Reglas de Woodward-Hoffmann
Las reglas de Woodward-Hoffmann, propuestas por Robert Burns Woodward y Roald Hoffmann, son un conjunto de reglas en química orgánica que predicen la estereoquímica de las reacciones pericíclicas, basándose en la simetría de los orbitales. Estas incluyen a las reacciones electrocíclicas, cicloadiciones, y reacciones sigmatrópicas. Por este trabajo, en 1981 Hoffmann fue galardonado con el Premio Nobel de Química, compartiéndolo con Kenichi Fukui, quien desarrolló un modelo similar, mientras que Woodward había muerto dos años antes, por lo que no era elegible para ganar el que hubiera sido su segundo Premio Nobel de Química.
Reacción electrocíclica
Las reglas se aplican a la estereoespecificidad de las reacciones electrocíclica de apertura de anillo y cierre de anillo en el extremo de los polienos conjugados de cadena abierta, tanto por aplicación de calor (reacciones térmicas) o por aplicación de luz (reacciones fotoquímicas). En la publicación original de 1965,[1] fueron establecidas tres reglas como:
- En un sistema de cadena abierta que contiene 4n electrones, la simetría de orbital del orbital molecular ocupado más alto en el estado fundamental es tal que una interacción enlazante entre los extremos debe involucrar el traslape entre las regiones de los orbitales en caras opuestas del sistema, y esto puede lograrse solamente mediante un proceso conrotatorio. Un ejemplo de este tipo de reacción es la reacción de ciclización de Nazarov de las divinilcetonas.
- En sistemas abiertos que contienen 4n + 2 electrones, la interacción terminal de enlace entre moléculas en estado basal requiere el traslape de las regiones de los orbitales de la misma cara del sistema, y esto es alcanzable solo por desplazamientos disrotatorios.
- En una reacción fotoquímica, un electrón en el HOMO del reactante es promovido a un estado excitado, conduciendo a la inversión de las relaciones de simetría terminal, y la inversión de la estereoespecificidad.
Se dice que las reacciones orgánicas que obedecen estas reglas están permitidas por la simetría. Las reacciones que toman el curso contrario son prohibidas por la simetría y requieren mucha más energía para que tengan lugar, si es que llegan a darse.
Las reglas predicen el desenlace de varias reacciones en el estado basal:
- Catión ciclopropilo - catión alilo: disrotatorio
- Radical ciclopropilo - radical alilo: conrotatorio
- Anión ciclopropilo - anión alilo: conrotatorio
- Catión ciclopentadienilo - catión pentadienilo: conrotatorio.
Las reglas mostradas son apoyadas por cálculos teóricos usando el método de Hückel extendido. Por ejemplo, la energía de activación requerida para el la reacción térmica de cierre de anillo del butadieno puede ser calculada como una función de los ángulos de enlace C-C-C, manteniendo las otras variables constantes. Los ángulos mayores de 117° muestran una ligera preferencia para una reacción disrotatoria, pero con ángulos menores se prefiere una reacción conrotatoria.
Una publicación reciente describe cómo puede usarse la tensión mecánica para reformar la trayectoria de una reacción química, para conducir a productos que aparentemente violan las reglas de Woodward-Hoffmann.[2]
Controversia
Se ha señalado que el químico E.J. Corey considera que él es el responsable por las ideas que condujeron a realizarse esta investigación, y que Woodward injustamente rechazó darle el crédito respectivo en el descubrimiento. En una memoria publicada en el 2004 en el Journal of Organic Chemistry,[3] Corey reclamaba su aportación en la elaboración reglas: "El 4 de mayo de 1964, le sugerí a mi colega R. B. Woodward una explicación sencilla de las conversiones estereoselectivas de ciclobuteno a 1,3-butadieno y de 1,3,5-hexatrieno a ciclohexadieno en la que implicaba la simetría de los orbitales moleculares tipo HOMO, lo que proporcionó la base para idear lo que posteriormente ha sido conocido como las reglas de Woodward–Hoffmann".
Según Corey, que por aquel entonces tenía 35 años, estaba trabajando la noche del lunes 4 de mayo, al igual que Woodward y otros químicos. Hacia las 8:30 p. m., él pasó por la oficina de Woodward, y Woodward le planteó una pregunta sobre cómo predecir el tipo de anillo que formaría una cadena de átomos. Después de algunas discusiones, Corey propuso que la configuración electrónica fuera la que dirigiera el transcurso de la reacción. Aunque Woodward rechazó esta propuesta, Corey dejó algunos esquemas en la oficina, convencido de que estaba en lo cierto.[4]
Sentí que esto iba a resultar en un desarrollo realmente interesante, y esperaba poder colaborar en el asunto, escribió. Pero al día siguiente, Woodward entró a la oficina de Corey, mientras él y un colega habían ido a almorzar, y presentando a otros compañeros, como suya (de Woodward), la idea que había tenido Corey. Corey se quedó conmocionado. Dos días después, Woodward habría expuesto la idea en una reunión del grupo.
En una publicación revindicadora del 2004 en Angewandte Chemie,[5] Roald Hoffmann negó la declaración de Corey, al referirse a Woodward a partir de una lectura dada en 1966, diciendo: RECUERDO muy claramente, y aún me sorprende ello, el destello crucial de luz que vino hacia mí de una forma algebraica, en vez de pictórica o geométrica. A partir de la idea principal, se me ocurrió que los coeficientes de los términos extremos en la expresión matemática que representa al orbital molecular ocupado más alto del butadieno eran de signo opuesto, mientras que los que corresponden a la expresión del hexatrieno poseían el mismo signo. De ahí, había un paso corto a la visión geométrica, y químicamente más relevante, de que en la ciclización interna de un dieno, la cara superior de un átomo terminal debería atacar la cara inferior del otro, mientras que en el caso del trieno, la formación de un nuevo enlace debería involucrar a ambas caras superiores (o también a la vez las inferiores) de ambos átomos terminales.
Además, Hoffmann señaló que en 2 publicaciones de 1963[6] y 1965,[7] Corey describió una síntesis total del compuesto dihidrocostunolida. Aunque en ella se describe una reacción electrocíclica, Corey no tiene nada qué ofrecer con respecto a explicar su estereoespecificidad. Más aún, es decepcionante que Corey no haya dicho nada de "su" idea por casi 2 décadas después de la muerte de Woodward.
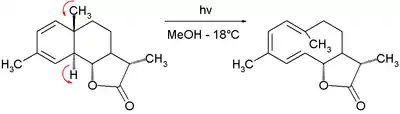
Esta reacción fotoquímica que involucra 4*1+2 electrones es reconocida ahora como conrotatoria.
Véase también
- Reglas de Woodward-Fieser para calcular las absorciones UV
Enlaces externos
- Symmetry rules!, Sophie Wilkinson Chemical & Engineering News January 27, 2003 Volume 81, Number 04 CENEAR 81 04 pp. 59 ISSN 0009-2347 Article
- "SHMO calculator", Simple Huckel molecular orbital theory calculator Link
Referencias
- Stereochemistry of Electrocyclic Reactions R. B. Woodward, Roald Hoffmann J. Am. Chem. Soc.; 1965; 87(2); 395-397. doi 10.1021/ja01080a054
- "Biasing Reaction Pathways with Mechanical Force. Nature (2007) 446:423-427" (See also the corresponding "News and Views" in the same issue of Nature)
- Impossible Dreams E. J. Corey J. Org. Chem.; 2004; 69(9) pp 2917 - 2919; (Perspective) doi 10.1021/jo049925d
- «Whose idea was it? - The Boston Globe».
- A Claim on the Development of the Frontier Orbital Explanation of Electrocyclic Reactions Roald Hoffman; Angew. Chem. Int. Ed.; 2004; 43; 6586-6590. doi 10.1002/anie.200461440
- Total Synthesis of Dihydrocostunolide E. J. Corey and Alfred G. Hortmann J. Am. Chem. Soc. 85 1963 pp 4033 - 4034; doi 10.1021/ja00907a030
- The Total Synthesis of Dihydrocostunolide E. J. Corey, Alfred G. Hortmann J. Am. Chem. Soc.; 1965; 87(24); 5736-5742. doi 10.1021/ja00952a037