SWI/SNF
La familia SWI/SNF (de sus siglas en inglés "SWItch/Sucrose Non Fermentable")[1][2] es un complejo proteico remodelador del empaquetamiento del ADN en los nucleosomas, en organismos eucariotas. También se define como una subfamilia de complejos remodeladores de la cromatina dependientes de ATP y, en levaduras, se compone de diversas proteínas codificadas por los genes swi y snf (en levaduras: SWI1, SWI2/SNF2, SWI3, SWI5 y SWI6), así como de otros polipéptidos.[3]
| Snf2 (ATPasa unida a un nucleosoma) | ||
|---|---|---|
 Reconstrucción de Snf2 ATPasa de S. cerevisiae formando un complejo con un nucleosoma (Obtenido mediante Cryo-EM) | ||
| Identificadores | ||
| Símbolo | Snf2 | |
| Pfam | PF00176 | |
| InterPro | IPR000330 | |
| SMART | DEXDc | |
| SCOP | 5x0x | |
Este complejo posee actividad ATPasa estimulada por ADN, pudiendo desestabilizar las interacciones histonas-ADN de un modo dependiente de ATP, aunque la naturaleza exacta de este cambio estructural aún no se conoce. Se cree que su mecanismo de acción se basa en la eyección y/o deslizamiento de los nucleosomas, reordenándolos y permitiendo así la apertura de la cromatina, lo cual permite la activación o represión de genes.[4]
En humanos existen los análogos BRG1 (también llamado factor asociados a BRM o BAF) y PBAF (BAF asociado a Polibromo).[5][6] También, en el género Drosophila, existen los análogos BAP (Proteína asociada a Brahma) y PBAP (BAP asociado a Polibromo).[7]
Miembros de la familia
A continuación se muestra una lista de los miembros de la familia SWI/SNF descritos y sus correspondientes ortólogos humanos[8] y de Drosophila:[9]
| Levadura | Humano | Drosophila | Función |
|---|---|---|---|
| SWI1 | ARID1A, ARID1B | OSA | Contiene motivos de unión LXXLL de receptor nuclear |
| SWI2/SNF2 | SMARCA2, SMARCA4 | BRM | Remodelación de la cromatina dependiente de ATP |
| SWI3 | SMARCC1, SMARCC2 | Moira/BAP155 | Secuencia similar, función desconocida |
| SWP73/SNF12 | SMARCD1, SMARCD2, SMARCD3 | Secuencia similar, función desconocida | |
| SWP61/ARP7 | ACTL6A, ACTL6B | Proteína semejante a actina | |
| SNF5 | SMARCB1 | SNR1 | Remodelación de la cromatina dependiente de ATP |
Estructura del complejo SWI/SNF
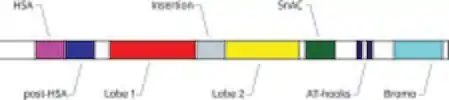
Estudios de microscopía electrónica del complejo proteico SWI/SNF revelaron estructuras grandes y lobuladas de 1,1-1,13 MDa.[10][11][12][13] Estas proteínas se asemejan a RecA, cubriendo ambos lados de una sección evolutivamente conservada correspondiente al dominio con actividad ATPasa. Este también incluye un dominio HSA, localizado en el extremo N-terminal y capaz de unirse a la actina.[4] Existe un bromodominio capaz de reconocer y unirse a lisinas acetiladas.[7] Hasta la fecha no se ha podido obtener una estructura a nivel atómico de todo el complejo SWI/SNF, debido a que este se compone de muchas subunidades altamente dinámicas. En particular, la subunidad ATPasa SNF2, cuya estructura ha sido obtenida mediante criomicroscopía electrónica (Cryo-EM), demuestra que el ADN del nucleosoma se encuentra localmente deformado en el sitio de unión.[14] Se han comprobado características similares en la subunidad ATPasa SMARCA4 en mamíferos, teniendo en cuenta el alto grado de homología con la subunidad SNF2 de levadura.[15] También se ha resuelto la estructura entre las dos subunidades BAF155 (SMARCC1) y BAF47 (SMARCB1), aportando información sobre los mecanismos de ensamblado del complejo SWI/SNF.[16]
Mecanismo de acción
Se ha descrito que el complejo SWI/SNF (en levaduras) es capaz de alterar la posición de los nucleosomas a lo largo del ADN.[17] Se han propuesto dos mecanismos para la remodelación de los nucleosomas mediada por SWI/SNF.[18]
- El primer modelo propone que una difusión unidireccional de un defecto en el enrollamiento del ADN alrededor del nucleosoma resulta en una extensión del ADN sobre la superficie del octámero que permite la entrada del ADN al sitio de unión con el nucleosoma.
- El segundo modelo es denominado mecanismo de "protuberancia" o de "recaptura de bucle" e implica la disociación del ADN en el límite del nucleosoma, con una reasociación del ADN dentro del nucleosoma, formando así una protuberancia de ADN sobre la superficie del octámero. El bucle de ADN se propagaría entonces a lo largo de toda la superficie del octámero de histonas como si fuera una ola. De este modo, el ADN se posicionaría de nuevo sin cambios en el número total de contactos ADN-histona.[19] Un reciente estudio ha proporcionado nuevas evidencias en contra del mecanismo de difusión del giro, apoyando así al mecanismo de "recaptura de bucle", el cual ha sido esquematizado en la figura que se muestra abajo.[20]
Véase también
- Complejo remodelador de la cromatina (RSC)
- Corregulador transcripcional
Referencias
- Neigeborn L, Carlson M (1984). «Genes affecting the regulation of SUC2 gene expression by glucose repression in Saccharomyces cerevisiae». Genetics 108 (4): 845-58. PMID 6392017.
- Stern M, Jensen R, Herskowitz I (1984). «Five SWI genes are required for expression of the HO gene in yeast». J. Mol. Biol. 178 (4): 853-68. PMID 6436497. doi:10.1016/0022-2836(84)90315-2.
- Pazin MJ, Kadonaga JT (1997). «SWI2/SNF2 and related proteins: ATP-driven motors that disrupt protein-DNA interactions?». Cell 88 (6): 737-40. PMID 9118215. doi:10.1016/S0092-8674(00)81918-2.
- Clapier, Cedric R.; Iwasa, Janet; Cairns, Bradley R.; Peterson, Craig L. (2017-07). «Mechanisms of action and regulation of ATP-dependent chromatin-remodelling complexes». Nature Reviews Molecular Cell Biology (en inglés) 18 (7): 407-422. ISSN 1471-0080. PMC 8127953. PMID 28512350. doi:10.1038/nrm.2017.26. Consultado el 9 de septiembre de 2022.
- Nie, Zuqin; Yan, Zhijiang; Chen, Everett H.; Sechi, Salvatore; Ling, Chen; Zhou, Sharleen; Xue, Yutong; Yang, Dafeng et al. (15 de abril de 2003). «Novel SWI/SNF Chromatin-Remodeling Complexes Contain a Mixed-Lineage Leukemia Chromosomal Translocation Partner». Molecular and Cellular Biology (en inglés) 23 (8): 2942-2952. ISSN 0270-7306. PMC 152562. PMID 12665591. doi:10.1128/MCB.23.8.2942-2952.2003. Consultado el 9 de septiembre de 2022.
- He, Shuang; Wu, Zihan; Tian, Yuan; Yu, Zishuo; Yu, Jiali; Wang, Xinxin; Li, Jie; Liu, Bijun et al. (21 de febrero de 2020). «Structure of nucleosome-bound human BAF complex». Science (en inglés) 367 (6480): 875-881. ISSN 0036-8075. doi:10.1126/science.aaz9761. Consultado el 9 de septiembre de 2022.
- Tang, Liling; Nogales, Eva; Ciferri, Claudio (1 de junio de 2010). «Structure and function of SWI/SNF chromatin remodeling complexes and mechanistic implications for transcription». Progress in Biophysics and Molecular Biology (en inglés) 102 (2): 122-128. ISSN 0079-6107. PMC 2924208. PMID 20493208. doi:10.1016/j.pbiomolbio.2010.05.001. Consultado el 9 de septiembre de 2022.
- Collingwood TN, Urnov FD, Wolffe AP (1999). «Nuclear receptors: coactivators, corepressors and chromatin remodeling in the control of transcription». J. Mol. Endocrinol. 23 (3): 255-75. PMID 10601972. doi:10.1677/jme.0.0230255.
- Table 1 The different components in the yeast, Drosophila and mammalian SWI/SNF complex (en inglés). Consultado el 9 de septiembre de 2022.
- Asturias, Francisco J.; Chung, Wen-Hsiang; Kornberg, Roger D.; Lorch, Yahli (15 de octubre de 2002). «Structural analysis of the RSC chromatin-remodeling complex». Proceedings of the National Academy of Sciences (en inglés) 99 (21): 13477-13480. ISSN 0027-8424. PMC 129698. PMID 12368485. doi:10.1073/pnas.162504299. Consultado el 9 de septiembre de 2022.
- Leschziner, Andres E.; Saha, Anjanabha; Wittmeyer, Jacqueline; Zhang, Yongli; Bustamante, Carlos; Cairns, Bradley R.; Nogales, Eva (20 de marzo de 2007). «Conformational flexibility in the chromatin remodeler RSC observed by electron microscopy and the orthogonal tilt reconstruction method». Proceedings of the National Academy of Sciences (en inglés) 104 (12): 4913-4918. ISSN 0027-8424. PMC 1820885. PMID 17360331. doi:10.1073/pnas.0700706104. Consultado el 9 de septiembre de 2022.
- Smith, Corey L.; Horowitz-Scherer, Rachel; Flanagan, Joan F.; Woodcock, Christopher L.; Peterson, Craig L. (2003-02). «Structural analysis of the yeast SWI/SNF chromatin remodeling complex». Nature Structural Biology (en inglés) 10 (2): 141-145. ISSN 1545-9985. doi:10.1038/nsb888. Consultado el 9 de septiembre de 2022.
- Chaban, Yuriy; Ezeokonkwo, Chukwudi; Chung, Wen-Hsiang; Zhang, Fan; Kornberg, Roger D.; Maier-Davis, Barbara; Lorch, Yahli; Asturias, Francisco J. (2008-12). «Structure of a RSC–nucleosome complex and insights into chromatin remodeling». Nature Structural & Molecular Biology (en inglés) 15 (12): 1272-1277. ISSN 1545-9985. PMC 2659406. PMID 19029894. doi:10.1038/nsmb.1524. Consultado el 9 de septiembre de 2022.
- Liu, Xiaoyu; Li, Meijing; Xia, Xian; Li, Xueming; Chen, Zhucheng (2017-04). «Mechanism of chromatin remodelling revealed by the Snf2-nucleosome structure». Nature (en inglés) 544 (7651): 440-445. ISSN 1476-4687. doi:10.1038/nature22036. Consultado el 9 de septiembre de 2022.
- Hodges, H. Courtney; Stanton, Benjamin Z.; Cermakova, Katerina; Chang, Chiung-Ying; Miller, Erik L.; Kirkland, Jacob G.; Ku, Wai Lim; Veverka, Vaclav et al. (2018-01). «Dominant-negative SMARCA4 mutants alter the accessibility landscape of tissue-unrestricted enhancers». Nature Structural & Molecular Biology (en inglés) 25 (1): 61-72. ISSN 1545-9985. PMC 5909405. PMID 29323272. doi:10.1038/s41594-017-0007-3. Consultado el 9 de septiembre de 2022.
- Yan, Li; Xie, Si; Du, Yongming; Qian, Chengmin (2 de junio de 2017). «Structural Insights into BAF47 and BAF155 Complex Formation». Journal of Molecular Biology (en inglés) 429 (11): 1650-1660. ISSN 0022-2836. doi:10.1016/j.jmb.2017.04.008. Consultado el 9 de septiembre de 2022.
- Whitehouse I, Flaus A, Cairns BR, White MF, Workman JL, Owen-Hughes T (agosto de 1999). «Nucleosome mobilization catalysed by the yeast SWI/SNF complex». Nature 400 (6746): 784-7. PMID 10466730. doi:10.1038/23506.
- van Holde K, Yager T (2003). «Models for chromatin remodeling: a critical comparison». Biochem. Cell Biol. 81 (3): 169-72. PMID 12897850. doi:10.1139/o03-038.
- Flaus A, Owen-Hughes T (2003). «Mechanisms for nucleosome mobilization». Biopolymers 68 (4): 563-78. PMID 12666181. doi:10.1002/bip.10323.
- Zofall M, Persinger J, Kassabov SR, Bartholomew B (2006). «Chromatin remodeling by ISW2 and SWI/SNF requires DNA translocation inside the nucleosome». Nat. Struct. Mol. Biol. 13 (4): 339-46. PMID 16518397. doi:10.1038/nsmb1071.