Tembladera
La tembladera o scrapie es una enfermedad fatal y neurodegenerativa que afecta el sistema nervioso de ovejas y cabras.[1] Pertenece a la familia de las encefalopatías espongiformes transmisibles (EET), la cual incluye a la encefalopatía espongiforme bovina (EEB) o enfermedad de la vaca loca y la caquexia crónica en venados y alces. Como otras encefalopatías espongiformes transmisibles, la tembladera es causada por un prion.[2] Se tienen registros de tembladera desde 1732.[3][4]

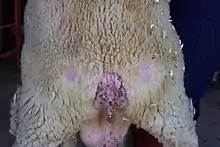
El nombre en inglés, scrapie, se deriva de un signo clínico de la enfermedad, donde los animales afectados se frotan de manera compulsiva contra rocas, árboles o cercas, con lo que se les cae la lana. El nombre en español, tembladera, se deriva de otro de los signos clínicos de la enfermedad, en el que las ovejas tiemblan de manera incontrolable. La enfermedad aparentemente provoca una sensación de picazón en los animales. Otros signos clínicos incluyen chasquido de labios, alteraciones en el andar y convulsiones.[5]
Suele afectar a ovejas de tres a cinco años. La capacidad de transmisión al nacer y por contacto con tejido placentario es evidente. No existe evidencia que indique que la tembladera es transmisible a humanos.[6]
Entrada de los priones
La proteína entra a través del intestino o de cortes en la piel. Los priones provocan que las proteínas normales de las ovejas cambien su conformación tridimensional. Estas proteínas se acumulan gradualmente en el cuerpo, especialmente en las células nerviosas, que terminan por morir. Cuando los priones son absorbidos por el intestino, se presentan primero en los ganglios linfáticos, especialmente en las placas de Peyer en el intestino delgado.[7]
Un experimento demostró que los corderos corren el riesgo de infectarse por medio del consumo de leche de ovejas infectadas,[8] aunque los corderos del experimento contagiaron a otros por lo que el riesgo de infección fue difícil de evaluar. El experimento no duró lo suficiente como para demostrar que los corderos presentaban síntomas a pesar de que el prion estaba presente en sus cuerpos.
Signos clínicos y diagnóstico
Los cambios son ligeros al principio; pequeños cambios en el comportamiento y un incremento en los movimientos de mascado pueden presentarse. Más adelante se desarrollan signos neurológicos como la ataxia y la oveja afectada comienza a tener problemas para seguirle el paso al rebaño.[6]
Algunas ovejas se rascan en exceso lo que provoca que en varias zonas de su cuerpo haya pérdidas de lana y lesiones en la piel. Rascar a la oveja en la parte trasera puede resultar en que el animal empiece a mordisquear , lo cual es característico de la condición.[6]
Signos de enfermedad sistémica crónica se presentan más tarde, junto con la pérdida de peso, anorexia, letargo y posiblemente la muerte.[6]
El examen post mortem es indispensable para el diagnóstico de la tembladera. Estudios histológicos muestran acumulación de priones en el sistema nervioso central. Ensayos inmunohistoquímicos y pruebas ELISA también pueden utilizarse para probar la presencia de la proteína.
Tratamiento y prevención
No existe tratamiento para las ovejas afectadas.[6] Actualmente ya está disponible una prueba que hace uso de una muestra de tejido linfático de la membrana nictitante.[9]
En el Reino Unido, el gobierno puso en marcha el National Scrapie Plan, el cual fomenta la reproducción entre ovejas genéticamente más resistentes a la tembladera. Con esto se pretende reducir eventualmente la incidencia de la enfermedad en las ovejas del Reino Unido. Existen registros de tembladera en Europa y Estados Unidos y a la fecha Australia y Nueva Zelanda (ambos grandes productores de ovejas) se encuentran libres de la enfermedad.
Razas como la Cheviot y la Suffolk son más susceptibles a la tembladera que otras razas.[10] Esto está determinado por genes que codifican para proteínas prionicas naturales. Las razas más resistentes son homocigotos para el gen ARR, mientras que las ovejas con la versión VRQ del alelo son más susceptibles.[11] Esto se puede determinar mediante una simple prueba de sangre y actualmente muchos países están intentando eliminar este alelo por medio de cría selectiva.
Por miedo a la encefalopatía espongiforme bovina, muchos países europeos prohibieron productos tradicionales hechos a partir de oveja o cabra sin haber retirado la médula espinal, tales como el smalahove y el smokie.[12]
En 2010, un grupo de investigadores de Nueva York lograron detectar la presencia de PrPSc incluso en tejido cerebral donde se encontraba originalmente presente en una proporción de uno a cien mil millones (10−11). El método utilizado combina la amplificación (PMCA) con una nueva tecnología conocida como Surround Optical Fiber Immunoassay (SOFIA) y anticuerpos específicos contra PrPSc. Después de amplificar y concentrar cualquier PrPSc presente, las muestras son marcadas con un fluorocromo usando un anticuerpo para la especificidad y finalmente son cargados a un tubo microcapilar. Este tubo se coloca en un aparato construido especialmente para que el tubo esté rodeado de fibra óptica que capta toda luz emitida por el fluorocromo una vez que es excitado por medio de un láser. Esta técnica hizo posible la detección de PrPSc después de un menor número de ciclos que otras técnicas, reduciendo sustancialmente la posibilidad de error y acelerando el ensayo. Los investigadores también probaron el método en muestras de sangre de ovejas aparentemente saludables que después presentaron tembladera. Los cerebros de los animales fueron analizados una vez que alguno de los síntomas se presentó. Por lo tanto, pudieron comparar los resultados de las muestras de sangre y de tejido cerebral una vez que los animales presentaron síntomas de la enfermedad, con muestras de sangre de los mismos animales antes de los síntomas y con muestras de animales no infectados. Los resultados mostraron claramente que las PrPSc se podían detectar en muestras de sangre de animales mucho antes de que aparecieran los primeros síntomas. Con un mayor desarrollo, este método podría ser de gran utilidad en la detección temprana de tembladera a partir de sangre y orina.[13][14]
Transmisión y vías de exposición
Varios estudios han indicado que los priones (PrPSC) que causaron en las ovejas y cabras la encefalopatía espongiforme transmisible conocida como tembladera, son capaces de persistir en el suelo por años sin perder su capacidad patogénica.[15] Los priones en el ambiente pueden provenir de diferentes fuentes: principalmente, placenta o líquido amniótico de ovejas infectadas así como de su saliva y excremento.
Sólo se pueden hacer análisis confirmatorios mediante la aplicación de ensayos inmunohistoquímicos de priones asociados con la enfermedad (PrPSC) de tejido obtenido post mortem, incluyendo el obex cerebral, los ganglios linfáticos retrofaríngeos y la tonsilla palatina. Una prueba diagnóstica, no confirmatoria, para animales vivos a base de tejido linfático obtenido de una biopsia rectal, y mediante el uso de inmunohistoquímica, fue aprobada por el Departamento de Agricultura de los Estados Unidos (USDA) en 2008.
La transmisión de tembladera en el campo aparentemente se da por a través del tracto gastrointestinal en la mayoría de los casos, y rebaños libres de tembladera pueden infectarse en pastos donde antes se dio un brote de tembladera. Estos hallazgos apuntan a un contagio ininterrumpido gracias al ambiente, particularmente por el suelo.[16]
La concentración de priones en fluidos como la placenta no alteran la infectividad de los priones. Ciervas y ovejas infectadas natural o experimentalmente transmiten la enfermedad a sus crías, incluso cuando las placentas tienen una cantidad muy pequeña de PrPSC. La PrPSC es depositada en un porcentaje más alto en la placenta de ovejas (52-72 %) que en la placenta de cabras (5-10 %) según estudios realizados por el Servicio de Investigación Agrícola del Departamento de Agricultura de los Estados Unidos.[17]
Se ha reportado presencia de PrPSC en las heces de ovejas tanto en etapas terminales como en etapas preclínicas de la enfermedad, lo que sugiere que los priones se pueden depositar en el ambiente mediante la patogénesis. Se han considerado distintas fuentes de priones para explicar su presencia en las heces, incluyendo la ingestión de saliva infectada; sin embargo, es más probable que provengan de desprendimientos de tejido linfático del tracto intestinal. Los rumiantes tienen placas de Peyer especializadas que, a lo largo del íleon, contienen alrededor de 100 000 folículos, y todos estos pueden infectarse y expulsar priones hacia el lumen.[18] Se han encontrado priones causantes de tembladera en las placas de Peyer de corderos infectados de manera natural de hasta cuatro meses.
Exposición a suelo contaminado
La ingesta de suelo por ovejas pastando ha sido medida en dos tipos de suelo, dos cargas ganaderas diferentes y en más de dos estaciones de pastoreo. Los animales consumieron hasta 44 g (gramos) de suelo por kilogramo de peso corporal entre mayo y noviembre. La lluvia y la carga ganadera surgieron como factores que influyen en el consumo. El efecto del tipo de suelo y de vegetación fue menos evidente.[19]
El promedio de peso de una oveja adulta es de alrededor de 250 libras (113 kg).[20] Si una oveja adulta come 400 g por kilogramo de suelo como predijo D. McGrath et al., la oveja promedio habrá ingerido alrededor de 45 000 g al final de seis meses, o 251 g por día. Asumiendo que el suelo está contaminado con priones PrPSC de las heces o fluidos de otras ovejas, muy posiblemente la oveja terminaría infectada. La concentración de priones es incierta, y no es directamente proporcional a la infectividad. Se ha demostrado que los factores que afectan a la infectividad de los priones en el suelo incluyen la cantidad de tiempo que estuvieron en el suelo y sus capacidades de unirse al mismo.
Para una evaluación de riesgo más detallada de tener suelo contaminado con priones causantes de tembladera, era de gran importancia analizar si la mínima cantidad detectable de PrPSc en extractos de suelo presentaba infectividad oral después de hasta 29 meses de incubación. Se realizó un ensayo biológico con un hámster sirio alimentando a los animales con suelo contaminado o con soluciones acuosas de extractos de suelo que fueron recolectados después de 26 y 29 meses de incubación, respectivamente. Los animales alimentados con suelo contaminado presentaron los primeros síntomas asociados a la tembladera entre las 2 semanas y los 6 meses (95 % CI) después de la primera aplicación. Los hámsteres alcanzaron la etapa terminal de tembladera entre los meses 5 y 21 (95 % CI) después de haber sido alimentados. Esto indica que persisten cantidades considerables de priones infecciosos en el suelo después de haberse incubado por 26 y 29 meses.[16] En Islandia en 1978, se implementó un programa destinado a erradicar la tembladera y los rebaños afectados fueron sacrificados, las instalaciones fueron desinfectadas y los establos y rediles fueron quemados; después de dos o tres años las instalaciones fueron reabastecidas con corderos de áreas libres de tembladera. Entre 1978 y 2004, se volvió a presentar en 33 granjas. Entre 14 y 21 años después del sacrificio se volvió a presentar como resultado de la contaminación ambiental.[21]
La capacidad de los priones de unirse a diferentes tipos de suelo ha demostrado incrementar la penetrancia de la enfermedad. Los priones se unen a suelo que contiene montmorillonita y caolinita más fácilmente que a aquellos suelos con cuarzo.[22] La mejora de transmisibilidad de los priones unidos al suelo podría explicar la propagación ambiental de la tembladera a pesar de los bajos niveles en suelo. El mecanismo por el cual la montmorillonita y otros componentes del suelo mejoran la transmisibilidad de los priones sigue sin esclarecerse. Los priones unidos a montmorillonita y otros componentes del suelo podrían ser parcialmente protegidos contra desnaturalización o proteólisis en el tracto digestivo, permitiendo que el animal absorba una cantidad mayor de priones. La adsorción de suelo con PrPSc puede alterar el estado de agregación de la proteína, cambiando la distribución de tamaño a una proteína priónica más infecciosa, por lo tanto incrementando la cantidad de unidades infecciosas. Para que las enfermedades por priones se transmitan por medio de la ingesta de suelo contaminado, los priones deben mantener su capacidad infecciosa a través del conducto bucal. Investigadores de la Universidad de Wisconsin investigaron la infectividad oral de la montmorillonita y los priones unidos a partículas de suelo. Los efectos de la fuente de los priones (homogenado de cerebro infectado y priones purificados) y la dosis en la penetrancia de la enfermedad (la proporción de animales que finalmente presentaron signos clínicos de tembladera) y el tiempo de incubación fueron evaluados. Alrededor de 38 % de los animales que recibieron 200 g de PrPSc pura oralmente presentaron síntomas clínicos con un tiempo de incubación en animales enfermos de 203 a 633 días. Por el contrario, todos los animales que consumieron vía oral la misma cantidad de PrPSc unida a montmorillonita manifestaron síntomas de la enfermedad entre los 195 y los 637 días. Los animales que recibieron únicamente montmorillonita o una décima parte de PrPSc pura (20 g) se mantuvieron sin presentar síntomas durante todo el estudio. Estos datos sugieren que los priones unidos a montmorillonita mantienen su capacidad infecciosa a través del tracto gastrointestinal, pero que la unión a montmorillonita incrementa la penetrancia de la enfermedad, incrementando la eficiencia de la transmisión oral.[23]
Resumen sobre la transmisión
Los priones (PrPSc) se desprenden de los fluidos, como la placenta y heces de ovejas y cabras. La concentración de priones es incierta, pero no es directamente proporcional a la infectividad. Las ovejas ingieren tierra al pastar, por lo que el suelo representa una posible reserva de priones, los cuales pueden permanecer en el ambiente durante años. La longevidad de los priones y su unión a partículas de tierra muy posiblemente influye en su persistencia e infectividad en el ambiente.
Actualmente hacen falta métodos para inactivar efectivamente a los priones, y los efectos de los mecanismos de degradación natural en la infectividad de priones se desconocen. Se requiere de una mejor comprensión del proceso que afecta su movilidad, persistencia y biodisponibilidad en el suelo para el correcto manejo de ambientes contaminados con priones. Un sistema para estimar la capacidad de unión de los priones al suelo en granjas, a partir de sencillos análisis del suelo, permitirían conocer el riesgo que representa un ambiente con priones y si el uso de remediadores de suelo o abonado de cobertura podrían ayudar a mitigar la capacidad infecciosa de los priones. El liquen lobaria pulmonaria podría tener la capacidad de reducir el número de priones dado que algunas especies contienen peptidasas que parecen descomponer a los priones. Se ha garantizado realizar trabajos de clonación y caracterización de estas peptidasas así como la evaluación de los efectos sobre la infectividad de los priones y la determinación del liquen que produce la peptidasa que altera a los priones.[24]
Referencias
- Detwiler LA (1992). «Scrapie». Rev. - Off. Int. Epizoot. 11 (2): 491-537. PMID 1617202.
- Hunter N (2007). «Scrapie: uncertainties, biology and molecular approaches». Biochim. Biophys. Acta 1772 (6): 619-628. PMID 17560089. doi:10.1016/j.bbadis.2007.04.007.
- National Scrapie Education Initiative. «Scrapie Fact Sheet». National Institute for Animal Agriculture. Archivado desde el original el 12 de diciembre de 2020. Consultado el 4 de diciembre de 2011.
- Rolf, George. «From Sheep to Humans: Scrapie and Creutzfeldt-Jakob Disease». Ecclectica. Archivado desde el original el 27 de agosto de 2011. Consultado el 4 de diciembre de 2011.
- Foster JD, Parnham D, Chong A, Goldmann W, Hunter N (2001). «Clinical signs, histopathology and genetics of experimental transmission of BSE and natural scrapie to sheep and goats». Vet. Rec. 148 (6): 165-171. PMID 11258721. doi:10.1136/vr.148.6.165.
- Scrapie revisado y publicado por WikiVet, consultado el 12 de octubre de 2011.
- Tarmen viktig for skrapesyke - forskning.no
- Konold, Moore, Bellworthy, Simmons, "Evidence of scrapie transmission via milk", BMC Veterinary Research 2008, 4:16 doi 10.1186/1746-6148-4-16
- O'Rourke KI, Duncan JV, Logan JR, et al. (2002). «Active surveillance for scrapie by third eyelid biopsy and genetic susceptibility testing of flocks of sheep in Wyoming». Clin. Diagn. Lab. Immunol. 9 (5): 966-971. PMC 120069. PMID 12204945. doi:10.1128/CDLI.9.5.966-971.2002.
- Eddie Straiton, "Sheep Ailments - recognition and treatment", 7th edition (2001) ISBN 1-86126-397-X
- Synnøve Vatn, Lisbeth Hektoen, Ola Nafstad "Helse og Velferd hos sau" 1. utgave, Tun Forlag (2008) ISBN 978-82-529-3180-8
- Heim D, Kihm U (2003). «Risk management of transmissible spongiform encephalopathies in Europe». Rev. - Off. Int. Epizoot. 22 (1): 179-199. PMID 12793779.
- «Detecting Prions in Blood». Microbiology Today.: 195. agosto de 2010. Consultado el 21 de agosto de 2011.
- «SOFIA: An Assay Platform for Ultrasensitive Detection of PrPSc in Brain and Blood». SUNY Downstate Medical Center. Consultado el 19 de agosto de 2011.
- Saunders, Samuel E.; Shannon L. Bartelt-Hunt; Jason C. Bartz (Oct–Nov 2008/Dec). «Prions in the environment». Prion 2 (4): 162-169. doi:10.4161/pri.2.4.7951.
- Seidel, Bjoern; Thomzig A; Buschmann A; Groschup M; Peters R; Beekes M; Terytze K (9 de mayo de 2007). «Scrapie Agent (Strain 263K) Can Transmit Disease via the Oral Route after Persistence in Soil Over Years». PLOS ONE (5). doi:10.1371/journal.pone.0000435.
- O'Rourke, Catherine. «PP - USDA ARS».
- Terry, Linda; et al (18 de mayo de 2011). «Detection of Prions in the faeces of sheep naturally infected with classical scrapie». Veterinary Research 42 (65).
- McGrath, D; et al (1982). «Soil Ingestion by Grazing Sheep». Irish Journal of Agriculture.
- USDA, National Statistical Service. «Livestock Slaughter 2010».
- Georgsson, Gudmundu; et al (2006). «Infectious agent of sheep scrapie may persist in the environment for at least 16 years». Journal of General Virology.
- O'Rourke, Katherine. «USDA-ARS 2011».
- Pederson, Joel; et al (julio de 2007). «Oral transmissibility of prion disease is enhanced by binding to soil particles». Plos Pathog.
- Johnson, CJ; et al (2011). «Degradation of the disease-associated prion protein by a serine protease from lichens». PLOS ONE.
Enlaces externos
- Article about scrapie and the aforementioned diagnostic test
- UK government scrapie information
- UK government National Scrapie Plan
- Scrapie research at the Institute for Animal Health (UK)
- Sheep genetics research at the Institute for Animal Health (includes photo of a sheep with scrapie)
- Scrapie in the United States
- US Department of Agriculture video of infected sheep demonstrating Hopping Gait
- Striking a Nerve: Prions Not the Last Word in TSEs – opinion article by Frank Bastian that proposes a different causation for scrapie and other prion diseases