Physeter macrocephalus
El cachalote (Physeter macrocephalus) es una especie de mamífero marino del infraorden Cetacea del parvorden Odontoceti. El cachalote es el único miembro del género Physeter y es una de las tres especies vivientes de la familia Physeteridae, junto al cachalote pigmeo y cachalote enano.
| Cachalote | ||
|---|---|---|
 | ||
 | ||
| Estado de conservación | ||
 Vulnerable (UICN 3.1)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Subfilo: | Vertebrata | |
| Clase: | Mammalia | |
| Orden: | Artiodactyla | |
| Suborden: | Whippomorpha | |
| Infraorden: | Cetacea | |
| Parvorden: | Odontoceti | |
| Familia: | Physeteridae | |
| Género: |
Physeter Linnaeus, 1758 | |
| Especie: |
P. macrocephalus Linnaeus, 1758 | |
| Distribución | ||
.jpg.webp) Distribución de Physeter macrocephalus | ||
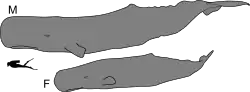
Es el animal con dientes más grande que existe; los machos pueden crecer hasta 20,5 metros de largo y llegar a pesar más de 50 toneladas. La cabeza mide un tercio de la longitud total del animal y poseen el cerebro más grande entre los animales existentes. La especie se alimenta de calamares y peces, sumergiéndose en su búsqueda a profundidades de hasta tres kilómetros, convirtiéndose en el mamífero marino que se zambulle a mayor profundidad. Su dieta a base de calamares incluye a las especies más grandes: el calamar gigante y el calamar colosal. Es el depredador viviente más grande y posiblemente el mayor que haya existido, no por el hecho de alimentarse de otros animales (lo cual también es cierto en todos los cetáceos, incluyendo las grandes ballenas), sino por realizar depredación activa sobre animales autónomos. El chasquido producido por el cachalote es el sonido más intenso producido por animal alguno, pero su función se desconoce (aunque se cree que lo usa como sonar y como un medio para aturdir a sus presas). Este cetáceo vive en grupos en los cuales las hembras y sus crías están separados de los machos más viejos que vagan solitarios; las hembras cooperan entre sí para proteger y alimentar a sus retoños. Dan a luz de cada tres a seis años una sola cría y su cuidado se prolonga por más de una década. Son animales muy longevos pudiendo alcanzar fácilmente los setenta años.
Entre principios del siglo XVII y hasta finales del siglo XX, el cachalote fue cazado intensamente para obtener el espermaceti y otros productos como aceite y ámbar gris. Como resultado de la caza intensiva en los siglos XIX y XX su número se redujo sustancialmente y se encuentra actualmente señalado como especie vulnerable por la UICN. El espermaceti se empleaba como insumo para elaborar velas, jabón, cosméticos y aceite para uso industrial. Debido a su gran tamaño, el cachalote en ocasiones era capaz de defenderse de los primeros balleneros; el caso más conocido fue el hundimiento del barco ballenero Essex en 1820.
Los cachalotes son animales sociales que se congregan en pequeñas manadas conformados por hembras, sus crías y algunos machos jóvenes. Los cachalotes prácticamente carecen de depredadores naturales, ya que ningún animal es lo suficientemente fuerte para atacar con éxito a un adulto saludable; sin embargo, las orcas atacando en grupo son capaces de matar crías y ejemplares débiles o enfermos. Se distribuye en todos los océanos prefiriendo las zonas templadas y las zonas aledañas a pendientes y cañones submarinos.
Nombre
El nombre «cachalote», según la RAE, viene del portugués cachalote, derivado de cachola «cabeza grande». Los franceses piensan que «cachalot» deriva del gascón «cachau» «grandes dientes». [2] El diccionario etimológico de Corominas dice que el origen de la palabra es incierto, pero se sugiere que viene del latín vulgar «cappula», plural de «cappulum», empuñadura de espada.[3]
Descripción
Tamaño
| Tamaño promedio | [4] Longitud | Peso |
|---|---|---|
| Macho | 16 m | 41 000 kg |
| Hembra | 11 m | 14 000 kg |
| Recién nacido | 4 m | 1000 kg |
El cachalote es el cetáceo dentado más grande que existe; los machos adultos pueden alcanzar hasta 20,5 metros de longitud y un peso de hasta 57 000 kilogramos.[5][6] La especie de cetáceo dentado que le sigue en tamaño es el zifio de Baird, con 12,8 metros de largo y 15 000 kilogramos de peso.[7] Sin embargo existe evidencia de ejemplares más grandes en el pasado. El ejemplar del museo de ballenas en la isla de Nantucket (Massachusetts, Estados Unidos) tiene una mandíbula de 5,5 metros de longitud. En el museo se afirma que este individuo tenía 24 metros de largo; mientras que el cachalote que hundió el ballenero Essex (uno de los incidentes que inspiró Moby-Dick) se estimó que tenía 26 metros.[8][9] La cacería intensiva pudo haber disminuido el tamaño promedio de los cachalotes, dado que los machos más grandes eran los más buscados y capturados, principalmente después de la Segunda Guerra Mundial.[9] En la actualidad, los machos no exceden con frecuencia los 18,3 metros de longitud y 51 000 kilogramos de peso.[4]
Se encuentra entre los cetáceos que presentan un dimorfismo sexual más evidente. Al momento del nacimiento ambos sexos tienen casi el mismo tamaño,[4] pero al alcanzar la madurez los machos tienen entre 30 y 50 por ciento de mayor longitud, triplican en peso a las hembras y alcanzan el mayor tamaño hacia los 50 años.[5]
Apariencia
El aspecto más distintivo del cachalote proviene de su enorme cabeza, la cual con frecuencia alcanza un tercio de la longitud del animal. El espiráculo se localiza muy cerca del extremo frontal de la cabeza, desplazado a la izquierda de la línea media.[5]

Las aletas posteriores del cachalote son triangulares y muy gruesas, y sobresalen fuera del agua cuando inician una inmersión.[5] Carecen de aleta dorsal, pero tienen una serie de crestas en el tercio caudal; la cresta más larga era llamada «hump» (joroba) por los balleneros y puede confundirse con una aleta dorsal debido a su forma.[4]
Al contrario del aspecto liso de la piel de la mayoría de las grandes cetáceos, la piel del dorso tiene un aspecto rugoso similar al aspecto de la cáscara de una ciruela pasa.[10] La piel tiene normalmente un color gris; sin embargo, bajo la luz del sol adquiere una coloración marrón. Al igual que en otros grandes cetáceos, existen numerosos avistamientos de ejemplares albinos.[11][12][13]
Mandíbulas y dientes

El cachalote tiene entre 20 y 26 dientes en cada una de las dos hileras de la mandíbula inferior.[5] Estos dientes poseen una forma cónica y llegan a pesar hasta un kilogramo cada uno.[14] El propósito de los dientes es desconocido, pues no parecen ser necesarios para capturar o comer calamares, ya que se tiene registro de animales bien alimentados que carecían de dentadura. Una posibilidad es que la dentadura se utilice como medio de agresión entre los machos ya que estos con frecuencia presentan numerosas cicatrices ocasionadas con dientes.[15] La mandíbula superior también cuenta con dientes pero son rudimentarios y raramente emergen hacia la cavidad oral.[16]
Respiración e inmersión
Los cachalotes, junto con los zifios calderones y los elefantes marinos, son los mamíferos marinos que se sumergen a mayor profundidad.[5] Se cree que son capaces de llegar hasta los tres kilómetros bajo la superficie y realizar inmersiones de hasta 90 minutos.[5][17] Sin embargo, lo más usual es que bajen a una distancia de 400 metros en inmersiones de 35 minutos de duración.[5] Con estas enormes inmersiones tienen el riesgo de ahogarse al quedar atrapados con cables submarinos.[18]
El cachalote está perfectamente adaptado a los enormes cambios de presión cuando se sumerge. Su caja torácica es muy flexible, permitiendo el colapso pulmonar, reduciendo la entrada de nitrógeno a los tejidos, y el metabolismo puede disminuir para conservar oxígeno.[19][20] La mioglobina, una proteína que almacena oxígeno en el músculo, es mucho más abundante que en los animales terrestres.[21] La sangre tiene alta densidad de glóbulos rojos, los cuales contienen el transportador de oxígeno hemoglobina. La sangre oxigenada puede dirigirse solamente hacia el cerebro y a otros órganos esenciales cuando los niveles de oxígeno disminuyen.[22][23][24] El órgano del espermaceti también puede desempeñar un papel para ajustar la flotabilidad.[25]
A pesar de que los cachalotes se encuentran bien adaptados para el buceo de profundidad, las inmersiones repetidas tienen efectos adversos a largo plazo. Los huesos muestran lesiones causadas por la descompresión rápida. Los esqueletos de individuos viejos muestran los daños más extensos, mientras que los esqueletos de individuos jóvenes no evidencian ninguna lesión. A pesar de estas adaptaciones, estos daños pueden indicar que estos animales son susceptibles a la descompresión, y el ascenso súbito a la superficie puede resultar letal para ellos.[26]
Entre inmersiones, sube a respirar por unos ocho minutos antes de la siguiente inmersión.[5] Como los demás odontocetos, respiran a través de un único espiráculo en forma de «S». Respiran de tres a cinco veces por minuto en reposo, incrementándose hasta seis a siete veces por minuto después de una inmersión. El soplido es único y ruidoso, con un chorro que se eleva hasta quince metros sobre la superficie y apunta hacia delante y la izquierda en un ángulo de 45°. En promedio, las hembras y los jóvenes respiran cada 12,5 segundos antes de sumergirse, en tanto que los machos grandes lo hacen cada 17,5 segundos antes de la inmersión.[27]
Esqueleto

El cráneo de este cetáceo es triangular y asimétrico en sus orificios y componentes óseos. Los maxilares son muy grandes, también tienen forma triangular y constituyen la mayor parte del esqueleto de la cabeza.[28]
La columna vertebral está formada por 49 vértebras, con cuatro secciones distinguibles: cervical, torácica, lumbar y caudal.[28]
Las costillas se adosan a la espina dorsal por medio de un cartílago, lo cual le proporciona la suficiente elasticidad al colapsarse debido a la alta presión de las profundidades.[29]
Cerebro y sentidos
El cerebro del cachalote es el más grande de cualquier animal moderno o extinto que se conozca, con un peso promedio de ocho kilogramos.[30][31] Sin embargo, no es muy grande en proporción al tamaño del cuerpo. Por ejemplo, los cachalotes tienen un cociente de encefalización menor que muchos delfines y ballenas, más bajo que los grandes simios y mucho menor que los humanos.[31][32]
Como otros odontocetos, los cachalotes usan la ecolocalización como un medio para encontrar comida debido a que su hábitat tiene condiciones acústicas favorables y la absorción de la luz por el agua y la turbidez limitan la visibilidad. El animal emite chasquidos de alta frecuencia enfocados en un ángulo amplio. Genera sonidos pasando aire desde los orificios nasales óseos a través de los labios fónicos, una estructura acústica dentro de la cabeza.[33] El cráneo, el melón y varios sacos de aire en la cabeza del animal juegan un papel importante en la transmisión de los sonidos y la mandíbula inferior actúa como una vía para la recepción de los ecos. Un canal continuo lleno de grasa transmite los sonidos al oído interno.[34]
Función del espermaceti
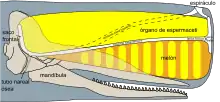
El órgano del espermaceti puede funcionar como un mecanismo de flotabilidad para el animal. Antes de iniciar la inmersión, el agua fría hace contacto con la estructura y solidifica el espermaceti;[25][35] esto induce un incremento en la densidad, lo cual genera una fuerza descendente de unos 40 kilogramos y permite al animal sumergirse con menos esfuerzo. Durante la cacería, el consumo de oxígeno genera calor y derrite el espermaceti, incrementando la flotabilidad y facilitándole el regreso a la superficie.[36]
Herman Melville, en su novela Moby-Dick, sugiere que el órgano del espermaceti evolucionó como un tipo de ariete para embestir durante las luchas entre machos.[37] Esta hipótesis coincide con los hundimientos, bien documentados, de los barcos balleneros Essex y Ann Alexander por atacantes con un peso estimado, como máximo, una quinta parte del peso de los navíos.[38]
Otra posibilidad es que el órgano ayude a la ecolocalización. La variación en la forma del órgano reduce o amplifica el sonido.[39]
El cachalote tiene dos orificios nasales. Una fosa externa forma el espiráculo y una interna presiona contra el compartimento que contiene el espermaceti. El órgano del espermaceti del macho es mucho más grande que el de las hembras. Esto puede ser un caso de selección sexual, impulsando a los machos a competir por las hembras usando despliegues sonoros.[40]
Ecología, comportamiento y modo de vida
Distribución
.jpg.webp)
El cachalote se encuentra entre las especies más cosmopolitas, prefiriendo las aguas no congeladas hasta los 1000 metros de profundidad.[1] Ejemplares de ambos sexos habitan los océanos y mares tropicales y templados; sin embargo, solo los machos adultos se encuentran en las latitudes más altas.[11]
Abunda relativamente desde los polos al ecuador y se encuentra en todos los océanos. Habita el mar Mediterráneo pero no el mar Negro,[4] mientras que su presencia en el mar Rojo es incierta.[1] Las entradas de baja profundidad tanto del mar Negro como el mar Rojo puede contribuir a su ausencia.[41] Las capas inferiores del mar Negro carecen de oxígeno y contienen altas concentraciones de compuesto de sulfuros como el sulfuro de hidrógeno lo que les impide adaptarse.[42]
Las poblaciones son densas cerca de las plataformas continentales y cañones submarinos.[11] Suelen encontrarse en aguas profundas de alta mar, pero pueden hallarse cerca de las costas en áreas donde la plataforma continental es pequeña y desciende abruptamente a profundidades de entre 310 y 920 metros.[4] Las zonas costeras que cuentan con las mayores poblaciones de esta especie son las aledañas a las islas Azores y la isla caribeña de Dominica.[43]
Reproducción
Los cachalotes pueden vivir 70 años o incluso más.[4][11][44] Son el ejemplo ideal de una especie que ha sido sometida a selección K, una estrategia reproductiva asociada con condiciones ambientales estables, una baja tasa de natalidad, ayuda significativa de los padres hacia las crías, maduración lenta y alta longevidad.[5]
No se ha determinado todavía cómo eligen sus parejas. Hay pruebas de que los machos tienen jerarquías y existe también evidencia de que esto influye en la selección para el apareamiento.[45] La gestación dura 14 a 16 meses, produciendo solo una cría.[4] La lactancia transcurre hasta los 19 a 42 meses, pero los jóvenes pueden lactar hasta los 13 años,[4] y pueden alimentarse de hembras diferentes a sus madres.[4] Las hembras generalmente tienen intervalos entre nacimientos de tres a seis años.[4]
Las hembras alcanzan la madurez sexual entre los 7 y los 13 años, y los machos a los 18 años. Una vez llegan a la madurez, los machos se trasladan a latitudes más altas, donde el agua es más fría y la alimentación más abundante, mientras las hembras permanecen en latitudes bajas.[4]
Comportamiento social

Las hembras permanecen en grupos de aproximadamente una docena de individuos con sus crías.[5] Los machos integran estas «guarderías» en forma permanente entre los 4 a 21 años de edad y forman un «grupo de solteros» con otros machos de edad y tamaño similares.[5] Cuando los machos maduran, tienden a dispersarse en grupos más pequeños y los más viejos en su mayoría tienen vidas solitarias.[5] Grupos de machos adultos se han varado juntos, lo cual sugiere un grado de cooperación que aún no ha sido estudiado.[5]
El atacante no humano más común de los cachalotes es la orca, pero las ballenas piloto y las falsas orcas también los atacan o acosan en ocasiones.[46][47] Las orcas amenazan los grupos de hembras con crías, usualmente intentando aislar y matar un individuo joven. Las hembras repelen estos ataques rodeando a sus vástagos y también usan sus aletas de cola contra las orcas dando la cara a las crías, o de frente, luchando con sus dientes.[5] Esta formación en margarita se emplea también para auxiliar a un miembro lesionado de la manada, un comportamiento que los primeros balleneros utilizaron para atraer a los otros miembros del grupo al causarle heridas a cualquiera de los individuos.[48] Si el grupo de orcas es muy grande, pueden llegar a matar a una hembra adulta. Los ejemplares más grandes no tienen predadores aparte de los humanos, y se cree que son demasiado grandes y fuertes para ser amenazados por las orcas.[49]
Alimentación

Los cachalotes se sumergen en busca de comida principalmente entre los 300 a 800 metros de profundidad, y solo en algunas ocasiones entre 1 a 2 kilómetros,[50] en inmersiones que pueden durar más de una hora.[50] Se alimentan de varias especies, de las cuales las más notables son el calamar gigante, el calamar colosal, los pulpos y diversos peces como rayas en la zona demersal, pero la mayor parte de su dieta consiste en calamares de mediano tamaño.[51] Algunas especies pueden servirles de alimento de manera incidental a falta de calamares.[51] La mayor parte de lo que se conoce de los calamares de las grandes profundidades procede de ejemplares hallados en el estómago de cachalotes, y más recientemente en el análisis de su materia fecal. En un estudio llevado a cabo en las inmediaciones de las islas Galápagos, se encontró que los cachalotes habían ingerido con mayor frecuencia calamares de los géneros Histioteuthis (62 %), Ancistrocheirus (16 %) y Octopoteuthis (7 %) con pesos que oscilaban entre 12 y 650 gramos.[52] Las supuestas batallas con los calamares colosales (los cuales llega a pesar 500 kilogramos) nunca han sido presenciados por humanos; sin embargo, se presume que las cicatrices de su cuerpo son causadas principalmente por grandes calamares. Otro estudio realizado en 1966 del contenido estomacal de ejemplares capturados por balleneros neozelandeses en la región del estrecho de Cook, encontró una relación 1,69:1 en peso, entre calamares y peces.[53] Los cachalotes algunas veces sustraen bacalaos y merluzas de las líneas de pesca. Los pescadores de línea larga en el golfo de Alaska se quejan de que los cachalotes aprovechan sus operaciones pesqueras para alimentarse de sus especies apetecidas sustrayéndolas de las líneas, eludiendo así la necesidad de cazar.[54] Sin embargo, la cantidad de pescado tomado es muy pequeño comparado con los requerimientos diarios de este animal. Una filmación de video reciente captó un gran ejemplar macho «rebotando» una línea larga para obtener pescado.[55] Se cree que los cachalotes depredan la especie de tiburón llamado tiburón de boca ancha, una especie rara y grande de las profundidades, descubierto en 1970, ya que en una ocasión tres cachalotes fueron observados atacando o jugando con un boca ancha.[56][57][58]
La irritación producida en el intestino por el pico afilado de los calamares ingeridos parece ser el factor que inicia la producción de una sustancia lubricante que da lugar a la formación de ámbar gris, de manera análoga a como se originan las perlas.[59] Los cachalotes son comensales prodigiosos ya que consumen alrededor del 3% de su peso corporal por día. El consumo anual de presas por parte de estos cetáceos alrededor del mundo se estima en cerca de 100 000 000 de toneladas, una cantidad todavía más alta que el consumo total de animales marinos por parte de los humanos en un año.[60]
No se sabe con claridad por qué la cabeza del cachalote es tan grande en comparación con la mandíbula inferior. Una teoría es que la habilidad para la ecolocalización se ubica en su cabeza, situación que le ayudaría en la cacería. Sin embargo, los calamares, su principal presa, pueden tener propiedades acústicas muy similares al agua de mar para reflejar sonidos.[61] El interior de la cabeza contiene unas estructuras llamadas labios fónicos, a través de los cuales se impulsan los flujos de aire para emitir sonidos. Pueden crear un chasquido que tiene una intensidad de 230 decibelios medida a la distancia de 1 metro, en otras palabras, es mucho más fuerte que el sonido hecho por cualquier otro animal, y 10-14 decibelios más intenso que el sonido de un fusil ubicado en el aire a 1 metro de distancia.[62] Se sugiere que estos chasquidos sirven para aturdir a sus presas. Sin embargo, los estudios experimentales que tratan de probar este efecto no han sido capaces de reproducir esta acción sobre sus presas, poniendo en duda esta idea.[63]
Taxonomía y denominación
El cachalote pertenece al infraorden Cetacea, al mismo que pertenecen todas las ballenas y delfines. Es miembro del parvorden Odontoceti, el cual engloba todos los cetáceos dentados incluyendo a los delfines. Es la única especie existente del género, Physeter, de la familia Physeteridae. Dos especies existentes del género Kogia, el cachalote pigmeo Kogia breviceps y el cachalote enano K. simus, están ubicados en la familia Physeteridae. Algunas clasificaciones ubican el género Kogia en la familia Kogiidae.[64] En otros esquemas taxonómicos las familias Kogiidae y Physeteridae son combinadas en la superfamilia Physeteroidea.[65]

El cachalote fue una de las especies originalmente descrita por Linneo en 1758 en su obra del siglo XVIII, Systema Naturae. Él reconoció cuatro especies en el género Physeter.[66] Sobre la base de un estudio de 1836 de Frederic Cuvier seguida por todos los cetólogos, las cuatro especies se integraron en una sola, pero subsistió la dualidad en la descripción original para la denominación del nombre específico de la especie, P. macrocephalus y P. catodon, ambos utilizados por Linneo. La especie se conoció generalmente bajo el nombre de P. catodon, hasta que en 1974 Husson y Holthuis propusieron que el nombre correcto debería ser P. macrocephalus, basándose en que ambos nombres eran sinónimos publicados simultáneamente y, por lo tanto, debía aplicarse el «principio del primer revisor» del Código Internacional de Nomenclatura Zoológica,[67] una opinión reiterada por Holthuis en 1987.[68] La mayoría de los autores optaron por esta opción, aunque Schevill (en 1986 y 1987) consideraron que P. macrocephalus había sido publicado con una descripción inexacta y que por consiguiente, sólo P. catodon podía ser considerado como válido, por lo que no podía aplicarse el principio del primer revisor.[69][70] En la actualidad la mayoría de los autores aceptan macrocephalus como nombre válido y catodon como sinónimo.[71][1][30][72]
Historia evolutiva
Registro fósil
A pesar de que el registro fósil de los cachalotes extintos es escaso,[73] algunos géneros se han asignado a la superfamilia Physeteroidea, la cual incluye los últimos ancestros comunes del cachalote moderno, del cachalote enano y cachalote pigmeo. Estos fósiles incluyen los géneros Ferecetotherium, Idiorophus, Diaphorocetus, Aulophyseter, Orycterocetus, Scaldicetus, Placoziphius, Zygophyseter y Acrophyseter.[61][65][74] Ferecetotherium, encontrado en Azerbaiyán y fechado en el Oligoceno tardío (de hace 28 a 23 millones de años), es el fósil más primitivo encontrado, con características del cachalote, como el rostro asimétrico.[75] La mayoría de los fósiles datan del periodo Mioceno, de hace 23 a 5 millones de años. Diaphorocetus, de Argentina, se fechó en el Mioceno Temprano. Los fósiles de cachalote del Mioceno Medio, incluyen los géneros Aulophyseter, Idiorophus y Orycterocetus, todos ellos encontrados en la costa este de los Estados Unidos, y Scaldicetus, encontrado en Europa y Japón.[75][76] Fósiles del género Orycterocetus se han hallado también en el océano Atlántico norte y en el mar Mediterráneo, aparte de los encontrados en la Costa Oeste de los Estados Unidos.[77] Placoziphius, encontrado en Europa, y Acrophyseter, en el Perú, proceden del Mioceno Tardío.[65][75]
| Cetacea |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
incluye un resumen simplificado de los grupos extintos (†)[61]
Los fósiles encontrados difieren la estructura de los cachalotes modernos, en la fórmula dental y la forma de la cara y mandíbulas.[75] Por ejemplo Scaldicetus tenía un rostro cónico,[76] y los géneros del Oligoceno y el Mioceno Temprano y Medio, con la posible excepción de Aulophyseter, tenían dientes en las mandíbulas superiores.[75] Acrophyseter, del Mioceno Tardío, también tenía dientes tanto en la mandíbula superior como inferior, un rostro corto y una mandíbula inferior con una curva ascendente.[65] Estas diferencias anatómicas sugieren que estas especies fósiles no necesariamente se alimentaban de calamares de las grandes profundidades como el cachalote moderno, en lugar de ello consumirían peces.[75] Zygophyseter, vivió en el Mioceno Medio a Tardío, encontrado en el sur de Italia, tenía dientes en ambas mandíbulas y parecían estar adaptados a comer grandes presas, como lo hacen las orcas modernas.[61]
Filogenia
La postura tradicional es que los misticetos y los odontocetos provienen de los cetáceos primitivos del periodo Oligoceno Temprano, y que la superfamilia Physeteroidea, el cual incluye el cachalote y el cachalote enano y pigmeo, se separaron de los otros odontocetos poco después, hace alrededor de 23 millones de años.[73][75] Entre los años 1993 a 1996 mediante análisis de filogenia molecular realizados por Milinkovitch y colegas, basados en la comparación de genes de varios cetáceos actuales, sugirieron que los cachalotes se encuentran más estrechamente relacionados con los misticetos que a los otros odontocetos dentados, lo cual podría significar que este grupo no es monofilético, o sea que no todos son descendientes de un solo ancestro dentado.[78] Sin embargo algunos estudios más recientes, basados en varias combinaciones de anatomía comparada y filogenia molecular, han desmentido los análisis de Milinkovitch por motivos técnicos y reafirmado que los odontocetos son monofiléticos.[78][79][80]
Estos análisis también confirmaron que se produjo una rápida radiación adaptativa de los physiteroideos en el Mioceno.[61] Los kógidos (cachalote enano y pigmeo) se separaron de Physeteridae hace al menos 8 millones de años.[79]
Relación con humanos
Caza histórica
El espermaceti, en su totalidad obtenido del órgano del espermaceti, y el aceite de cachalote, obtenido de la grasa corporal, eran muy codiciados por los balleneros durante los siglos XVIII, XIX y XX. Esta sustancia tenía una variedad de aplicaciones comerciales, para velas, jabones, cosméticos, aceite industrial y otros lubricantes especiales, aceite para lámparas, lápices, crayones, impermeabilizante para cueros, materiales anticorrosivos y muchos compuestos farmacéuticos.[81][82][83][84] El ámbar gris, una sustancia sólida, serosa e inflamable producida en el sistema digestivo de los cachalotes, era usado también como un fijador en perfumería.

Antes de principios del siglo XVIII, la cacería era realizada principalmente por nativos indonesios.[85] La leyenda cuenta que en algún momento a principios del siglo XVIII alrededor del año 1712, el Capitán Christopher Hussey, mientras buscaba ballenas francas cerca a la costa, fue desviado por el viento hacia el Norte, donde encontró una manada de cachalotes y mató uno.[86] A pesar de que la historia puede que no sea real, los balleneros estadounidenses iniciaron muy pronto la caza de estos animales. El juez Paul Dudley, en su Ensayo sobre la historia natural de las ballenas (1725), afirma que un hombre de apellido Atkins, quien duró diez o veinte años en el negocio, estuvo entre los primeros que cazó uno, alrededor de 1720 frente a la costa de Nueva Inglaterra.[87]
Existen solo unos pocos casos registrados de cacería de cachalotes en altamar en el periodo comprendido entre 1709 hasta 1730. Debido a que las balandras apostadas en los bancos de Nantucket, capturaban ballenas francas o iban a la región del estrecho de Davis a cazar ballenas de Groenlandia. A principios de 1740, con el desarrollo de las velas de espermaceti, los buques estadounidenses empezaron a concentrarse en estos cetáceos. El diario de Benjamin Bangs (1721-1769) narra que navegando en su balandra, él encontró otros tres barcos destazando cachalotes de la costa de Carolina del Norte a finales de mayo de 1743.[88] De regreso a Nantucket en el verano de 1744 en un viaje posterior el anotó «45 espermacetos fueron traídos aquí este día», otra indicación de que los balleneros estadounidenses estaban en pleno apogeo.[88]
Los balleneros pronto abandonaron las costas de las colonias americanas, hacia la corriente del golfo, los Grandes Bancos de Terranova, África Occidental (1763), las islas Azores (1765) y el Atlántico sur (1770). De 1770 a 1775 los puertos de Massachusetts, New Cork, Connecticut y Rhode Island produjeron 45 000 barriles de aceite de cachalote anualmente, en comparación a los 8 500 de aceite de otros cetáceos.[89] En esta misma época los británicos empezaron la cacería de cachalotes, empleando barcos y personal estadounidenses.[90] Para la década siguiente los franceses entraron al negocio, también empleando a expertos estadounidenses.[90] La cacería de esta especie se incrementó hasta mediados del siglo XIX. El espermaceti fue importante en el alumbrado público (por ejemplo fue usado para alumbrar viviendas, siendo usado hasta 1862, cuando fue reemplazado por aceite de manteca de cerdo, que a su vez fue reemplazado por petróleo) y para lubricación de maquinaria (como las usadas en fábricas de algodón) de la revolución industrial. La cacería declinó en la segunda mitad del siglo XIX, cuando el uso del petróleo se extendió, hecho que indirectamente protegió la población de estos cetáceos de una explotación más intensa.[91][92]
Los balleneros del siglo XVIII, se iniciaron con balandras que podían llevar solo uno o dos botes. La cobertura de la flota y tamaño se incrementó con el tiempo, y barcos más grandes entraron al negocio. A finales del siglo XVIII e inicios del XIX los balleneros navegaban por los océanos Pacífico e Índico, el Japón, las costas de Arabia, Australia y Nueva Zelanda.[90][93][94] La cacería era peligrosa para la tripulación. Por ejemplo, el 20 de noviembre de 1820, un cachalote que se calculó medía 25,9 metros de longitud atacó al barco ballenero de Nantucket Essex. Solo 8 de los 21 marineros sobrevivieron al ser rescatados por otros barcos.[95]
La cacería declinó desde la década de 1880 hasta 1946, pero se reactivó de nuevo luego de la Segunda Guerra Mundial. Los balleneros modernos eran más eficientes que los que cazaban en botes, empleando barcos a vapor y arpones propulsados. Inicialmente la actividad se centró en las grandes ballenas barbadas misticetos, pero al mermar su población, la caza de los cachalotes se incrementó. Los cosméticos, jabones y lubricantes para maquinaria eran los artículos con más compradores. Después que la población disminuyó de manera significativa, la Comisión Ballenera Internacional confirió a la especie total protección en 1985. La cacería por parte de balleneros japoneses en el norte del océano Pacífico no cesó hasta 1988.[92]
Se estima que la población histórica por todo el mundo sumaba 1 100 000 ejemplares antes de la explotación comercial a principios del siglo XVIII.[1] Para 1880 esta había declinado a un estimado de 29 por ciento de la inicial.[1] Desde ese momento hasta 1946 la población pareció haberse recuperado al disminuir la cacería por parte de los balleneros, pero después de la Segunda Guerra Mundial, disminuyó una vez más, a solo el 33 % de la estimada, antes de la irrupción de la industria ballenera.[1] Se estima que en el siglo XIX fueron capturados entre 184 000 y 236 000 ejemplares,[96] mientras que en la era moderna, al menos 770 000 fueron cazados, la mayoría entre 1946 y 1980. De estos más de 680 000 fueron oficialmente reportados.[97] Revisiones adicionales encontraron que reportes oficiales de la URSS mencionan al menos 89 000 capturas.[98] En otros países como el Japón se encontró faltantes en el registro de capturas.[99]
Se tiene constancia incluso de eventos en los que el cachalote fue víctima de caza deportiva, en fechas relativamente recientes. Así, el dictador español Francisco Franco capturó un cachalote de 14 toneladas de peso y 18 metros de longitud en 1958 utilizando para ello el pequeño cañón arponero de su yate Azor[100] cerca de las costas de Galicia (España).
La población restante de estos animales es lo suficientemente grande para que el estado de conservación de la especie sea considerada como vulnerable, en lugar de en peligro de extinción.[1] Sin embargo, la recuperación de los años de cacería es un proceso lento, principalmente en el sur del océano Pacífico donde la cuota de machos en edad reproductiva fue alta.[101]
Estado de conservación actual
El número de cachalotes a través del mundo es desconocido, pero se piensa que es de cientos de miles.[1] El panorama de conservación es más claro que el de muchas otras especies de cetáceo. Históricamente Japón ha capturado diez individuos al año y hasta 2006 diez de ellos fueron capturados en Indonesia. Están protegidos prácticamente por todo el mundo y la caza comercial ha cesado;[1] y los animales que les sirven de alimento no son objeto de pesca.[1] Sin embargo, los operadores de pesca mediante líneas en el golfo de Alaska se han quejado del robo de pescado de sus líneas de pesca.[54]
Actualmente, las principales amenazas que enfrentan estos cetáceos son los enredones en las líneas de pesca y colisiones con barcos.[11] Otros peligros actuales incluyen la ingestión de desechos marinos, el ruido, y la contaminación química.[102] Para la UICN este cetáceo permanece como «vulnerable».[1] Las lista de los EE. UU. lo ubican como «en peligro de extinción».
Importancia cultural

Los dientes de cachalote montados en cuerdas son un objeto cultural importante a través del pacífico. En Nueva Zelanda los maorís los conocían como rei puta y eran escasos debido a que no eran cazados activamente en la sociedad tradicional maorí.[103] El marfil y huesos eran tomados de ejemplares varados. En Fiyi los dientes eran conocidos como tabua y eran tradicionalmente dados como regalo para expiación o muestra de estimación (llamado sevusevu), y era importante en negociaciones entre jefes rivales.[104] Friedrich Ratzel en La Historia de la Humanidad reportó en 1896, que en Fiyi, los dientes de cachalote era el artículo más demandado como ornamento o valor. Estos se organizaban a menudo en collares.[105] Hoy la tabua permanece como un elemento importante en la vida de los Fiyianos. Los dientes eran originalmente raros en Fiyi y Tonga, la cual exportaba dientes, pero con la llegada de los europeos, los dientes inundaron el mercado y esta «moneda» colapsó. La sobreoferta permitió a su vez el desarrollo del arte europeo de confección en piezas de ballena (huesos y dientes) llamado en inglés scrimshaw.[106]
La ballena blanca protagonista de la novela Moby-Dick de Herman Melville es un cachalote;[107][108] al cual Melville asoció con el Leviatán bíblico.[108][109] La reputación de fiereza perpetuada por Melville, se basó en la habilidad de los cachalote para defenderse, en ocasiones con éxito, de los primeros balleneros, terminando en la destrucción de los navíos en varias oportunidades.
Julio Verne en Veinte mil leguas de viaje submarino, los menciona (quizá incorrectamente) cazando ejemplares de esta especie. En la película de Disney Pinocho de 1940, «Monstro» la ballena es un cachalote mediano muy similar a Moby-Dick excepto que «Monstro» era más negro que blanco.
En 2006 la BBC emitió el programa de televisión titulado Ocean Odyssey (en América Latina Odisea en el Océano), en el cual se recrea la vida de un cachalote con ayuda de imágenes generadas por computador, desde su primera inmersión a los 2 años de edad, hasta su muerte a los 80 años varado en una playa.[110]

Avistamiento de cachalotes
Los cachalotes no son los cetáceos más fáciles de observar, debido a los largos periodos de tiempo que pasan sumergidos y a su habilidad para atravesar grandes distancias bajo el agua. Sin embargo, debido a su apariencia distintiva y a su gran tamaño se han hecho muy populares. Los observadores a menudo usan hidrófonos para escuchar los chasquidos y así localizarlos antes que estos emerjan. Sitios populares para su observación se encuentran en Kaikoura ubicada en la Isla del Sur de Nueva Zelanda, donde la plataforma continental en tan angosta que pueden ser observados desde la costa, Andenes y Tromsø en la Noruega ártica y en las Islas Azores, donde pueden verse a lo largo del año.[43][111] Dominica, se cree, es la única isla del Caribe con una población residente de hembras y crías durante todo el año.[112]
Véase también
Referencias
- Taylor, B.L., Baird, R., Barlow, J., Dawson, S. M., Ford, J., Mead, J. G., Notarbartolo di Sciara, G., Wade, P. y Pitman, R. L. (2008). «Physeter macrocephalus». Lista Roja de especies amenazadas de la UICN 2011.2 (en inglés). ISSN 2307-8235. Consultado el 16 de diciembre de 2011.
- Haupt, P. (1907). «Jonah's Whale». Proceedings of the American Philosophical Society 46 (185): 151-164.
- Corominas, Joan (1987). Breve diccionario etimológico de la lengua castellana. Madrid: Gredos. ISBN 84-249-1 332-9.
- Shirihai, H. y Jarrett, B. (2006). Whales Dolphins and Other Marine Mammals of the World. Princeton: Princeton Univ. Press. pp. 21-24. ISBN 0-691-12757-3.
- Whitehead, H. (2002). «Sperm whale Physeter macrocephalus». En Perrin, W., Würsig B. y Thewissen, J., ed. Encyclopedia of Marine Mammals. Academic Press. pp. 1165-1172. ISBN 0-12-551340-2.
- «Physeter macrocephalus, Sperm Whale». Archivado desde el original el 30 de junio de 2017. Consultado el 9 de noviembre de 2009.
- Shirihai, H. y Jarrett, B. (2006). Whales Dolphins and Other Marine Mammals of the World. Princeton: Princeton Univ. Press. pp. 112-115. ISBN 0-691-12757-3.
- Maury, M. (1853). Explanations and Sailing Directions to Accompany the Wind and Current Charts. C. Alexander. p. 297.
- «Sperm Whale». Archivado desde el original el 28 de agosto de 2008. Consultado el 12 de octubre de 2008.
- Mark Carwardine (1994). On the Trail of the Whale. Chapter 1. Thunder Bay Publishing Co. ISBN 1-899074-00-7.
- Reeves, R., Stewart, B., Clapham, P. & Powell, J. (2003). Guide to Marine Mammals of the World. Nueva York: A.A. Knopf. pp. 240-243. ISBN 0-375-41141-0.
- «Sperm Whale (Physeter macrocephalus): Species Accounts». Consultado el 12 de octubre de 2008.
- «Offshore Cetacean Species». CORE. Archivado desde el original el 16 de mayo de 2008. Consultado el 12 de octubre de 2008.
- «American Cetacean Society Fact Sheet». Archivado desde el original el 11 de julio de 2007. Consultado el 19 de marzo de 2007.
- «Sperm Whale Facts». Archivado desde el original el 15 de enero de 2010. Consultado el 26 de diciembre de 2007.
- Whitehead, H. (2003). Sperm Whales Social Evolution in the Ocean. Chicago: University of Chicago Press. p. 4. ISBN 0-226-89518-1.
- «Sperm Whale». Oceana. Archivado desde el original el 30 de agosto de 2009. Consultado el 20 de agosto de 2009.
- The Southwestern Company: "The Volume Library 1", página 65, 1987, ISBN 0-87197-208-5
- Kooyman, G. L.& Ponganis, P. J. (octubre de 1998). «The Physiological Basis of Diving to Depth: Birds and Mammals». Annual Review of Physiology 60 (1): 19-32. doi:10.1146/annurev.physiol.60.1.19.
- Tyack, P., Johnson, M., Aguilar Soto, N., Sturlese, A. & Madsen, P. (18 de octubre de 2006). «Extreme diving of beaked whales». Journal of Experimental Biology 209: 4238-4253. PMID 17050839. doi:10.1242/jeb.02505.
- Noren, S. R. & Williams, T. M. (junio de 2000). «Body size and skeletal muscle myoglobin of cetaceans: adaptations for maximizing dive duration». Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology 126 (2): 181-191. doi:10.1016/S1095-6433(00)00182-3.
- Marshall, C. (2002). «Morphology, Functional; Diving Adaptations of the Cardiovascular System». En Perrin, W., Würsig B. y Thewissen, J., ed. Encyclopedia of Marine Mammals. Academic Press. p. 770. ISBN 0-12-551340-2.
- «Aquarium of the Pacific - Sperm Whale». Aquarium of the Pacific. Archivado desde el original el 14 de marzo de 2019. Consultado el 6 de noviembre de 2008.
- Shwartz, Mark (8 de marzo de 2007). «Scientists conduct first simultaneous tagging study of deep-diving predator, prey». Stanford Report. Consultado el 6 de noviembre de 2008.
- Clarke, M. (1978). «Structure and Proportions of the Spermaceti Organ in the Sperm Whale». Journal of the Marine Biological Association of the United Kingdom 58: 1-17. Archivado desde el original el 17 de julio de 2011.
- Moore MJ, Early GA (2004). «Cumulative sperm whale bone damage and the bends». Science 306 (5705): 2215. PMID 15618509. doi:10.1126/science.1105452.
- Whitehead, H. (2003). «Foraging». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 156-161. ISBN 0-226-89518-1.
- P. S. B. R. James; R. Soundararajan (1981). «Osteological Study On The Sperm Whale Physeter macrocephalus Linnaeus From Indian Ocean». Central Marine Fisheries Research Institute, Cochin (en inglés) 28 (1): 217-232.
- «Ocean Facts: Pressure increases with ocean depth». NOAA. enero de 2013. Consultado el 15 de marzo de 2013.
- «Sperm Whales (Physeter macrocephalus)». U.S. Department of Commerce NOAA Office of Protected Resources. Consultado el 17 de noviembre de 2008.
- Marino, L. (2004). «Cetacean Brain Evolution Multiplication Generates Complexity». International Journal of Comparative Psychology 17: 3-4. Archivado desde el original el 20 de noviembre de 2012. Consultado el 22 de enero de 2010.
- Dicke, U.; Roth, G. (agosto/septiembre de 2008). «Intelligence Evolved». Scientific American Mind. pp. 71-77.
- Cranford, T. W. (2000). «In Search of Impulse Sound Sources in Odontocetes». En Au, W. W. L., Popper, A. N. & Fay, R. R., ed. Hearing by Whales and Dolphins (Springer Handbook of Auditory Research series). Springer-Verlag, Nueva York. ISBN 0387949062.
- Whitlow, W. (2002). «Echolocation». En Perrin, W., Würsig B. y Thewissen, J., ed. Encyclopedia of Marine Mammals. Academic Press. pp. 359–367. ISBN 0-12-551340-2.
- Clarke, M. (1978). «Physical Properties of Spermaceti Oil in the Sperm Whale». Journal of the Marine Biological Association of the United Kingdom 58: 19-26. Archivado desde el original el 17 de julio de 2011.
- Clarke, M.R. (noviembre de 1970). «Function of the Spermaceti Organ of the Sperm Whale». Nature 228: 873-874. doi:10.1038/228873a0.
- «Spermaceti as battering ram?» (PDF). Archivado desde el original el 19 de junio de 2007. Consultado el 19 de marzo de 2007.
- Carrier, D., Deban, S. & Otterstrom, J. (2002). «The face that sank the Essex: potential function of the spermaceti organ in aggression». The Journal of Experimental Biology 205: 1755-1763. Archivado desde el original el 2 de octubre de 2006.
- spermwhale.org - Cranford
- Cranford, T.W. (1999). «The Sperm Whale's Nose: Sexual Selection on a Grand Scale?». Marine Mammal Science 15 (4): 1133-1157. doi:10.1111/j.1748-7692.1999.tb00882.x.
- Whitehead, H. (2003). «Oceanographic Habitat of the Sperm Whale». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. p. 33. ISBN 0-226-89518-1.
- Murray, J. W., Jannasch, H. W., Honjo, S., Anderson, R. F., Reeburgh, W. S., Top, Z., Friederich, G. E., Codispoti, L. A. & Izdar E. (30 de marzo de 1989). «Unexpected changes in the oxic/anoxic interface in the Black Sea». Nature 338: 411-413. doi:10.1038/338411a0.
- Whitehead, H. (2003). «Sperm Whales and Humans». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 23-24. ISBN 0-226-89518-1.
- Whitehead, H. & Weilgart, L. (2000). «The Sperm Whale». En Mann, J., Connor, R., Tyack, P. & Whitehead, H., ed. Cetacean Societies. The University of Chicago Press. p. 169. ISBN 0-226-50341-0.
- Whitehead, H. (2003). «Mating Systems». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 271-285. ISBN 0-226-89518-1.
- Pitman, RL; Ballance, LT; Mesnick, SI; Chivers, SJ (2001) "Killer whale predation on sperm whales: Observations and implications" Marine Mammal Science 17(3): 494-507 Abstract Archivado el 5 de junio de 2013 en Wayback Machine.
- Whitehead, H. & Weilgart, L. (2000). «The Sperm Whale». En Mann, J., Connor, R., Tyack, P. & Whitehead, H., ed. Cetacean Societies. The University of Chicago Press. p. 165. ISBN 0-226-50341-0.
- Piper, Ross (2007), Extraordinary Animals: An Encyclopedia of Curious and Unusual Animals, Greenwood Press.
- Estes, J. (2006). Whales, Whaling, and Ocean Ecosystems. University of California Press. p. 179. ISBN 0520248848.
- Whitehead, H. (2003). «Vertical Movements: The Sperm Whale's Dive». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. p. 79. ISBN 0-226-89518-1.
- Whitehead, H. (2003). «The Diet of a Sperm Whale: The Walnut, the Pea and the Half-Pound Steak». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 43-55. ISBN 0-226-89518-1.
- Smith S. & Whitehead, H. (2000). «The Diet of Galapagos sperm whales Physeter macrocephalus as indicated by fecal sam». Marine Mammal Science 16 (2): 315-325. doi:10.1111/j.1748-7692.2000.tb00927.x.
- Gaskin D. & Cawthorn M. (1966). «Diet and feeding habits of the sperm whale (Physeter macrocephalus L.) in the Cook Strait region of New Zealand». New Zealand Journal of Marine and Freshwater Research 2: 156-179.
- «Sneaky Cetaceans». Arctic Science Journeys. Consultado el 4 de noviembre de 2008.
- «Whale Buffet». Archivado desde el original el 22 de mayo de 2006. Consultado el 19 de marzo de 2008.
- «animal facts: megamouth shark» (en inglés). Archivado desde el original el 7 de junio de 2013. Consultado el 29 de enero de 2010.
- «Sperm Whales Spotted Attacking Megamouth Shark» (en inglés). Consultado el 29 de enero de 2010.
- Compagno, L. J. V. (2001). Sharks of the World Volume 2 Bullhead, mackerel and carpet sharks. FAO Species Catalogue for Fishery Purposes. pp. 74-78. Archivado desde el original el 17 de febrero de 2011.
- Dannenfeldt K. H. (1982). «Ambergris: The Search for Its Origin». Isis 73 (3): 382-397. doi:10.1086/353040.
- Ellis, R. (1994). Monsters of the Sea. The Lyons Press. p. 245. ISBN 1592289673.
- Bianucci, G. & Landini, W. (8 de septiembre de 2006). «Killer sperm whale: a new basal physeteroid (Mammalia, Cetacea) from the Late Miocene of Italy». Zoological Journal of the Linnean Society 148 (1): 103-131. doi:10.1111/j.1096-3642.2006.00228.x.
- Møhl, B., Wahlberg, M., Madsen, P. T., Heerfordt, A. y Lund, A. (agosto de 2003). «The monopulsed nature of sperm whale clicks». The Journal of the Acoustical Society of America 114 (2): 1143-1153. doi:10.1121/1.1586258.
- Benoit-Bird K. Au W. & Kastelein R. (agosto de 2006). «Testing the odontocete acoustic prey debilitation hypothesis: No stunning results». The Journal of the Acoustical Society of America 120 (2): 1118-1123. doi:10.1121/1.2211508.
- ITIS standar report. «Kogiidae» (en inglés). Consultado el 30 de enero de 2010.
- Lambert, O., Bianucci, G. & de Muizon, C. (agosto de 2008). «A new stem-sperm whale (Cetacea, Odontoceti, Physeteroidea) from the Latest Miocene of Peru». Comptes Rendus Palevol 7 (6): 361-369. doi:10.1016/j.crpv.2008.06.002.
- Linnaeus, Carolus (1758). Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. Holmiae. (Laurentii Salvii). p. 824.
- Husson, A.M.; Holthuis, L.B. (1974). «Physeter macrocephalus Linnaeus, 1758, the valid name for the sperm whale». Zoologische Mededelingen (en inglés) 48 (19): 205-217.
- Holthuis, L.B. (1987). «The scientific name of the sperm whale». Marine Mammal Science (en inglés) 3 (1): 87-89. doi:10.1111/j.1748-7692.1987.tb00154.x.
- Schevill, W.E. (1986). «The International Code of Zoological Nomenclature and a paradigm: the name Physeter catodon Linnaeus 1758». Marine Mammal Science (en inglés) 2 (2): 153-157. doi:10.1111/j.1748-7692.1986.tb00036.x.
- Schevill, W.E. (1987). «Reply to L.B. Holthuis "The scientific name of the sperm whale"». Marine Mammal Science (en inglés) 3 (1): 89-90. doi:10.1111/j.1748-7692.1987.tb00155.x.
- «Physeter macrocephalus (TSN 180488)». Sistema Integrado de Información Taxonómica (en inglés).
- Perrin, W. (2011). «Physeter macrocephalus Linnaeus, 1758». World Register of Marine Species (en inglés). World Cetacea Database. Consultado el 16 de diciembre de 2011.
- Fordyce, R. E. y Barnes, L. G. (mayo de 1994). «The Evolutionary History of Whales and Dolphins». Annual Review of Earth and Planetary Sciences 22: 419-455. doi:10.1146/annurev.ea.22.050194.002223. Archivado desde el original el 18 de agosto de 2011. Consultado el 22 de enero de 2010.
- Stucky, R.E. y McKenna, M.C. (1993). «Mammalia». En Benton, M.J., ed. The Fossil Record. London.: Chapman & Hall. pp. 739–771.
- Mchedlidze. G. A. (2002). «Sperm whales, evolution». En Perrin, W. F., Würsic, B. & Thewissen, J. G. M., ed. Encyclopedia of Marine Mammals. Academic Press, San Diego. pp. 1172-1174. ISBN 0-12-551340-2.
- Hirota, K. & Barnes, L. G. (5 de abril de 2006). «A new species of Middle Miocene sperm whale of the genus Scaldicetus (Cetacea; Physeteridae) from Shiga-mura, Japan». Island Arc 3 (4): 453-472. doi:10.1111/j.1440-1738.1994.tb00125.x.
- Bianucci, G., Landrini, W. & Varola, W. (septiembre/octubre de 2004). «First discovery of the Miocene northern Atlantic sperm whale Orycterocetus in the Mediterranean». Geobios 37 (5): 569-573. doi:10.1016/j.geobios.2003.05.004.
- Nikaido, M., Matsuno, F., Hamilton, H., Brownwell, R., Cao, Y., Ding, W., Zuoyan, Z., Shedlock, A., Fordyce, R. E., Hasegawa, M. & Okada, N. (19 de junio de 2001). «Retroposon analysis of major cetacean lineages: The monophyly of toothed whales and the paraphyly of river dolphins». Procedings of the National Academy of Sciences of the United States of America 98 (13): 7384-7389. doi:10.1073/pnas.121139198.
- Whitehead, H. (2003). «Evolutionary History of the Sperm Whale». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 2-3. ISBN 0-226-89518-1.
- Heyning, J. (23 de agosto de 2006). «Sperm Whale Phylogeny Revisited: Analysis of the Morphological Evidence». Marine Mammal Science 13 (4): 596-613. doi:10.1111/j.1748-7692.1997.tb00086.x.
- Wilson, D. (1999). The Smithsonian Book of North American Mammals. Vancouver: UBC Press. p. 300. ISBN 0774807628.
- The Southampton Oceanography Centre & A deFontaubert. «The status of natural resources on the high seas». UICN. p. 63. Archivado desde el original el 17 de diciembre de 2008. Consultado el 11 de octubre de 2008.
- Jamieson, A. (1829). A Dictionary of Mechanical Science, Arts, Manufactures, and Miscellaneous Knowledge. H. Fisher, Son & Co. p. 566.
- «Aquarium of the Pacific - Sperm Whale». Archivado desde el original el 14 de marzo de 2019. Consultado el 11 de octubre de 2008.
- Whitehead, H. (2003). «Sperm Whales and Humans». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. p. 14. ISBN 0-226-89518-1.
- Simons, B. «Christopher Hussey Blown Out (Up) to Sea». Nantucket Historical Association.
- Dudley, P. (1725). «An Essay upon the Natural History of Whales, with a Particular Account of the Ambergris Found in the Sperma Ceti Whale». Philosophical Transactions (1683-1775), Vol. 33. The Royal Society. p. 267.
- Dolin, E. (2007). Leviathan: The History of Whaling in America. W. W. Norton. pp. 98-100. ISBN 0393060578.
- Starbuck, A. (1878). History of the American Whale Fishery from its Earliest Inception to the Year 1876.
- Bockstoce, J. (diciembre de 1984). «From Davis Strait to Bering Strait: The Arrival of the Commercial Whaling Fleet in North America's West Arctic». Arctic 37 (4): 528-532.
- Estes, J. (2006). Whales, Whaling, and Ocean Ecosystems. University of California Press. p. 329. ISBN 0520248848.
- Whitehead, H. (2003). «Sperm whales and humans». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 13–21. ISBN 0-226-89518-1.
- Stackpole, E. A. (1972). Whales & Destiny: The Rivalry between America, France, and Britain for Control of the Southern Whale Fishery, 1785-1825. The University of Massachusetts Press. ISBN 0870231049.
- Baldwin, R., Gallagher, M. y van Waerebeek, K. «A Review of Cetaceans from Waters off the Arabian Peninsula». p. 6. Archivado desde el original el 17 de diciembre de 2008. Consultado el 15 de octubre de 2008.
- «The Wreck of the Whaleship Essex». BBC. Consultado el 11 de octubre de 2008.
- Davis, L, Gallman, R. & Gleiter, K. (1997). In Pursuit of Leviathan: Technology, Institutions, Productivity, and Profits in American Whaling, 1816-1906 (National Bureau of Economic Research Series on Long-Term Factors in Economic Dev). University of Chicago Press. p. 135. ISBN 0226137899.
- «Whaling Statistics». Archivado desde el original el 15 de octubre de 2019. Consultado el 15 de octubre de 2008.
- «Sperm Whale (Physeter macrocephalus) California/Oregon/Washington Stock». Consultado el 16 de octubre de 2008.
- «The RMS - A Question of Confidence: Manipulations and Falsifications in Whaling». Archivado desde el original el 7 de octubre de 2008. Consultado el 16 de octubre de 2008.
- «El Caudillo, realiza un crucero de pesca Marítima deportiva. Capturó un cetáceo de 14 metros y 28 000 kg de peso». hemeroteca digital diario ABC. 2 de desptiembre de 1958. Consultado el 24 de enero de 2012.
- Whitehead, H. (2003). «Ghosts of Whaling Past». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 360-362. ISBN 0-226-89518-1.
- Whitehead, H. (2003). «New Threats to Sperm Whales». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 362–368. ISBN 0-226-89518-1.
- «Museum of New Zealand Te Papa Tongarewa Collections Online Search - Rei puta». Consultado el 15 de marzo de 2009.
- Arno, A. (2005). «Cobo and tabua in Fiji: Two forms of cultural currency in an economy of sentiment». American Ethnologist 32 (1): 46-62. doi:10.1525/ae.2005.32.1.46.
- Ratzel, Friedrich. The History of Mankind. (Londres: MacMillan, 1896). Consultado el 21 de octubre de 2008.
- Constantine, R. (2002). «Folklore and Legends». En Perrin, W., Würsig, B. & Thewissen, J., ed. Encyclopedia of Marine Mammals. Academic Press. p. 449. ISBN 0-12-551340-2.
- «Chapter 3. Romances of Adventure. Section 2. Herman Melville. Van Doren, Carl. 1921. The American Novel». Bartleby.com. Consultado el 19 de octubre de 2009.
- Zwart, H. (2000). «What is a Whale? Moby Dick, marine science and the sublime». En Mieth, D. & Pfaff, D., ed. Erzahlen und Moral Narrativitat im Spannungsfeld von Ethik und Asthetic (Tubingen Attempo). pp. 185-214. Archivado desde el original el 20 de marzo de 2009.
- Edwards, B. «The Playful Learnings». Australasian Journal of American Studies: 9. Archivado desde el original el 17 de diciembre de 2008.
- Mundo plus TV. «"Odisea en el Océano" se adentra en las maravillas». Consultado el 14 de julio de 2010.
- «Whale and dolphin watching in the Azores». Wildlife Extra. Archivado desde el original el 14 de julio de 2013. Consultado el 26 de agosto de 2009.
- «Whale Watching Dominica». Archivado desde el original el 25 de mayo de 2009. Consultado el 26 de septiembre de 2009.
Enlaces externos
 Wikispecies tiene un artículo sobre Physeter macrocephalus.
Wikispecies tiene un artículo sobre Physeter macrocephalus. Wikimedia Commons alberga una categoría multimedia sobre Physeter macrocephalus.
Wikimedia Commons alberga una categoría multimedia sobre Physeter macrocephalus.- Physeter en
- información sobre cachalote
- "Fauna ibérica; mamíferos". Ángel Cabrera Latorre. 1914. Facsímil electrónico.
- Physeter macrocephalus (como Ph. catodon) en el mismo sitio.
- Whale science
- Vidéos de cachalots En francés
- US National Marine Fisheries Service Sperm Whale web page
- 70South - information on the sperm whale
- MarineBio: Sperm Whale, Physeter catodon
- "Physty"-stranded sperm whale nursed back to health and released in 1981
- The physiology of the deep diving adaptations of whales
- ARKive Fotografías, video.
- Whale Trackers - An online documentary film buscando los cachalotes en el mar Mediterráneo.
- El profesor Malcolm Clarke habla sobre la anatomía de los cachalotes Clarke ha pasado gran parte de su vida estudiando los cachalotes y calamares gigantes.