Sulfonación aromática
La sulfonación aromática es una reacción orgánica en la que un átomo de hidrógeno en un areno es reemplazado por un grupo funcional de ácido sulfónico en una sustitución aromática electrófila.[1] En la industria química se utilizan habitualmente para la fabricación de detergentes, tintes y medicamentos.
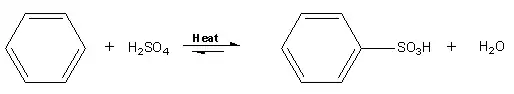
Estequiometría y mecanismo

Las condiciones típicas implican calentar el compuesto aromático con ácido sulfúrico:[2]
- C6H6 + H2SO4 → C6H5SO3H + H2O
En esta sustitución aromática electrofílica, el trióxido de azufre o su derivado protonado es el electrófilo.
Para estabilizar la reacción, se pueden agregar agentes deshidratantes como cloruro de tionilo:
- C6H6 + H2SO4 + SOCl2 → C6H5SO3H + SO2 + 2 HCl
El ácido clorosulfúrico también es un agente efectivo:
- C6H6 + HSO3Cl → C6H5SO3H + HCl
A diferencia de la nitración aromática y la mayoría de las otras sustituciones aromáticas electrofílicas, esta reacción es reversible. La sulfonación tiene lugar en condiciones ácidas concentradas y la desulfonación es el modo de acción en un ácido acuoso caliente diluido. Esta reacción es de gran utilidad en la protección del sistema aromático gracias a su reversibilidad: debido a los efectos de la captación de electrones, los grupos protectores de los sulfonatos se pueden utilizar para prevenir la sustitución aromática electrófila.[3] También se pueden instalar como grupos activantes para afectar la posición en la que puede tener lugar la sustitución.
Métodos especializados de sulfonación
Además de la tratada anteriormente, la ingeniería química ha desarrollado varios métodos especializados para introducir grupos sulfonados.
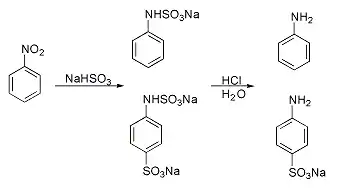
Reacción de Piria
Una reacción clásica es la Reacción de Piria (Raffaele Piria, 1851) en la cual un nitrobenceno en la que el nitrobenceno reacciona con un bisulfito metálico formando un ácido aminosulfónico como resultado de la reducción combinada del grupo nitro y la sulfonación.[4]
Proceso de sulfonación de Tyrer
En el proceso de sulfonación de Tyrer (1917)[5] el vapor de benceno es conducido a través de un recipiente que contiene 90% de ácido sulfúrico, cuya temperatura se aumenta de 100 a 180°. El agua y el benceno se eliminan continuamente en un condensador y la capa de benceno se devuelve al recipiente. De esta forma se obtiene un rendimiento del 80%..[6]
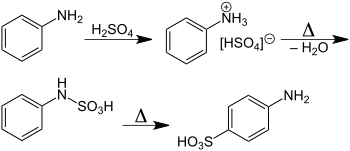
Reacciones de los ácidos arilsulfónicos
Como grupo funcional, los ácidos arilsulfónicos sufren desulfonación cuando se calientan en agua:
- RC6H4SO3H + H2O → RC6H5 + H2SO4
Cuando se tratan con una base fuerte, los derivados del ácido bencenosulfónico se convierten en fenoles (a través de los fenóxidos):[7]
- C6H5SO3H + 2 NaOH → C6H5ONa + NaHSO4 + H2O
Véase también
Referencias
- Universidad de Zaragoza (ed.). Reacciones de compuestos aromáticos. Química orgánica para ingenieros.
- Otto Lindner, Lars Rodefeld (2005). «Benzenesulfonic Acids and Their Derivatives». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_507.
- Graham Solomons (2013). Wiley, ed. Química Orgánica. p. 676. ISBN 978-1-118-13357-6.
- Piria, Raffaele (1851). «Über einige Produkte der Einwirkung des schwefligsäuren Ammoniaks auf Nitronaphtalin». Annalen der Chemie und Pharmacie 78: 31-68. ISSN 0075-4617. doi:10.1002/jlac.18510780103.
- Patente USPTO n.º 1,210,725
- Siegfried Hauptmann: (1985). VEB Deutscher Verlag für Grundstoffindustrie, ed. Organische Chemie. p. 511. ISBN 3-342-00280-8.
- W. W. Hartman (1923). «p-Cresol». Organic Syntheses 3: 37. doi:10.15227/orgsyn.003.0037.