Transglutaminasa tisular
La transglutaminasa tisular (abreviada como TG2 o tTG) es un enzima (número EC: 2.3.2.13) de la familia de las transglutaminasas. Al igual que otras transglutaminasas, une proteínas entre un grupo ε-amino de un residuo de lisina y un grupo γ-carboxamida de un residuo de glutamina, creando un enlace inter- o intramolecular que es altamente resistente a la proteólisis. La tTG es particularmente notable por ser el autoantígeno en la enfermedad celíaca, pero también es conocido por desempeñar un papel en la apoptosis, diferenciación celular y la estabilización de la matriz extracelular.[1] El gen de la tTG humano se encuentra localizada en el cromosoma 20 (20q11.2-q12).
| transglutaminasa 2 | ||||
|---|---|---|---|---|
 | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolos | TGM2 (HGNC: 11778) tTG | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.3.2.13 | |||
| Locus | Cr. 20 q12 | |||
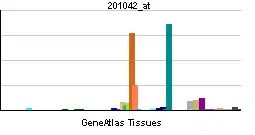
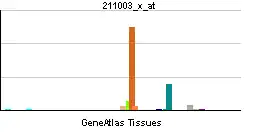
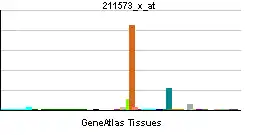
| Patrón de expresión de ARNm | ||||
 | ||||
 | ||||
 | ||||
| Más información | ||||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| Ensembl |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| RefSeq (proteína) NCBI |
| |||
| Ubicación (UCSC) |
| |||
| PubMed (Búsqueda) |
| |||
Fisiología
La tTG se expresa ubicuamente. Requiere calcio como cofactor. Su transcripción es aumentada por ácido retinoico. Entre sus muchas supuestas funciones, parece estar involucrada en la apoptosis, el desarrollo de la matriz extracelular y la reparación de heridas.[1]
La tTG también posee actividad GTPasa: en presencia de GTP funciona como una proteína G,participando en procesos de señalización.[2] Además de su actividad transglutaminasa, la tTG también puede actuar como quinasa,[3] proteína disúlfido-isomerasa,[4] y desamidasa.[5] Esta última actividad es importante en la deamidación de péptidos gliadinos en la patología de la enfermedad celíaca.
Papel en la enfermedad
A la transglutaminasa tisular se la conoce sobre todo por su papel en la enfermedad celíaca. En los pacientes con esta enfermedad, se producen anticuerpos anti-transglutaminasa (ATA),[6] que resultan en una forma de sensibilidad al gluten en la que una respuesta celular al gluten unido a tTG es capaz de estimular respuestas específicas contra la transglutaminasa por parte de los linfocitos B, lo cual desencadena la producción de anticuerpos ATA IgA e IgG.[7]
Recientes estudios sugieren que la tTG desempeña también un papel en la inflamación, las enfermedades degenerativas y la biología de los tumores.[1]
Uso terapéutico
El uso de la tTG como forma de pegamento quirúrgico atraviesa todavía una fase experimental. También está siendo estudiada como un atenuador en la metástasis de ciertos tumores.[1]
Inactivación
Se ha encontrado que la proteína 57 (ERp57) residente en el retículo endoplásmico (RE), una proteína del RE que favorece el plegamiento de proteínas nacientes y que también está presente en el medio extracelular, posee las características celulares y bioquímicas para inactivar la TG2.[8]
La ERp57 se colocaliza con TG2 extracelular en células endoteliales de vena umbilical humana (HUVECs) cultivadas. ERp57 oxida la TG2 con una constante de velocidad 400-2000 veces superior a la de los oxidantes de molécula pequeña. Además, su especificidad para TG2 fue también notablemente superior a la de otras proteínas redox secretadas, como la proteína disulfuro isomerasa (PDI), ERp72, TRX y la quiescina sulfhidrilo oxidasa 1 (QSOX1). Por último, la eliminación de ERp57 mediada por siRNA en HUVECs. aumentó la transamidación catalizada por TG2 en el entorno extracelular. El cambio de enlace disulfuro en la TG2 humana representa el primer ejemplo de un mecanismo regulador redox postraduccional modulado reversible y alostéricamente por dos proteínas distintas (ERp57 y TRX).
Referencias
- Griffin M, Casadio R, Bergamini CM. Transglutaminases: nature's biological glues. Biochem J 2002;368:377-96. PMID 12366374.
- Fesus L, Piacentini M. Transglutaminase 2: an enigmatic enzyme with diverse functions. Trends Biochem Sci 2002;27:534-9. PMID 12368090.
- Mishra S, Murphy LJ. Tissue transglutaminase has intrinsic kinase activity: identification of transglutaminase 2 as an insulin-like growth factor-binding protein-3 kinase. J Biol Chem 2004;279:23863-8. PMID 15069073.
- Hasegawa G, Suwa M, Ichikawa Y, Ohtsuka T, Kumagai S, Kikuchi M, Sato Y, Saito Y. A novel function of tissue-type transglutaminase: protein disulphide isomerase. Biochem J 2003; 373:793-803. PMID 12737632.
- Sakly W, Thomas V, Quash G and El Alaoui S. A role for tissue transglutaminase in alpha-gliadin peptide cytotoxicity. Clin Exp Immunol 2006;146:550-8. PMID 17100777.
- GOTTELAND R, Martin, VERBEKE P, Sandra, CRUCHET M, Sylvia et al. Anticuerpos anti-transglutaminasa tisular: ¿una mejor prueba para detectar transgresiones menores de la dieta en pacientes celíacos?. Rev. méd. Chile. [online]. ene. 2003, vol.131, no.1 [citado 19 de febrero de 2008], p.25-29. Disponible en la World Wide Web: . ISSN 0034-9887.
- Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nature Med 1997;3:797-801. PMID 9212111
- Endoplasmic reticulum-resident protein 57 (ERp57) oxidatively inactivates human transglutaminase 2.