Tensioactivo aniónico
Se llama tensioactivos aniónicos a los tensioactivos que tienen un grupo funcional en la molécula cargado negativamente, sin embargo, para mantener la neutralidad eléctrica, este está asociado a un catión (ion positivo). Como cada agente tensioactivo, los tensioactivos aniónicos están formados por una parte polar y una parte no polar. La parte no polar son grupos alquilo diferentes. El grupo polar es generalmente un grupo -COO-(carboxilato)-SO3-(sulfonato), SO42-(sulfato) o PO43- (fosfato).[1]
Derivados de ácidos carboxílicos
Alquilcarboxilatos
Los ácidos grasos no se emplean como tensoactivos debido a su baja solubilidad en agua. Sin embargo, las sales de éstos tienen afinidad por el agua y se usan ampliamente, especialmente los alcalinos (neutralizados con una base fuerte) y aquellos que han sido neutralizados con aminas de cadena corta (etanolamina, dietanolamina, trietanolamina...).[2]
La mayoría de jabones entran dentro de este tipo de tensioactivos. Por una reacción de saponificación a partir de grasas animales y/o vegetales se obtiene por tratammiento con potasa o sosa cáustica el jabón correspondiente:

Este jabón (que es un tensioactivo aniónico), se basa en la estructura química del ácido graso correspondiente de la materia prima (la grasa) que reacciona con la base para dar el alquilcarboxilato de fórmula general: R−COO−Na+ (en el caso de usar potasa en vez de sosa, en vez de Na+, será un K+) donde R=alquilo (o alquenilo a veces) de 8-20 átomos de carbono.
Además de los jabones tradicionales, como el jabón de Marsella, jabón de Castilla, etc, industrialmente también se producen muchos más.
Ésteres de ácido carboxílico
Este tipo de tensioactivos es una subcategoría de los anteriores. Son monoésteres de ácidos di- o tricarboxílicos. Estos ésteres son producidos por reacciones de condensación que implican diferentes tipos de moléculas: ya sea un alcohol con un ácido policarboxílico (por ejemplo, ácido tartárico o ácido cítrico), o un hidroxiácido (por ejemplo, ácido láctico o ácido cítrico) con un ácido carboxílico. El alcohol suele haber sido etoxilado previamente para mejorar la solubilidad en agua y la actividad superficial.
Un par de ejemplos de estos tensioactivos son el dilaurato-7 citrato de sodio (donde el 7 indica las unidades de óxido de etileno que se han unido al alcohol láurico en la etoxilación) y el estearoil tartrato de sodio:

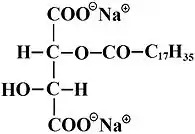
Debido a sus buenas propiedades para la formación de espuma y su "persistencia" sobre el cabello, los ésteres de estos ácidos carboxílicos son especialmente adecuados en champús; en combinación con alquilsulfatos polietoxilados, que reducen la irritación de la piel.[2]
Derivados de ácidos carboxílicos polietoxilados
Estos tensioactivos se forman por la reacción de un cloruro de ácido, como el cloroacetato de sodio, con alcoholes polietoxilados. Debido a la adición de grupos etoxilados, los carboxilatos polietoxilados son más solubles en agua y menos sensibles a la dureza del agua en comparación con los jabones convencionales. También, mantienen las mejores propiedades de tensioactivos no iónicos, al no presentar ningún "punto de niebla" (Cloud point en inglés, que consiste en la temperatura a la que los sólidos disueltos en un líquido ya no son completamente solubles, precipitando como una segunda fase dando al fluido un aspecto turbio) y muestran una buena humectación y estabilidad espumante. Estos carboxilatos polietoxilados no se someten a hidrólisis en presencia de álcalis o ácidos.
La fórmula general de este tipo de compuestos es la siguiente:
Con R = C8H17 −C18H37. Se usan como emulsionantes y estabilizantes de emulsiones, en acondicionadores para el cabello y en champús, en combinación con alquil éter sulfatos (de alcoholes) y, a veces, con tensioactivos catiónicos.[2]
Tensioactivos acrílicos
Existen muchos tensioactivos acrílicos sintéticos, entre ellos caben destacar los copolímeros derivados del ácido poliacrílico tanto en su estructura de copolímero en bloque como copolímero de injerto usando estireno o ácido metacrílico como otros bloques de construcción del copolímero. Estos polímeros suelen usarse como dispersantes acuosos y emulsionantes.
Un ejemplo de copolímero en bloque de acrílico/estireno es el siguiente:

Derivados del ácido sulfúrico
Alquilsulfatos
Son ésteres orgánicos del ácido sulfúrico; el átomo de azufre se une al de carbono de la cadena alifática a través de un átomo de oxígeno. Son sulfatos de alcoholes grasos. El grupo SO3 al unirse al oxígeno del alcohol forma un grupo sulfato en vez de sulfonato. El más conocido de este grupo es el dodecilsulfato sódico (SDS), también llamado (a veces) lauril sulfato de sodio (SLS).
Los sulfatos de alcoholes grasos se obtienen por reacción de un alcohol graso con trióxido de azufre. Las reacciones son:
Alquil éter sulfatos
El alquil éter sulfato (AES) más conocido y ampliamente usado es el derivado polietoxilado del SLS: el lauril éter sulfato sódico (SLES):
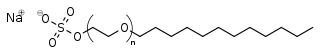
Son el resultado de la sulfonación de un alcohol, como en el caso anterior, pero previamente este alcohol es polietoxilado:
Debido a esta reacción de etoxilación previa a la sulfonación, a menudo a los AES se les llama también: alcoholes sulfato (poli)etoxilados (AEOS de las siglas en inglés), ya que resultan de la sulfonación de un alcohol (poli)etoxilado.
Comparados con los alquilsulfatos, los alquil éter sulfatos muestran una mayor solubilidad en agua y, dependiendo del grado de etoxilación, una menor (o incluso marginal) afección por la dureza de los iones del agua. En contraposición, suelen ser disoluciones más viscosas que sus correspondientes alquilsulfatos sin etoxilar.
Los AES se utilizan como limpiadores para el hogar (por ejemplo, limpiadores de alfombras), líquidos para lavaplatos, productos de cuidado personal, jabones líquidos, geles de ducha, y, sobre todo, champús. El aumento de grado de etoxilación reduce la irritación cutánea y ocular. Por lo general, se combinan con otros agentes tensioactivos no iónicos o aniónicos.[2]
Derivados de ácidos sulfónicos
Alquilsulfonatos
Son equivalentes a los alquilcarboxilatos, pero en vez de tener un grupo carboxilo en el extremo polar, tienen un grupo sulfonato. Los tres tipos principales de alquilsulfonatos (o alcanosulfonatos) son: los sulfonatos primarios y secundarios de parafina (PS y SAS) y los sulfonatos de α-olefina (AOS). Los primeros suelen sintetizarse a partir de n-parafinas, por sulfoxidación de éstas irradiando con luz ultravioleta, generando así radicales libres que reaccionan con el SO3.
.jpg.webp)

.jpg.webp)
.jpg.webp)
Los alcanosulfonatos (PS y SAS) son muy solubles en agua y muestran una buena formación de espuma, humectación y propiedades emulsionantes. Se utilizan principalmente en Europa en los detergentes en polvo, así como en productos de limpieza líquidos de superficie dura para todo uso. Debido a su excelente resistencia a los altos contenidos de electrolitos, los alcanosulfonatos también han encontrado interesantes perspectivas en limpiadores concentrados industriales o domésticos que contienen aditivos químicos minerales.
Los sulfonatos de α-olefinas se han utilizado principalmente en Asia como tensioactivos para detergentes pesados y ligeros de lavandería, pastillas de jabón sintético, y productos para el hogar; también se han utilizado en los Estados Unidos en varios productos de cuidado personal (jabones líquidos, baños de burbujas, y champús) como alternativas a los alquil éter sulfatos. También se utilizan marginalmente en formulaciones para el cuidado oral.[2]
Alquilbencenosulfonatos
Los alquilbencenosulfonatos se diferencian de los anteriores en que además de tener una cadena alifática como extremo apolar del tensioactivo, también poseen un grupo aromático, además de que tienen el grupo sulfonato. La fórmula general correspondería a: CnH2n+1−C6H4−SO3−Na+.
El alquilbenceno obtenido a partir de la alquilación de Friedel-Crafts se sulfona con ácido sulfúrico fumante y se neutraliza con un álcali. Las reacciones son:
1. Adición:
La adición es catalizada a través del ion H+.
2. Sustitución electrófila aromática:
3. Neutralización:
El más empleado de estos alquilbenceno sulfonatos es el dodecilbencenosulfonato:



Sulfosuccinatos
Los sulfosuccinatos son ésteres alquílicos del ácido sulfosuccínico. Normalmente se sintetizan a través de la condensación del anhídrido maleico con un alcohol graso, seguida de sulfonación con hidrógenosulfito de sodio. También se puede usar ácido fumárico o ácido maleico en lugar del anhídrido.
El más usado es el dioctilsulfosuccinato de sodio:
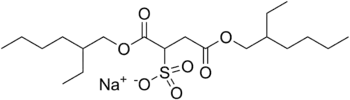
Tauratos
Los tauratos son derivados N-alquílicos de la taurina. El más utilizado como tensioactivo aniónico es el N,N-metil oleoil taurato de sodio.


Derivados del ácido fosfórico
Esta clase de tensioactivos incluye tanto alquilfosfatos como alquil éter fosfatos. Estos tensioactivos se producen por la reacción de alcoholes grasos con alguno de estos dos posibles agentes fosfatantes: ácido fosfórico y pentóxido de fósforo. Los tensioactivos resultantes de esta reacción son mezclas que contienen principalmente ésteres orgánicos del ácido fosfórico monoalquílicos y dialquílicos. También suele quedar una pequeña cantidad de ácido fosfórico y alcohol (puesto que la reacción no tiene una conversión completa), lo que afecta a las propiedades finales de la mezcla del tensioactivo.
Otros
Algunos sulfonatos se usan como plastificantes, o incluso algunos derivados del naftaleno o melanina, junto con otros polímeros como los lignosulfonatos o policarboxilatos, poseen mejores características y se emplean como aditivos superplastificantes.
Referencias
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 503−504.
- Oldenhove de Guertechin, Louis. Handbook of Detergents, Part A: Properties (Serie: Surfactant Science). Capítulo 2: Surfactants: Classification. CRC Press. ISBN 978-0824714178.