Tetrafluoruro de azufre
El tetrafluoruro de azufre es el compuesto químico de fórmula SF4. En condiciones estándar existe como gas. Es corrosivo que libera peligroso HF a la exposición a agua o humedad. A pesar de estas características indeseables, este compuesto es un reactivo útil para la preparación de compuestos organofluorados,[2] algunos de los cuales son importantes en los farmacéuticos y químicos de especialidad industrias.
| tetrafluoruro de azufre | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Fluoruro de azufre(IV) | ||
| General | ||
| Otros nombres | Tetrafluoruro de azufre | |
| Fórmula molecular | SF4 | |
| Identificadores | ||
| Número CAS | 7783-60-0[1] | |
| Propiedades físicas | ||
| Apariencia | transparente | |
| Masa molar | 108,07 g/mol | |
| Punto de fusión | −121.0 | |
| Punto de ebullición | −38 | |
| Propiedades químicas | ||
| Momento dipolar | 0.632 D D | |
| Peligrosidad | ||
| NFPA 704 |
0
3
2
W
| |
| Frases R | R26 R35 | |
| Frases S | S(1) S9 S26 S36/37/39 S45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura
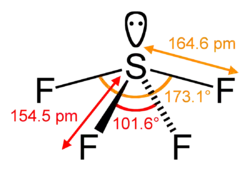
El azufre en SF4 esta formalmente en un estado de oxidación +4. Del total de azufre electrones de valencia: seis , dos forman un par solitario. La estructura del SF4 por lo tanto se puede prever empleando los principios de la teoría de VSEPR: es una forma de balancín, con el azufre en el centro. Una de las tres posiciones ecuatoriales está ocupado por un enlazante par solitario de electrones. Por consiguiente, la molécula tiene dos tipos distintos de enlaces F, dos axiales y dos ecuatorial. Las distancias de enlace pertinentes son S−Fax = 164,3 p. m. y S−Fec = 154,2 p. m.. Es típico de los enlaces axiales en las moléculas hipervalentes se más débiles. En contraste con SF4, la molécula parecida SF6 tiene azufre en el estado 6 +, no quedan electrones de valencia no enlazantes en azufre, por lo tanto, la molécula adopta una estructura octaédrica altamente simétrica. Y además contrasta con SF4, ya que el SF6 es extraordinariamente inerte químicamente.

La espetrometía de RMN del 19F en SF4 revela sólo una señal, lo que indica que los átomo flúor axial y ecuatorial interconvierten posiciones rápidamente a través de pseudorrotación.[3]
Síntesis
El tetrafluoruro se produce por fluoración del azufre por contacto directo del flúor con azufre.,[4] en lugar de flúor se puede emplear triclorofluorometano.[5]
En el laboratorio, existen varias maneras de sintetizarlo:
El resultado de la reacción de dicloruro de azufre (SCl2), cloro (Cl2), y fluoruro de sodio (NaF):[4]
El resultado de la reacción de dicloruro de azufre (SCl2) y fluoruro de sodio (NaF). La reacción de SCl2 con NaF también proporciona SF4, no SF2. Puesto que el SF2 es inestable, se condensa con sí mismo para formar SF4 y SSF2.[6]
La acción de dicloruro de azufre sobre fluoruro de sodio:
La reacción de cloro a presión con una mezcla de azufre y fluoruro de sodio :
La reacción de trifluoruro de cobalto con azufre:
Descomposición del disulfuro difluoruro:
Propiedades
Propiedades físicas
EL tetrafluoruro de azufre es un gas incoloro, no inflamable con un olor acre. Se descompone en agua con una reacción violenta, y cuando se calienta forma fluoruro de hidrógeno. Tiene una temperatura crítica de 91 °C, el punto triple está a una temperatura de -121 °C y una presión de 1,7 mbar.[7] Actúa como un ácido de Lewis débil, y forma, por ejemplo, aductos 1:1 con bases orgánicas tales como la piridina y trietilamina.
Propiedades químicas
Se descompone al calentarlo fuerte:
Reacciona con la humedad del aire:
Reacciona con el agua, hidrólisis, da dióxido de azufre:[8]
Esta reacción se produce a través de la intermediación de fluoruro de tionilo, que generalmente no interfiere con el uso de SF4 como reactivo.[6]
Reacciona con ácido nítrico caliente:
Reacciona con álcalis:
A presión elevada y con catalizador reacciona con el oxígeno:
Empleo en la síntesis de fluorcarbonados
En síntesis orgánica, se utiliza el SF4 para convertir los grupos COH y C = O en grupos CF y CF2, respectivamente.[9] Ciertos alcoholes fácilmente dar el correspondiente fluorocarbono . cetonas y aldehídos dar difluoruros geminales. La presencia de protones alfa con respecto al carbonilo conduce a reacciones secundarias y la disminución de rendimiento (% 30-40). También puede dar dioles cíclicos sulfito ésteres,(RO)2SO. Los ácidos carboxílicos convertir a derivados trifluorometilo. Por ejemplo el tratamiento de ácido heptanoico con SF4 a 100-130 °C produce 1,1,1-trifluoroheptane. Los coproductos procedentes de estas fluoraciones, incluyendo SF4 sin reaccionar junto con SOF2 y SO2, son tóxicos pero se puede neutralizar con un tratamiento con KOH acuoso.
El empleo de SF4 se está reemplazado en los últimos años por el más fácil de manejar trifluoruro dietilaminoazufre, Et2NSF3, "DAST", donde Et representa CH3CH2.[10] Este reactivo se prepara a partir SF4:[11]
- SF4 + Me3SiNEt2 → Et2NSF3 + Me3SiF
Otras reacciones
El cloruro de pentafluoruro de azufre ( SF5Cl ), una fuente útil de grupos SF5, se prepara a partir SF4.[12]
Referencias
- Número CAS
- C.-L. J. Wang, "Sulfur Tetrafluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi 10.1002/047084289.
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Georg Brauer; Handbuch der Präparativen Anorganischen Chemie, Band 1, S. 183f, ISBN 3432023286
- D. Naumann 1, Dr. (Mrs.) D. K. Padma: Die Darstellung von Schwefeltetrafluorid aus den Elementen bei tiefer Temperatur in einem inerten Lösungsmittel. In: Zeitschrift für anorganische und allgemeine Chemie. 1973, 401, 1, S. 53–56, doi 10.1002/zaac.19734010108.
- F. S. Fawcett, C. W. Tullock, "Sulfur (IV) Fluoride: (Sulfur Tetrafluoride)" Inorganic Syntheses, 1963, vol. 7, pp 119–124. doi 10.1002/9780470132388.ch33
- Entrada CAS: 7783-60-0 en la base de datos GESTIS de IFA .
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. ISBN 0080379419.
- Hasek, W. R.. "1,1,1-Trifluoroheptane". Org. Synth.; Coll. Vol. 5: 1082.
- A. H. Fauq, "N,N-Diethylaminosulfur Trifluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi 10.1002/047084289.
- W. J. Middleton, E. M. Bingham. "Diethylaminosulfur Trifluoride". Org. Synth.; Coll. Vol. 6: 440.
- Nyman, F., Roberts, H. L., Seaton, T. Inorganic Syntheses, 1966, Volume 8, p. 160 McGraw-Hill Book Company, Inc., 1966, doi 10.1002/9780470132395.ch42
