Transcriptasa inversa
La transcriptasa inversa (también, transcriptasa reversa, retrotranscriptasa) es una enzima de tipo ADN polimerasa que tiene como función sintetizar ADN de doble cadena utilizando como molde ARN monocatenario, es decir, catalizar la retrotranscripción o transcripción inversa. Se encuentra presente en los retrovirus. Su nombre obedece a que el proceso normal de la transcripción, la que se puede llamar «directa», codifica el ARN a partir de la secuencia inicial de ADN, y no al revés.[cita requerida]
| Transcriptasa inversa | ||
|---|---|---|
 | ||
| Identificadores | ||
| Identificadores externos | ||
Una forma sencilla de síntesis de ADN de doble cadena a partir de transcriptasa inversa, también llamada ADN/ARN-polimerasa dirigida, sería partir de un cebador cola de poli-T que establecería bases complementarias con la cola de poli-A del ARN transcrito de la hebra que se va a sintetizar, lo que forma un híbrido ARN/ADN. Dicho híbrido podría separarse mediante ribonucleasas, y después, con la acción de una ADN-polimerasa y un nuevo cebador, ser completada la hebra de ADN de doble cadena.[cita requerida]
En la biología molecular y la bioquímica, la transcriptasa inversa, también conocida como ADN polimerasa dependiente de ARN, es una enzima ADN polimerasa que transcribe, desde una sola cadena de ARN, una sola cadena de ADN. También ayuda en la formación de una doble hélice de ADN una vez que el ARN ha experimentado una transcripción inversa en una sola cadena de ADNc. La transcripción inversa implica la síntesis de ADN a partir del ARN.
La transcriptasa inversa fue descubierta por Howard Temin en la Universidad de Wisconsin-Madison, y de forma independiente por David Baltimore en 1970, en el MIT. Los dos compartieron el Premio Nobel de Fisiología o Medicina en 1975 con Renato Dulbecco por su descubrimiento. Transcriptasas inversas bien estudiadas incluyen:
- transcriptasa inversa del virus de la inmunodeficiencia humana VIH-1 (Véase Subtipos de VIH)
- transcriptasa inversa M-MLV del virus de la leucemia murina Moloney
- transcriptasa inversa AMV del virus de la mieloblastosis aviar
- telomerasa, transcriptasa inversa que mantiene a los telómeros de los cromosomas eucariotas
Función de los virus
La enzima está codificada y utilizada por los virus en la transcripción inversa, utilizan la enzima durante el proceso de replicación. La transcripción inversa de los virus de ARN, como los retrovirus, utilizan la enzima en su genoma para el paso de ARN en ADN, que se integra en el genoma huésped y se replica junto con él. La transcripción inversa de los virus de ADN, como el hepadnavirus, puede permitir que el ARN sirva de plantilla en el montaje, haciendo cadenas de ADN. El VIH infecta a los seres humanos gracias a esta enzima. Sin la transcriptasa inversa, el genoma viral no sería capaz de incorporarse en la célula huésped, a causa de la incapacidad de los virus para autorreplicarse. A diferencia de las bacterias, los retrovirus utilizan como iniciadores los ARN de transferencia codificados en la célula huésped.
Proceso de transcripción inversa
La transcriptasa inversa crea ADN de cadena simple a partir de una plantilla de ARN. Los virus que carecen de la transcriptasa inversa sintetizan su ADN gracias a la δ polimerasa codificada del ADN de la célula huésped, que por error confunde el ARN del virus como un iniciador y sintetiza un ADN de doble cadena por la similitud del mecanismo de eliminación de imprimación, donde el ADN de nueva síntesis desplaza el ARN de la plantilla original.
El proceso de transcripción inversa es muy propenso a errores y es durante este paso cuando pueden ocurrir mutaciones. Estas mutaciones pueden causar resistencia a los medicamentos.
Proceso de transcripción inversa en el virus de clase VI

Los virus de clase VI ssARN-TR, también llamado retrovirus son virus de ARN de transcripción inversa con un ADN intermedio. Su genoma consta de dos moléculas de sentido positivo de cadena sencilla de ARN con una tapa 5 'y una cola 3' de poliadenilado. Ejemplos de retrovirus son el virus de inmunodeficiencia humana (VIH) y T-virus linfotrópico humano (HTLV). Tiene lugar en el citosol.[2] La creación de ADN de doble cadena se produce en una serie de pasos:
- Un ARNt específico celular actúa como un cebador e hibrida con una parte complementaria del genoma del virus llamado el sitio de unión del primer o PBS (del inglés Primer Binding Site).
- ADN complementario se sintetiza hacia el extremo 5', complementario a las regiones U5 (región no codificante) y R (una repetición directa que se encuentra en ambos extremos de la molécula de ARN) del ARN viral.
- Un dominio de la enzima transcriptasa inversa llamado RNAsa H degrada el ARN en el extremo 5', eliminando las regiones U5 y la R, originando un ADN monocatenario (ADNmc).
- El ARNt-primer, y el ADNmc unido, saltan al extremo 3' del genoma viral y el ADN recién sintetizado hibrida con la región R complementarias en el ARN.
- La primera molécula de ADN complementario (ADNc) extiende su síntesis hasta la región PBS. La mayoría de ARN viral es degradado por la RNasa H, excepto la región PP.
- Una vez que la primera cadena de ADN está completa, esta hace de hebra complementaria para la síntesis de la segunda hebra de ADN, que se inicia desde la región PP del ARN viral, utilizando esta fragmento remanente de ARN como cebador[3] de esta segunda molécula de ADN. La segunda cadena ADN se extiende desde PP por U3, R hasta U5.
- Después, hay otro 'salto' de la segunda cadena de ADN, y las regiones PBS de ambas cadenas van a hibridar.
- Ambas corrientes terminan de extenderse (siempre sentido 5'--> 3') Finalmente pueden incorporarse al genoma del huésped gracias a la enzima integrasa.
La creación de doble hélice del ADN también implica la transferencia de cadena, en el que hay una translocación del producto corto de ADN de síntesis inicial de ARN dependiente de ADN a aceptor regiones de plantilla en el otro extremo del genoma, que después se alcanzó y procesados por la transcriptasa inversa para su ADN-ADN dependientes de la actividad.[4]
El ARN retroviral está organizado en 5 'a la terminal 3'. El iniciador es recocido por el ARN viral en el sitio de unión del primer (PBS). La 5'terminal del ARN es llamado U5, y el ARN 3 'se llama el líder. El primer ARNt que se desarrolló constaba de 14-22 nucleótidos y constituye una base pareada dúplex con el ARN viral en PBS. Es inusual que el PBS se localice cerca de la 5 'terminal del ARN viral debido a la transcriptasa inversa sintetiza ADN de extremo 3' de la cadena en la dirección 5 'a 3'. Por lo tanto, el primer y la transcriptasa inversa deben ser reubicado en el extremo 3 'del ARN viral. Para llevar a cabo esta reposición, hay medidas múltiples y diversas enzimas como la ADN polimerasa, H ribonucleasa (RNasa H) y polinucleótidos simples son necesarios.[5]
La transcriptasa inversa del VIH también tiene actividad ribonucleasa es decir que degrada el ARN viral durante la síntesis de ADN, así como de ADN dependiente de la actividad de la ADN polimerasa que copia el sentido cadena de ADNc en un ADN antisentido para formar una doble hélice del ADN viral intermedia (vDNA).[6]
En los eucariotas
Los tramos autorreplicantes del genoma eucariota conocidos como retrotransposones utilizan la transcriptasa inversa para pasar de una posición en el genoma a otro a través de un intermediario de ARN. Se encuentran abundantemente en los genomas de plantas y animales. La telomerasa es otra transcriptasa inversa de los eucariotas, incluyendo los seres humanos, que lleva su propia plantilla de ARN que es utilizado para la replicación del ADN.[7]
En las procariotas
Las transcriptasa inversas también se encuentran en las bacterias Retron msr RNAs, distintas secuencias que codifican para la transcriptasa inversa, y se utilizan en la síntesis de msDNA. Con el fin de iniciar la síntesis de ADN, se necesita un primer. En las bacterias, el primer se sintetiza durante la replicación.[8]
Estructura
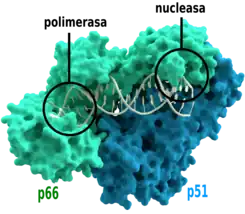
Las transcriptasas inversas son heterodímeros que incluyen una ADN polimerasa ARN-dependiente y una ADN polimerasa dependiente del ADN, que trabajan juntas para llevar a cabo la transcripción. Además de la función de la transcripción, las transcriptasas inversas retrovirales tienen un dominio perteneciente a la familia de la RNasa H, que es vital para su replicación.
Fidelidad de la replicación
Hay tres diferentes sistemas de replicación durante el ciclo de vida de un retrovirus. En primer lugar, la transcriptasa inversa sintetizan ADN viral del ARN del virus y, a continuación de la recién creada cadena de ADN complementarias. El segundo proceso de replicación celular se produce cuando la polimerasa de ADN de la célula huésped replica el ADN viral integrado. Por último, la ARN polimerasa II transcribe el ADN proviral en ARN, que se coloca en viriones. Por lo tanto, la mutación puede ocurrir durante uno o todos estos pasos de la replicación.[9]
La transcriptasa inversa tiene una elevada tasa de error al transcribir el ARN en ADN, ya que, a diferencia de ADN polimerasas, no tiene la capacidad de corrección de errores. Esta elevada tasa de error permite que las mutaciones que se acumulen a un ritmo acelerado con respecto a la corrección de las formas de replicación. La transcriptasa inversa disponible comercialmente producida por Promega posee una tasa de error con en el rango de 1 de cada 17 000 bases de la AMV y 1 de cada 30 000 bases de la M-MLV.[10]
Aplicaciones

Los medicamentos antivirales
Como el VIH utiliza la transcriptasa inversa para copiar su material genético y generar nuevos virus (parte de un círculo proliferación retrovirus), fármacos específicos han sido diseñados para interrumpir el proceso y por lo tanto suprimir su crecimiento. Colectivamente, estos fármacos son conocidos como inhibidores de transcriptasa inversa e incluyen los nucleósidos y análogos de nucleósidos zidovudina (nombre comercial de Retrovir), lamivudina (Epivir) y tenofovir (Viread), así como los inhibidores no nucleósidos, como la nevirapina (Viramune).
Biología molecular
La transcriptasa inversa se utiliza comúnmente en la investigación para aplicar la técnica de la reacción de transcripción inversa de la cadena de la polimerasa (RT-PCR). La técnica de PCR clásica sólo puede aplicarse a cadenas de ADN, pero, con la ayuda de la transcriptasa inversa, el ARN puede ser transcrito en el ADN, lo que hace el análisis de PCR de moléculas de ARN posible. La transcriptasa inversa se utiliza también para crear bibliotecas de ADNc de ARNm. La disponibilidad comercial de la transcriptasa inversa ha mejorado considerablemente el conocimiento de la biología molecular, ya que, junto a otras enzimas, permitió a los científicos clonar, la secuencia de ADN y caracterizarla.
Historia
La idea de la transcripción inversa era muy impopular en un principio, ya que contradice el dogma central de la biología molecular, que establece que el ADN se transcribe en ARN que se traduce en proteínas. Sin embargo, en 1970, cuando los científicos Howard Temin y David Baltimore descubrió de forma independiente tanto de la enzima responsable de la transcripción inversa, llamada transcriptasa inversa, la posibilidad de que la información genética podría ser transmitida de esta manera fue finalmente aceptada.
Véase también
- ADN polimerasa
- ARN polimerasa
- Biblioteca del ADN
- Marcador retrotransposón
- msDNA
- Telomerasa
- Virus de la transcripción inversa
Referencias
- PDB 3KLF ; Tu X, Das K, Han Q, Bauman JD, Clark AD Jr, Hou X, Frenkel YV, Gaffney BL, Jones RA, Boyer PL, Hughes SH, Sarafianos SG, Arnold E (septiembre de 2010). «Structural basis of HIV-1 resistance to AZT by excision.». Nat. Struct. Mol. Biol. 17 (10): 1202-9. PMC 2987654. PMID 20852643. doi:10.1038/nsmb.1908.
- Bio-Medicine.org - Retrovirus Archivado el 28 de abril de 2021 en Wayback Machine. Retrieved on 17 Feb, 2009
- «Reverse transcriptase jumps and gaps». Journal of General Virology (1996), 77, 1987-1991. Printed in Great Britain. Consultado el 20 de mayo de 2017.
- Telesnitsky, A., Goff, S.P. (1993). «Strong-stop strand transfer during reverse transcription». En Skalka, M. A., Goff, S.P, ed. Reverse transcriptase (1st edición). Nueva York: Cold Spring Harbor. p. 49. ISBN 0-87969-382-7.
- Bernstein, A.; Weiss, Robin; Tooze, John (1985). «RNA tumor viruses». Molecular Biology of Tumor Viruses (2nd edición). Cold Spring Harbor, N.Y: Cold Spring Harbor Laboratory.
- Doc Kaiser's Microbiology Home Page > IV. VIRUSES > F. ANIMAL VIRUS LIFE CYCLES > 3. The Life Cycle of HIV Community College of Baltimore County. Updated: Jan., 2008
- Monty Krieger; Matthew P Scott; Matsudaira, Paul T.; Lodish, Harvey F.; Darnell, James E.; Lawrence Zipursky; Kaiser, Chris; Arnold Berk (2004). Molecular cell biology (5th edición). Nueva York: W.H. Freeman and CO. ISBN 0-7167-4366-3.
- Hurwitz J, Leis JP (enero de 1972). «RNA-dependent DNA polymerase activity of RNA tumor viruses. I. Directing influence of DNA in the reaction». J. Virol. 9 (1): 116-29. PMC 356270. PMID 4333538.
- Bbenek, K., Kunkel, A. T (1993). «The fidelity of retroviral reverse transcriptases». En Skalka, M. A., Goff, P. S., ed. Reverse transcriptase. Nueva York: Cold Spring Harbor Laboratory Press. pp. p. 85. ISBN 0-87969-382-7.
- Promega kit instruction manual (1999)
Enlaces externos
- MeSH
- la animación de la acción de la transcriptasa inversa y tres inhibidores de la transcriptasa inversa
- Molecule of the month Archivado el 9 de abril de 2020 en Wayback Machine. (September 2002) at the Protein Data Bank
- HIV Replication 3D Medical Animation. (Nov 2008). Video by Boehringer Ingelheim.