Édition génomique
L'édition génomique ou modification localisée de séquence génomique (genome editing pour les anglophones) regroupe un ensemble de techniques de manipulation du génome visant à la modification du matériel (et donc de l'information) génétique. Ces techniques sont plus précises et ciblées que les techniques OGM historiques qui voient ces organismes transformés par transgenèse qui introduit des modifications génétiques au niveau d'un site « au hasard » dans le génome.
Les termes « édition génomique » ou « édition du génome », bien que couramment employés, sont à éviter car contrairement au mot anglais « editing », le mot « édition » ne signifie pas « modifier, corriger, retoucher ». L'expression « édition génétique » est aussi à éviter car ayant un autre sens[1].
Ces techniques peuvent être appliquées aux plantes, aux animaux[2], aux champignons et aux organismes unicellulaires, procaryotes ou eucaryotes. Certains laboratoires proposent aussi de les appliquer au génome humain.
Potentialités et limites
Les approches de modification localisée du génome sont utilisées en recherche fondamentale et dans l'industrie pour produire des cellules ou des organismes génétiquement modifiés. Ces techniques sont plus précises que les approches de transgenèse qui introduisent des modifications génétiques (souvent sous la forme d'ADN exogène) au hasard dans le génome sans contrôle précis du site d'insertion. Elles sont également plus efficaces que les premières approches de modification génétique basées sur la recombinaison homologue spontanée entre une séquence d'ADN exogène et l'ADN génomique.
Ces techniques ont notamment suscité l’espoir de ne pas soulever les mêmes réticences et controverses que les premières générations d’OGM. Certains acteurs de l'industrie agroalimentaire tentent en particulier d'utiliser des lacunes de la législation de certains pays envers les organismes qui sont génétiquement modifiés sans faire appel à un transfert d'ADN d'un organisme à un autre. Au Japon, un conseil consultatif a proposé le d’autoriser, sans évaluation sanitaire préalable, la mise sur le marché d’aliments dont les gènes ont été édités[3]. Ces approches pourraient aussi être appliquées à l'être humain dans l’objectif de corriger des mutations délétères[4]. La possibilité d'utiliser l'édition génomique afin d’améliorer le génome humain, par exemple dans le contexte du transhumanisme ou du post-humanisme, est également anticipée. Cependant la plupart des législations n'autorisent pas l'introduction de modifications génétiques transmissibles à la descendance chez l'homme.
Ces techniques encore émergentes peuvent potentiellement révolutionner la médecine personnalisée et la thérapie génique, ce pourquoi elles ont été mises en valeur par Nature Methods comme « méthodes de l'année » en 2011[5], mais elles ont aussi rapidement suscité un appât du gain et des mouvements de privatisation aux États-Unis notamment, avec de nombreuses sociétés et jeunes entreprises qui, ayant saisi le potentiel de la technologie CRISPR, ont déclenché une course aux brevets[6]. Face à cette évolution, plusieurs groupes de scientifiques ont en 2015 publiquement attiré l’attention sur des dérives possibles ou en cours concernant des utilisations non éthiques de ces technique[7],[8]. De plus, des interrogations persistent quant à la spécificité relative des outils utilisés en édition génomique et l'impact que pourraient avoir des mutations hors-cibles. Des incertitudes existent également quant à d'éventuels effets indésirables dans les cellules ou dans l'organisme résultant de l'utilisation de vecteurs pour le transfert des outils de modification génomique[9].
Principes de base de la modification en tant que technique de génie génétique
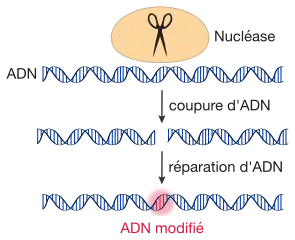
Les techniques de modification localisée du génome regroupent des techniques de génie génétique dans lesquelles un ou plusieurs morceaux d'ADN sont insérés, remplacés ou retirés d'un génome. Le mot anglais editing évoque le vocabulaire de l’informatique où la fonction « couper-coller » peut métaphoriquement aussi évoquer les « ciseaux moléculaires » maintenant couramment utilisés en ingénierie génomique.
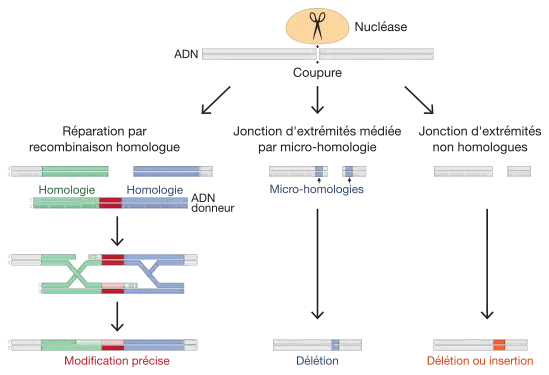
Ces ciseaux moléculaires sont des nucléases ; des enzymes de restriction qui peuvent sectionner le double-brin d’ADN à des emplacements précis, coupures auxquelles les cellules répondent par des mécanismes de réparation de l'ADN. Le principe de base des approches de modification localisée du génome consiste à utiliser ces mécanismes de réparation de l'ADN afin d'introduire des modifications génétiques. Ici, les scientifiques cherchent à exploiter les mécanismes naturels de réparation de l'ADN :
- la recombinaison homologue (RH) : c’est un type de réparation par recombinaison génétique où, à la suite d'une coupure de l'ADN, les séquences de nucléotides sont échangées entre des molécules d'ADN identiques ou similaires. Ce mécanisme est aussi à l’œuvre lors du processus de méiose, par lequel les eucaryotes créent des gamètes et de nouvelles combinaisons génétiques. La réparation par recombinaison homologue est extrêmement précise et permet d'effectuer divers types de modifications de l'ADN : mutations ponctuelles (par exemple la mutation d'un nucléotide), insertion d'étiquettes moléculaires (par exemple l'insertion de tags pour la purification biochimique pour le suivi de la localisation cellulaire en imagerie), délétions, etc. En pratique, afin de modifier un gène par recombinaison homologue, il est nécessaire d'introduire dans les cellules : 1) la nucléase dirigée contre le gène à modifier et 2) un ADN donneur qui contient la modification d'intérêt (par exemple un tag) flanqué par des séquences d'ADN dites d'homologie (identiques aux séquences situées de part et d'autre du site de coupure par la nucléase) ;
- la jonction d'extrémités médiée par micro-homologie (appelée MMEJ pour microhomology-mediated end joining) : cette voie de réparation utilise des séquences homologues de 5-25 paires de bases de part et d'autre du site de coupure, ce qui entraîne des délétions flanquant la coupure initiale[10] ;
- la jonction d'extrémités non homologues (appelée NHEJ pour non-homologous end joining) : c’est un mécanisme de réparation d'une cassure d'ADN par re-ligation des extrémités. Ce type de réparation de l'ADN est fidèle par défaut mais est sujet à des erreurs[11]. Une réparation à l'identique rétablit le site de liaison à la nucléase, engendrant un nouveau cycle de réparation. Les cycles de coupure-réparation cessent à la suite d'erreurs de réparation sous la forme de petites insertions ou délétions (aussi appelés indels, dont la taille est typiquement de moins de 20 paires de bases).
Les mutations introduites via ces deux derniers processus, lorsqu'elles surviennent dans une séquence codante, permettent d'inactiver le gène correspondant. L'inactivation peut être complète si la taille des indels n'est pas un multiple de 3 (le code génétique fonctionne par triplets de nucléotides codant des acides aminés), ce qui entraine un décalage du cadre de lecture de la protéine. Si ce décalage survient suffisamment tôt dans la séquence codante, la perte de fonction peut être complète.
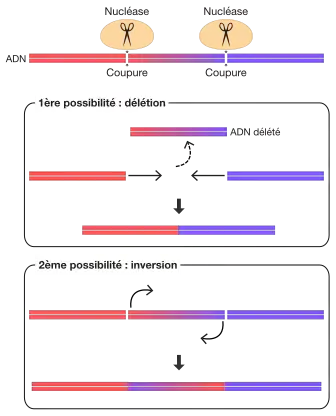
Le processus de jonction d'extrémités non homologues peut également être utilisé afin de générer des délétions ou inversions de segments d'ADN. Dans ce cas, deux nucléases coupant de part et d'autre d'un fragment d'ADN sont utilisées. Cela donne lieu à deux événements possibles de réparation : une perte (délétion) de l'ADN excisé ou une inversion de l'ADN suivie d'une re-ligation.
Les outils de base de la modification génomique : les ciseaux biomoléculaires
Quatre familles de nucléases modifiées ont été développées en laboratoire et sont de plus en plus utilisées en génie génétique[12],[2],[13] :
- méganucléases (en anglais : engineered meganuclease re-engineered homing endonucleases) conçues par génie génétique pour reconnaître et cibler des séquences spécifiques du génome ;
- nucléase à doigt de zinc (en anglais : Zinc finger nucleases ou ZFNs)[14] ;
- nucléases effectrices de type activateur de transcription (Transcription activator-like effector nuclease ou TALENs) ;
- Clustered Regularly Interspaced Short Palindromic Repeats ou CRISPR/Cas system ; une technique qui a suscité beaucoup d’espoir à la suite de progrès techniques au début des années 2010[15], et qui a aussi déclenché une course aux brevets[16],[17],[18].

Les 3 dernières génération de nucléases (ZFNs, TALENs et CRISPR/Cas) sont dites « programmables » car il est possible de définir la séquence d'ADN ciblée.
Ces outils biomoléculaires ont d’abord été utilisés (et ils le sont aujourd’hui couramment) pour l'analyse génétique, généralement afin de comprendre la fonction d'un gène, d'un groupe de gènes ou des protéines codées par ces gènes.
Chez certains modèles, la mise œuvre des outils de modification ciblée de l'ADN reste difficile. Dans de tels cas, les scientifiques utilisent des méthodes indirectes pour interférer avec l'expression des gènes telles que l'interférence par ARN (siRNA pour small interfering RNA)[19], qui permet de réduire l'expression d'un gène d'intérêt. Cependant, les perturbations obtenues par les approches de siRNA sont souvent incomplètes, peuvent être instables au cours du temps et sont sujettes à d'importants effets indirects[20].
De surcroît, les approches de modification génomique permettent de modifier et donc d'interférer avec la fonction de séquences d'ADN impliquées dans la régulation de l'expression des gènes comme les amplificateurs transcriptionnels (enhancer en anglais), ce qu'il n'est pas possible de faire avec les approches par siRNA.
Les méganucléases
Ces enzymes cytotoxiques sont naturellement produites par certaines espèces microbiennes (champignons unicellulaires). Elles présentent une particularité unique qui les a rendu intéressantes pour les biotechnologies : leur séquence de reconnaissance est beaucoup plus grande que les endonucléases bactériennes « classiques » (> 14 pb) ce qui les rend ainsi naturellement très spécifique[21],[22]. On connaît un petit nombre de méganucléases, loin de pouvoir couvrir toutes les séquences cibles possibles utiles à la médecine ou recherchées par l’industrie des biotechnologies[22].
Des techniques de mutagenèse et des méthodes d’analyse à haut débit ont été utilisées pour créer des variantes de méganucléases artificielles capables de reconnaître des séquences d’intérêt médical, scientifique ou commercial[22].
Une autre piste, qui a donné certains résultats a consisté à fusionner diverses méganucléases existantes, pour créer des enzymes hybrides ciblant une nouvelle séquence[23]. Des scientifiques ont aussi tenté de modifier des méganucléases existantes pour qu’elles reconnaissent des séquences génétiques spécifiques, via un procédé dit « méganucléase rationnellement conçue » (brevet US 8,021,867 B2).
L’introduction contrôlée d’une méganucléase spécifique dans une cellule serait moins toxiques pour la cellule que l’utilisation de procédés de type ZFN, probablement en raison d’une meilleure reconnaissance de la séquence d'ADN recherchée[22]; mais, la construction artificielle de telles enzymes spécifiques est longue et coûteuse et ne bénéficie pas des possibilités combinatoires qui sont celles des méthodes concurrentes telles que ZFN et TALENs.
Les avantages et inconvénients respectifs des diverses méthodes ne sont pas encore clairs et pourraient encore évoluer au gré des avancées scientifiques et techniques.
Les outils ZFNs et TALENs
Ils sont basés sur un autre concept opérationnel : l'association d'une nucléase non spécifique (qui ne reconnait pas de séquence d'ADN particulière) et de domaines de liaison à l'ADN capables de se lier à des séquences spécifiques (ex : « doigts de zinc » ou effecteurs de type « transcription activator-like »)[24].
Pour cela il fallait trouver une endonucléase dont la partie consacrée à la reconnaissance de l'ADN était différente de la partie responsable du clivage de l’ADN, une situation rare parmi des enzymes de restriction connues[24] et pouvoir séparer les deux parties de cette enzyme pour conserver la paire de ciseaux et l’accrocher à une autre molécule jouant le rôle de tête chercheuse. Une telle enzyme a été trouvée à la fin des années 1980 : une enzyme de restriction trouvé chez une flavobactérie (Flavobacterium okeanokoites[25], et pour cette raison dénommé FokI[26]). En outre, cette enzyme nécessite d'être sous la forme d'un dimère afin de cliver l'ADN[27]. Deux monomères de FokI doivent donc être recrutés indépendamment au niveau d'une séquence d'ADN d'intérêt afin de générer une coupure de l'ADN, ce qui augmente considérablement la spécificité de l'enzyme. La fusion de FokI avec les domaines ZFN et TALE a permis de créer des enzymes de restriction ayant la capacité de reconnaître quasiment toutes les séquences d'intérêt[28],[29],[30].
Le , la société Calyxt annonce la commercialisation d'une huile de soja modifiée en utilisant les TALENs. Cette huile, à haute teneur en acide oléique, est exempte de gras trans et offre des graisses saturées réduites comme ingrédient alimentaire[31].
L'outil CRISPR-Cas
Le système CRISPR-Cas est un système immunitaire procaryote qui confère une résistance contre les éléments génétiques étrangers tels que ceux présents dans les plasmides et les phages[32],[33],[34] fournissant une forme d'immunité acquise. L'ARN guide héberge une séquence appelée « spacer » qui aide les protéines Cas (associées à CRISPR) à reconnaître et à couper l'ADN étranger pathogène. D'autres protéines Cas guidées par l'ARN sont capables de couper l'ARN étranger[35].
Le systèmes CRISPR le mieux étudié est le CRISPR-Cas9 de Streptococcus pyogenes (dont la protéine Cas9 est pour cette raison appelée SpCas9). Des groupes dirigés par Feng Zhang et George Church ont simultanément publié pour la première fois des descriptions de l'édition du génome dans des cultures de cellules humaines en utilisant CRISPR-Cas9[36],[37],[38]. Depuis lors, il a été utilisé chez un grand nombre d'organismes, notamment la levure de boulanger (Saccharomyces cerevisiæ) [39],[40],[41] l'agent pathogène opportuniste Candida albicans[42],[43], le poisson zèbre (Danio rerio)[44], la mouche du vinaigre (Drosophila melanogaster)[45],[46], des fourmis (Harpegnathos saltator (en)[47] et Ooceræa biroi[48]), des moustiques (Ædes ægypti)[49], des nématodes (Cænorhabditis elegans)[50], des plantes[51], des souris[52], des singes[53] et des embryons humains[54].
Contrairement aux méthodes TALEN et aux nucléases aux ZFNs, le ciblage de l'ADN par Cas9 est direct et ne requiert pas de modification de la protéine mais seulement de l‘ARN guide[55],[56]. Des versions modifiées de la protéine Cas9 qui se lient mais ne coupent pas l'ADN peuvent être de plus utilisées pour localiser des activateurs ou des suppresseurs de transcription de séquences d'ADN spécifiques afin de contrôler la transcription de gènes d'intérêt[57],[58]. Le ciblage Cas9 a été notamment simplifié grâce à la création d’ARN chimérique unique. Des scientifiques ont suggéré que la technologie Cas9 avait le potentiel pour modifier les génomes de groupes entiers d'organismes[59]. En 2015, des scientifiques en Chine ont utilisé Cas9 pour modifier le génome d'embryons humains pour la première fois[60]. Depuis 2015 et toujours en Chine, des essais thérapeutiques utilisant la technologie CRISPR-Cas9 ont été amorcés sur des patients atteints notamment de cancers[61].
Stratégies de contrôle des voies de réparation de l'ADN
Au vu des différents types de réparation qui sont mis en œuvre à la suite d'une coupure de l'ADN, un des problèmes majeurs de l'édition génomique est d'obtenir, parmi les différentes possibilités, la modification désirée. Or le choix du type de voie de réparation d'ADN utilisé est un processus complexe. Ce choix est en partie dicté par la phase du cycle cellulaire dans laquelle se trouvent les cellules au moment de la coupure. La voie de RH répare l'ADN avant que la cellule n'entre en mitose (phase M). Elle se produit pendant et peu après la réplication de l'ADN, dans les phases S et G2 du cycle cellulaire, lorsque les chromatides sœurs sont plus facilement disponibles. La voie NHEJ quant à elle est active pendant toutes les phases du cycle cellulaire[62]. Par conséquent, des modifications précises nécessitant une réparation par recombinaison homologue ont généralement plus de chance de succès dans des cellules à forte prolifération puisque la proportion de cellules qui sont dans les phases S/G2 y est plus importante.
Plusieurs stratégies sont cependant utilisées afin de faciliter l'obtention de la modification génétique d'intérêt.
Stratégies d'enrichissement des cellules portant une modification génétique
Il s'agit de stratégies permettant la sélection des cellules génétiquement modifiées.
Dans le cas des modifications par HR, la stratégie d'enrichissement la plus courante est l'insertion, en plus de la modification d'intérêt, d'un marqueur de sélection. Les marqueurs de sélection les plus employés sont principalement les gènes de résistance à des antibiotiques permettant une sélection positive par traitement antibiotique des cellules modifiées et des gènes codant des protéines fluorescentes qui permettent de trier les cellules modifiées génétiquement par cytométrie en flux.
Stratégies visant à biaiser l'utilisation des voies de réparation
Les voies MMEJ et NHEJ étant prépondérantes sur la voie de RH dans la plupart des types cellulaires, plusieurs types de stratégies sont développées afin de favoriser la réparation par RH. Une première stratégie consiste à inhiber la voie NHEJ ce qui favorise l'utilisation voies de réparation alternatives MMEJ ou RH[63],[64].
Une deuxième stratégie utilise la nucléase comme plateforme pour le recrutement de composants de la machinerie moléculaire de RH afin de favoriser localement l'utilisation de ce type de réparation[65],[66].
Risques et controverses
Comme d’autres méthodes de manipulation du génome, les approches de modification locale du génome fait l’objet de controverses en particulier dans le cadre d'applications à l'homme.
Ainsi deux groupes de scientifiques ont respectivement publié en 2015 dans les la revue Science[67] et dans la revue Nature[68] un appel à moratoire dans le domaine de la correction génomique appliquée au génome humain (y compris par des manipulations portant sur les gènes présents dans le sperme, les ovules et les embryons humains, car si les ciseaux à ADN permettent théoriquement de combattre certaines maladies par la thérapie génique[18], ils permettent aussi (par n’importe quelle personne ayant une simple formation de base à la biologie moléculaire) d’introduire des informations génétiques nouvelles, et éventuellement délétères.
Ces scientifiques estiment que le bond technologique récent qui nous permet de facilement modifier notre patrimoine génétique et celui d’autres êtres vivants (éventuellement disparus) doit faire l’objet de réflexions éthiques approfondies (ils s’inquiètent par exemple de rumeurs qui laissent penser que des chercheurs chinois ont expérimenté des modifications de génomes sur des bébés humains et de voir des exemples comme la proposition faite en 2012 par George Church, promoteur de la biologie de synthèse, de reconstituer intégralement le génome de l’homme de Néandertal à partir de celui de l’Homo sapiens[69]. Ces chercheurs craignent que la mauvaise publicité faite par de telles expériences puisse engendrer dans le public et chez les décideurs des réactions d’hostilité à ces techniques, y compris pour des usages légitimes (thérapie génique).
Dans les commentaires respectivement publiés en ligne dans Science le et dans la revue Nature le , ces deux groupes de chercheurs font des propositions de mesures à prendre par la communauté scientifique pour constituer un cadre éthique et sécurisé à ces biotechnologies émergentes.
Notes et références
- P. D’Iorio, « Qu’est-ce qu’une édition génétique numérique ? », Genesis. Manuscrits-Recherche-Invention, no 30, 2010, pp. 49-53.
- W. S. Tan, D. F. Carlson, M. W. Walton, S. C. Fahrenkrug, P. B. Hackett, « Precision editing of large animal genomes », Adv Genet., no 80, 2012, pp. 37-97 doi:10.1016/B978-0-12-404742-6.00002-8. PMC 3683964. .
- « CRISPR : des aliments génétiquement édités bientôt dans les supermarchés japonais ? », Courrier international.
- D. F. Carlson & S. C. Fahrenkrug, « Targeting DNA with fingers and TALENs » (PDF), Molecular Therapy- Nucleic Acids, vol. 1, no 3, 2012 doi:10.1038/mtna.2011.5. Consulté 11 novembre 2014.
- « Method of the Year 2011 », Nat. Meth., vol. 9, no 1, 2011, p. 1-1.
- Antonio Regalado, « Who Owns the Biggest Biotech Discovery of the Century? », MIT Technology Review, 04/12/2014.
- Gretchen Vogel, « Bioethics. Embryo engineering alarm », Science (New York, N.Y.), vol. 347, no 6228, , p. 1301 (ISSN 1095-9203, PMID 25792311, DOI 10.1126/science.347.6228.1301, lire en ligne, consulté le ).
- Daniel F. Carlson, Scott C. Fahrenkrug et Perry B. Hackett, « Targeting DNA With Fingers and TALENs », Molecular therapy. Nucleic acids, vol. 1, no 1, , e3 (ISSN 2162-2531, PMID 23344620, PMCID 3381595, DOI 10.1038/mtna.2011.5, lire en ligne, consulté le ).
- Thomas Gaj, Charles A. Gersbach et Carlos F. Barbas, « ZFN, TALEN and CRISPR/Cas-based methods for genome engineering », Trends in biotechnology, vol. 31, no 7, , p. 397-405 (ISSN 0167-7799, PMID 23664777, PMCID 3694601, DOI 10.1016/j.tibtech.2013.04.004, lire en ligne, consulté le ).
- Mitch McVey et Sang Eun Lee, « MMEJ repair of double-strand breaks (director's cut): deleted sequences and alternative endings », Trends in genetics: TIG, vol. 24, no 11, , p. 529-538 (ISSN 0168-9525, PMID 18809224, PMCID 5303623, DOI 10.1016/j.tig.2008.08.007, lire en ligne, consulté le ).
- Mireille Bétermier, Pascale Bertrand et Bernard S. Lopez, « Is non-homologous end-joining really an inherently error-prone process? », PLoS genetics, vol. 10, no 1, , e1004086 (ISSN 1553-7404, PMID 24453986, PMCID 3894167, DOI 10.1371/journal.pgen.1004086, lire en ligne, consulté le ).
- K. M. Esvelt, H. H. Wang, « Genome-scale engineering for systems and synthetic biology », Mol. Syst. Biol., vol. 9, no 1, 2013, p. 641 doi:10.1038/msb.2012.66. PMC 3564264. .
- Holger Puchta et Friedrich Fauser, « Gene targeting in plants: 25 years later », The International Journal of Developmental Biology, vol. 57, nos 6-8, , p. 629-637 (ISSN 1696-3547, PMID 24166445, DOI 10.1387/ijdb.130194hp, lire en ligne, consulté le ).
- Y. G. Kim, J. Cha et S. Chandrasegaran, « Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain », Proceedings of the National Academy of Sciences of the United States of America, vol. 93, no 3, , p. 1156-1160 (ISSN 0027-8424, PMID 8577732, PMCID PMC40048, DOI 10.1073/pnas.93.3.1156, lire en ligne, consulté le ).
- Le Cong, F. Ann Ran, David Cox et Shuailiang Lin, « Multiplex Genome Engineering Using CRISPR/Cas Systems », Science (New York, N.Y.), vol. 339, no 6121, , p. 819-823 (ISSN 0036-8075, PMID 23287718, PMCID 3795411, DOI 10.1126/science.1231143, lire en ligne, consulté le ).
- « Revolutionizing genome engineering: Review on history and future of the CRISPR-Cas9 system published », phys.org, 01/12/2014.
- Jacob S. Sherkow, « Patent protection for CRISPR: an ELSI review », Journal of Law and the Biosciences, vol. 4, no 3, , p. 565-576 (ISSN 2053-9711, PMID 29868185, PMCID 5965580, DOI 10.1093/jlb/lsx036, lire en ligne, consulté le ).
- BE États-Unis 386 - 12/12/2014 / Sciences de la vie / « Les nucléases, de fabuleux outils pour la chirurgie du génome : les États-Unis se mobilisent », france-science.org.
- A. Fire, S. Xu, M. K. Montgomery et S. A. Kostas, « Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans », Nature, vol. 391, no 6669, , p. 806-811 (ISSN 0028-0836, PMID 9486653, DOI 10.1038/35888, lire en ligne, consulté le )
- Aimee L. Jackson et Peter S. Linsley, « Recognizing and avoiding siRNA off-target effects for target identification and therapeutic application », Nature Reviews. Drug Discovery, vol. 9, no 1, , p. 57-67 (ISSN 1474-1784, PMID 20043028, DOI 10.1038/nrd3010, lire en ligne, consulté le ).
- N. de Souza, « Primer: genome editing with engineered nucleases », Nat. Meth., vol. 9, no 1, 2011, pp. 27-27.
- J. Smith et al., « A combinatorial approach to create artificial homing endonucleases cleaving chosen sequences », Nucleic Acids Research, vol. 34, no 22, 2006, p. e149.
- B. S. Chevalier et al., « Design, Activity, and Structure of a Highly Specific Artificial Endonuclease », Molecular Cell, no 10, no 4, 2002, pp. 895-905.
- M. Baker, « Gene-editing nucleases », Nat. Meth., vol. 9, no 1, 2012, pp. 23-26.
- S. Hiroyuki & K. Susumu, «New restriction endonucleases from Flavobacterium okeanokoites (FokI) and Micrococcus luteus (MluI) », Gene, vol. 16, no 1, 1981, pp. 73-78 (résumé).
- D. A. Wah, J. A. Hirsch, L. F. Dorner, I. Schildkraut, & A. K. Aggarwal, « Structure of the multimodular endonuclease FokI bound to DNA », Nature, vol. 388, no 6637, 1997, pp. 97-100.
- J. Bitinaite, D. A. Wah, A. K. Aggarwal & I. Schildkraut, « FokI dimerization is required for DNA cleavage », Proceedings of the national academy of sciences, vol. 95, no 18, 1998, pp. 10570-10575.
- A. J. Podhajska & W. Szybalski, « Conversion of the FokI endonuclease to a universal restriction enzyme: cleavage of phage M13mp7 DNA at predetermined sites », Gene, vol. 40, no 2, 1985, pp. 175-182 (résumé).
- W. Mandecki, T. J. Boiling, « FokI method of gene synthesis », Gene, vol. 68, no 1, 1988, pp. 101-107 (résumé).
- T. Li, S. Huang, W. Z. Jiang, D. Wright, M. H. Spalding, D. P. Weeks, B. Yang, « TAL nucleases (TALNs): hybrid proteins composed of TAL effectors and FokI DNA-cleavage domain », Nucleic acids research, vol. 39, no 1, 2011, pp. 359-372.
- « The latest gene-edited food is a soybean oil that comes with zero trans fats », Forbes.
- « What is CRISPR/Cas9? », Archives of Disease in Childhood. Education and Practice Edition, vol. 101, no 4, , p. 213-5 (PMID 27059283, PMCID 4975809, DOI 10.1136/archdischild-2016-310459).
- « CRISPR provides acquired resistance against viruses in prokaryotes », Science, vol. 315, no 5819, , p. 1709-12 (PMID 17379808, DOI 10.1126/science.1138140
 , Bibcode 2007Sci...315.1709B).
, Bibcode 2007Sci...315.1709B). - « CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA », Science, vol. 322, no 5909, , p. 1843-5 (PMID 19095942, PMCID 2695655, DOI 10.1126/science.1165771, Bibcode 2008Sci...322.1843M).
- « Diverse evolutionary roots and mechanistic variations of the CRISPR-Cas systems », Science, vol. 353, no 6299, , aad5147 (PMID 27493190, DOI 10.1126/science.aad5147).
- « Development and applications of CRISPR-Cas9 for genome engineering », Cell, vol. 157, no 6, , p. 1262-78 (PMID 24906146, PMCID 4343198, DOI 10.1016/j.cell.2014.05.010).
- « Multiplex genome engineering using CRISPR/Cas systems », Science, vol. 339, no 6121, , p. 819-23 (PMID 23287718, PMCID 3795411, DOI 10.1126/science.1231143, Bibcode 2013Sci...339..819C).
- « RNA-guided human genome engineering via Cas9 », Science, vol. 339, no 6121, , p. 823-6 (PMID 23287722, PMCID 3712628, DOI 10.1126/science.1232033, Bibcode 2013Sci...339..823M).
- « Genome engineering in Saccharomyces cerevisiae using CRISPR-Cas systems », Nucleic Acids Research, vol. 41, no 7, , p. 4336-43 (PMID 23460208, PMCID 3627607, DOI 10.1093/nar/gkt135).
- « Construction of a quadruple auxotrophic mutant of an industrial polyploid saccharomyces cerevisiae strain by using RNA-guided Cas9 nuclease », Applied and Environmental Microbiology, vol. 80, no 24, , p. 7694-701 (PMID 25281382, PMCID 4249234, DOI 10.1128/AEM.02310-14).
- « Metabolic Engineering of Probiotic Saccharomyces boulardii », Applied and Environmental Microbiology, vol. 82, no 8, , p. 2280-2287 (PMID 26850302, PMCID 4959471, DOI 10.1128/AEM.00057-16).
- « Candida albicans CRISPR system permits genetic engineering of essential genes and gene families », Science Advances, vol. 1, no 3, , e1500248 (PMID 25977940, PMCID 4428347, DOI 10.1126/sciadv.1500248, Bibcode 2015SciA....1E0248V).
- « Candida albicans by Increased Single Guide RNA Expression », mSphere, vol. 2, no 2, , e00385-16 (PMID 28435892, PMCID 5397569, DOI 10.1128/mSphere.00385-16).
- « Efficient genome editing in zebrafish using a CRISPR-Cas system », Nature Biotechnology, vol. 31, no 3, , p. 227-9 (PMID 23360964, PMCID 3686313, DOI 10.1038/nbt.2501).
- « Genome engineering of Drosophila with the CRISPR RNA-guided Cas9 nuclease », Genetics, vol. 194, no 4, , p. 1029-35 (PMID 23709638, PMCID 3730909, DOI 10.1534/genetics.113.152710).
- « Highly efficient targeted mutagenesis of Drosophila with the CRISPR/Cas9 system », Cell Reports, vol. 4, no 1, , p. 220-8 (PMID 23827738, PMCID 3714591, DOI 10.1016/j.celrep.2013.06.020).
- « An Engineered orco Mutation Produces Aberrant Social Behavior and Defective Neural Development in Ants », Cell, vol. 170, no 4, , p. 736-747.e9 (PMID 28802043, PMCID 5587193, DOI 10.1016/j.cell.2017.06.051, lire en ligne).
- « orco Mutagenesis Causes Loss of Antennal Lobe Glomeruli and Impaired Social Behavior in Ants », Cell, vol. 170, no 4, , p. 727-735.e10 (PMID 28802042, PMCID 5556950, DOI 10.1016/j.cell.2017.07.001, lire en ligne).
- « Genome engineering with CRISPR-Cas9 in the mosquito Aedes aegypti », Cell Reports, vol. 11, no 1, , p. 51-60 (PMID 25818303, PMCID 4394034, DOI 10.1016/j.celrep.2015.03.009, lire en ligne).
- « Heritable genome editing in C. elegans via a CRISPR-Cas9 system », Nature Methods, vol. 10, no 8, , p. 741-3 (PMID 23817069, PMCID 3822328, DOI 10.1038/nmeth.2532).
- « Demonstration of CRISPR/Cas9/sgRNA-mediated targeted gene modification in Arabidopsis, tobacco, sorghum and rice », Nucleic Acids Research, vol. 41, no 20, , e188 (PMID 23999092, PMCID 3814374, DOI 10.1093/nar/gkt780).
- « One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering », Cell, vol. 153, no 4, , p. 910-8 (PMID 23643243, PMCID 3969854, DOI 10.1016/j.cell.2013.04.025).
- « Targeted genome editing in primate embryos », Cell Research, vol. 25, no 7, , p. 767-8 (PMID 26032266, PMCID 4493275, DOI 10.1038/cr.2015.64).
- « Biotechnology. A prudent path forward for genomic engineering and germline gene modification », Science, vol. 348, no 6230, , p. 36-8 (PMID 25791083, PMCID 4394183, DOI 10.1126/science.aab1028, Bibcode 2015Sci...348...36B).
- (en) Le Cong, F. Ann Ran, David Cox et Shuailiang Lin, « Multiplex Genome Engineering Using CRISPR/Cas Systems », Science, vol. 339, no 6121, , p. 819-823 (ISSN 0036-8075 et 1095-9203, PMID 23287718, PMCID PMC3795411, DOI 10.1126/science.1231143, lire en ligne, consulté le ).
- Prashant Mali, Kevin M. Esvelt et George M. Church, « Cas9 as a versatile tool for engineering biology », Nature Methods, vol. 10, no 10, , p. 957-963 (ISSN 1548-7105, PMID 24076990, PMCID PMC4051438, DOI 10.1038/nmeth.2649, lire en ligne, consulté le ).
- Prashant Mali, John Aach, P. Benjamin Stranges et Kevin M. Esvelt, « CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering », Nature Biotechnology, vol. 31, no 9, , p. 833-838 (ISSN 1546-1696, PMID 23907171, PMCID PMC3818127, DOI 10.1038/nbt.2675, lire en ligne, consulté le ).
- Luke A. Gilbert, Matthew H. Larson, Leonardo Morsut et Zairan Liu, « CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes », Cell, vol. 154, no 2, , p. 442-451 (ISSN 0092-8674, PMID 23849981, PMCID PMC3770145, DOI 10.1016/j.cell.2013.06.044, lire en ligne, consulté le ).
- Kevin M. Esvelt, Andrea L. Smidler, Flaminia Catteruccia et George M. Church, « Concerning RNA-guided gene drives for the alteration of wild populations », eLife, vol. 3, (ISSN 2050-084X, PMID 25035423, PMCID PMC4117217, DOI 10.7554/eLife.03401, lire en ligne, consulté le ).
- (en) David Cyranoski et Sara Reardon, « Chinese scientists genetically modify human embryos », Nature, (DOI 10.1038/nature.2015.17378, lire en ligne, consulté le ).
- (en-US) Preetika Rana, Amy Dockser Marcus et Wenxin Fan, « China, Unhampered by Rules, Races Ahead in Gene-Editing Trials », Wall Street Journal, (ISSN 0099-9660, lire en ligne, consulté le ).
- Kai Rothkamm, Ines Krüger, Larry H. Thompson et Markus Löbrich, « Pathways of DNA double-strand break repair during the mammalian cell cycle », Molecular and Cellular Biology, vol. 23, no 16, , p. 5706-5715 (ISSN 0270-7306, PMID 12897142, PMCID PMC166351, DOI 10.1128/mcb.23.16.5706-5715.2003, lire en ligne, consulté le ).
- Takeshi Maruyama, Stephanie K. Dougan, Matthias C. Truttmann et Angelina M. Bilate, « Increasing the efficiency of precise genome editing with CRISPR-Cas9 by inhibition of nonhomologous end joining », Nature Biotechnology, vol. 33, no 5, , p. 538-542 (ISSN 1546-1696, PMID 25798939, PMCID 4618510, DOI 10.1038/nbt.3190, lire en ligne, consulté le ).
- Marella D. Canny, Nathalie Moatti, Leo C. K. Wan et Amélie Fradet-Turcotte, « Inhibition of 53BP1 favors homology-dependent DNA repair and increases CRISPR-Cas9 genome-editing efficiency », Nature Biotechnology, vol. 36, no 1, , p. 95-102 (ISSN 1546-1696, PMID 29176614, PMCID 5762392, DOI 10.1038/nbt.4021, lire en ligne, consulté le ).
- Shota Nakade, Keiji Mochida, Atsushi Kunii et Kazuki Nakamae, « Biased genome editing using the local accumulation of DSB repair molecules system », Nature Communications, vol. 9, no 1, 08 16, 2018, p. 3270 (ISSN 2041-1723, PMID 30115916, PMCID 6095859, DOI 10.1038/s41467-018-05773-6, lire en ligne, consulté le ).
- M. Charpentier, A. H. Y. Khedher, S. Menoret et A. Brion, « CtIP fusion to Cas9 enhances transgene integration by homology-dependent repair », Nature Communications, vol. 9, no 1, 03 19, 2018, p. 1133 (ISSN 2041-1723, PMID 29556040, PMCID 5859065, DOI 10.1038/s41467-018-03475-7, lire en ligne, consulté le ).
- « Embryo engineering alarm, researchers call for restraint in genome editing », Science.
- Gretchen Vogel, « Don’t edit the human germ line Nature », Nature, 19 mars 2015.
- G. Church & E. Regis, Regenesis, how synthetic biology will reinvent nature and ourselves, Basis Books, New York, 2012.
Voir aussi
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Genome editing » (voir la liste des auteurs).
Bibliographie
- B. S. Chevalier et al., « Design, Activity, and Structure of a Highly Specific Artificial Endonuclease », Molecular Cell, vol. 10, no 4, 2002, pp. 895-905.
- K. M. Esvelt, HH. Wang, « Genome-scale engineering for systems and synthetic biology », Mol. Syst. Biol., vol. 9, no 1, 2013, p. 641. doi:10.1038/msb.2012.66. PMC 3564264. .
- M. A. McMahon, M. Rahdar & M. Porteus, « Gene editing: not just for translation anymore », Nat. Meth., vol. 9, no 1, 2012, pp. 28-31.
- J. Maria, « Genetic manipulation of genomes with rare-cutting endonucleases », Trends in Genetics, vol. 12, no 6, 1996, pp. 224-228.
- H. Puchta & B. Hohn, « Breaking news: Plants mutate right on target », Proceedings of the National Academy of Sciences, vol. 107, no 26, 2010, pp. 11657-11658.
- N. de Souza, « Primer: genome editing with engineered nucleases », Nat. Meth., vol. 9, no 1, 2011, p. 27.
- J. Smith et al., « A combinatorial approach to create artificial homing endonucleases cleaving chosen sequences », Nucleic Acids Research, vol. 34, no 22, 2006, p. e149.
- V. K. Shukla et al., « Precise genome modification in the crop species Zea mays using zinc-finger nucleases », Nature, vol. 459, no 7245, 2009, pp. 437-U156.
- W. S. Tan, D. F. Carlson, M. W. Walton, S. C. Fahrenkrug, P. B. Hackett, « Precision editing of large animal genomes », Adv. Genet., no 80, 2012, pp. 37-97. doi:10.1016/B978-0-12-404742-6.00002-8. PMC 3683964. .
- G. Witzany, « The agents of natural genome editing », J. Mol. Cell. Biol., vol. 3, no 3, 2011, pp. 181-189. doi:10.1093/jmcb/mjr005. .
- (en) Jennifer A. Doudna, « The promise and challenge of therapeutic genome editing », Nature, vol. 578, , p. 229-236 (DOI 10.1038/s41586-020-1978-5)
Articles connexes
Liens externes
- Dossier d'information de l'INSERM sur l'édition génomique.
- rapport de l'académie nationale de médecine sur les modifications du génome des cellules germinales et de l’embryon humains (2016).
- Portail de la biologie cellulaire et moléculaire