Érythropoïèse
Chez les êtres humains, la production des globules rouges, l'érythropoïèse (du grecque ερυθρος, "rouge", et ποιησις, "action de faire"), se fait dans la moelle osseuse. Les globules rouges assurent le transport de l'oxygène des poumons vers les organes et du dioxyde de carbone des organes vers les poumons. Environ la moitié du sang est composée de globules rouges dont 2 à 3 millions et sont créés chaque seconde et autant détruits.
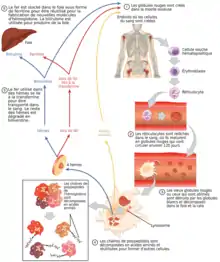
Description chez les êtres humains adultes
Globules rouges

Une femme a environ 5 l et un homme 5,5 l de sang dans son corps. Ce sang est formé à 58 % (55 % chez l'homme) d'un liquide, le plasma sanguin, et de 42 % de globules rouges (45 % chez l'homme). Les autres cellules sanguines, principalement des globules blancs et des plaquettes, représentent moins de 1 % du sang. Chaque millilitre de sang contient environ 5 milliards de globules rouges[1]. Les globules rouges sont responsables du transport de l'oxygène (O2) des poumons vers les cellules et du dioxyde de carbone (CO2) des cellules vers les poumons (voir respiration).
Ils se présentent sous forme de disque, creusés en leur centre, d'un diamètre de 7,5 μm (7,5 micromètres) et d'une épaisseur de 2,5 μm[2]. Cette forme particulière augmente la surface d’échange entre l’intérieur et l’extérieur et les rend particulièrement aptes à glisser dans les vaisseaux sanguins. Ce sont des cellules sans noyau, ni mitochondries, ni ribosomes, ni autres organites ; ce sont des sacs remplis d'hémoglobine, une protéine particulière servant au transport de l'O2 et du CO2. L'énergie nécessaire à son métabolisme interne est assurée par la glycolyse anaérobique, contrairement aux autres cellules où cette génération est faite dans les mitochondries ; c'est un métabolisme qui génère de l'énergie à partir de sucre dans le cytoplasme de la cellule[1]. Les structures particulières de la membrane et du cytosquelette sous-jacent sont les causes principales de la souplesse des globules rouges ; ils peuvent ainsi emprunter facilement les plus petits vaisseaux sanguins, les capillaires[3].

Un globule rouge contient entre 250 à 300 millions de molécules d'hémoglobine, chacune pouvant transporter jusqu'à 4 molécules d'O2[2]. L'hémoglobine est une protéine constituée de 4 chaines de polypeptides et de 4 hèmes fixés dans chacune de ces chaines. Chacun de ces hèmes contient un ion ferreux auquel peut s'attacher l'O2 ou le CO2[1]. Un mécanisme particulier permet de relâcher le CO2 et ainsi d'attirer l'O2 et vice-versa[3]. Lorsque l’hémoglobine est chargée en O2, elle a une couleur rouge ; dans le cas contraire, elle a une couleur bleuâtre[1].
Production des globules rouges
N'ayant pas d'organites, en particulier de noyau, les globules rouges ne peuvent se reproduire ou se réparer ; ils meurent après environ 120 jours[2] en ayant parcouru près de 1 200 km dans les vaisseaux sanguins[1]. Ils sont continuellement remplacés par de nouveaux globules rouges à raison de 2 à 3 millions par seconde[1], représentant un remplacement de 0,8 % à 1,0 % par jour[4].
Les globules rouges sont produits dans la moelle osseuse par les cellules souches hématopoïétiques. Ces cellules souches ne produisent pas seulement les globules rouges, mais aussi toutes les autres cellules du sang, comme les globules blancs et les plaquettes. Toutes ces cellules murissent dans la moelle osseuse en passant par différents stades[1].
Pour les globules rouges les principaux stades sont les suivants[4]:
- Les cellules souches hématopoïétiques se divisent pour former des cellules appelées cellules myéloïdes progénitrices ; celles-ci peuvent se reproduire avant de se différencier en différents types de cellules dont des cellules proérythroblastes, première étape de la maturation des globules rouges. A ce stade la surface des cellules comporte des molécules d'adhésion intercellulaire (par exemple ICAM-1) ; ces molécules disparaitront progressivement afin que le globule rouge puisse sortir de la moelle osseuse pour entrer dans les vaisseaux sanguins.
- Aux phases suivantes du développement, les cellules deviennent des érythroblastes basophiles puis polychromatiques. Pendant ces périodes, la division cellulaire continue et une grande quantité de transferrine (jusqu'à 800 000 molécules) s'agglutine à la surface des cellules ; cette protéine contient du fer qui est nécessaire à la formation de l'hémoglobine.
- Quand les cellules atteignent le stade d'érythroblaste acidophile (ou orthochromatique), elles ne se divisent plus.
- Après l'expulsion de son noyau, le globule rouge contient encore de la réticuline, une protéine de structuration de la cellule, et à ce stade, la cellule se nomme réticulocyte. Elle reste encore 1 à 2 jours dans la moelle osseuse, se réduisant et se débarrassant de son réticule et de ses molécules d'adhésion, puis sort de la moelle osseuse par les vaisseaux sanguins. Avant de devenir des globules rouges, les réticulocytes vont encore maturer pendant 2 jours dans le sang et en particulier dans la rate[5].
Pendant tous les stades de leurs formations, les globules rouges s'agglutinent autour d'un macrophage et forment ainsi des îlots d'érythroblastes. Ces îlots sont proches des capillaires. Les cellules les plus proches du macrophage sont les moins matures. Le macrophage absorbe les cellules défectueuses et enlève aussi les noyaux des globules rouges avant qu'elles ne gagnent les vaisseaux sanguins[6].
Le cycle complet depuis le stade proérythroblaste jusqu'à un globule rouge mature dure environ 7 jours. Cette durée peut être réduite en cas de besoin accru. Une insuffisance d'O2 dans les reins stimule la production d'une hormone, l'érythropoïétine, qui va activer la production de globule rouges dans la moelle osseuse[4].
Pour produire les cellules rouges, il faut avoir à disposition, en plus des matériaux usuels à la production et maintenance des cellules comme le glucose, des lipides et des acides aminés, les éléments suivants[5]:
- Du fer : Il est stocké dans la moelle osseuse, le foie et la rate dans des protéine appelées ferritine et hémosidérine (la dernière est plus lente à restituer son fer). Quand érythropoïétine stimule la production de globules rouges, le fer est lié à la transferrine pour être transporté à la moelle osseuse par le sang.
- Du cuivre : Essentiel pour transformer le Fe 2+ en Fe 3+ qui peut s'attacher à la transferrine.
- Du zinc : Fonctionne comme une coenzyme pour la création des hèmes.
- De la vitamine B9 et B12 : ces vitamines sont nécessaires à la formation de nouvelles cellules et en particulier des globules rouges. Les vitamines B9 et B12 interviennent dans la synthèse des acides nucléiques : un déficit de l'une de ces vitamines bloque le cycle du S-adénosylméthionine qui permet la régénération du folate nécessaire à la synthèse des purines (auquel cas il s'accumule sous une forme non utilisable, le N5-methyltétrahydrofolate), rendant la duplication cellulaire des cellules souches précurseurs impossible (cellules bloquées en phase S)[7].
Destruction des globules rouges
Les globules rouges sont détruits par les macrophages de la rate et du foie[2] et L'hémoglobine est décomposée de la manière suivante[5]:
- Le fer utilisé dans des hèmes est conservé et stocké dans le foie, ou directement dans la moelle osseuse, pour être réutilisé pour la fabrication de nouvelles molécules d'hémoglobines.
- Le reste des hèmes est dégradé en biliverdine, une protéine verte, puis en bilirubine, une protéine jaune, qui est utilisée par le foie pour produire de la bile, une substance libérée dans les intestins pour aider à la digestion des matières grasses.
- La partie non-hème de l’hémoglobine, à savoir les chaines de polypeptides, est décomposée en acides aminés et réutilisée pour former d'autres cellules.
Régulation
La production de globules rouges est régulée par plusieurs médiateurs, dont le plus connu et le plus important est l'érythropoïétine, une hormone produite par les cellules interstitielles (interstice juxtatubulaire) et les cellules endothéliales des capillaires péritubulaires du cortex rénal en cas d'apport insuffisant en O2. D'autres messagers peuvent influencer la production : hormones thyroïdiennes, hormones de croissance, hormones surrénaliennes et sexuelles (testostérone essentiellement), et médiateurs inflammatoires[7].
Développement de l’embryon à l'adulte

Vers les semaines 3 à 4 du développement de l'embryon humain, des cellules spéciales, similaires aux érythroblastes, se développent dans la vésicule vitelline. Elles jouent un rôle crucial dans la circulation de l'oxygène et du dioxyde de carbone, mais aussi dans le développement des vaisseaux sanguins[8]. La structure de l'hémoglobine dans ces cellules spéciales est différente de l'hémoglobine à l'âge adulte ; les hèmes sont les mêmes, mais les chaines de polypeptides sont différentes. On leur donne le nom de ζ et ε – tandis que l'hémoglobine adulte utilise des chaines α et β[9].
Vers la semaine 4 du développement du fœtus, des cellules souches hématopoïétiques, les cellules génératrices des cellules du sang, dont les globules rouges, se trouvent dans la vésicule vitelline, puis aussi dans le foie de l'embryon vers les semaines 5 à 6. D'autres parties, comme les vaisseaux sanguins principaux et le placenta, renferment aussi quelques cellules souches hématopoïétiques, mais ne sont pas des lieux de développement des cellules sanguines[8]. L'hémoglobine est maintenant principalement composée de chaines α et γ[9].
Vers les milieux de la grossesse, les cellules souches hématopoïétiques commencent à migrer vers la moelle osseuse. Au moment de la naissance, le foie ne fabrique plus de cellules sanguines[8] ; l'hémoglobine avec des chaines α et β représente seulement une proportion de 5 % à 20 % de toute l'hémoglobine. Après une année, l'hémoglobine à chaines α et β représente 95 % à 97 %[9].
L'adulte conserve la possibilité de faire de l'hémoglobine avec des chaines α et γ, et aussi avec des chaines α et δ, une autre variante des chaines de polypeptides[9].
Animaux
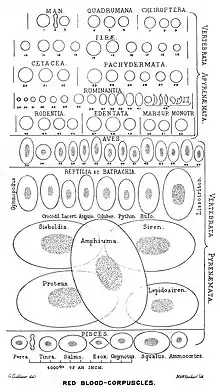
Tous les vertébrés ont des globules rouges. Une exception particulière est le poisson des glaces channichthyidae chez lequel l'oxygène est dissous dans son sang[10].
Chez les mammifères, le cycle de vie des globules rouges est le même que chez les humains. Les globules rouges sont aussi les mêmes ; ils ont la forme de disques creusés en leur centre, n'ont pas de noyau et utilisent l'hémoglobine pour transporter l'oxygène et le dioxyde de carbone. La durée de vie des globules rouges est de 100 à 110 jours chez les mammifères domestiques[10].
Chez les oiseaux, la production des globules rouges, qui garde un noyau non-actif, se fait, comme chez les mammifères, dans la moelle osseuse. Leurs durées de vie sont de 28 jours chez un perroquet et de 30 jours chez un poulet[10].
Chez les vertébrés non-mammaliens, les globules rouges sont plus grands et ont conservé leurs noyaux, et, comme chez les mammifères, utilisent l'hémoglobine pour fixer l'oxygène et le dioxyde de carbone. Les amphiumas, un genre d'amphibien, ont des globules rouges particulièrement grand, 70 μm x 40 μm[11], environ 10 fois plus grand qu'un globule rouge humain.
Beaucoup invertébrés (arthropodes, araignées, mollusques) utilisent l'hémocyanine, une protéine basée sur 2 atomes de cuivre au lieu des 4 de fer pour leur hémoglobine. Cette molécule est la plupart du temps directement dissoute dans le sang ou l'hémolymphe ; les globules rouges semblent être une exception chez les invertébrés[12].
Chez les arthropodes, l'air est directement amené vers les organes par un système de trachées ; de ce fait, aucun moyen de transport de l'oxygène n'est nécessaire[10].
Maladies
Quand la quantité d'hémoglobine dans le sang est trop basse, on parle d'anémie ; ce n'est pas une description d'une maladie, mais juste une mesure d'un problème. L'anémie peut avoir une grande variété de causes. La cause principale est une carence nutritionnelle, en particulier un manque de fer, qui peut provenir d'une carence dans la nourriture, d'un problème d’absorption du fer ou d'une perte de sang continuelle. On parle anémie ferriprive. Comme l'hémoglobine contient dur fer dans sa structure, un manque de fer va réduire le nombre de globules rouges produits[9].
Un autre élément nécessaire pour la création de nouvelles cellules, et donc le globules rouges (dont 2 à 3 millions sont produits par seconde), est la vitamines B12, une vitamine se trouvant exclusivement dans des aliments d'origine animale. La vitamine B9 est aussi une vitamine essentielle à la création de nouvelles cellules et donc de globules rouges[9].
D'autres maladies liées à la production des globules rouges sont dues à des problèmes de création de l'hémoglobine. L'hémoglobinopathie regroupe toutes les maladies de l'hémoglobine d'origine génétique ; les deux principales concernent la production des chaines de polypeptides : la thalassémie et la drépanocytose. Les maladies liées à la production des hèmes sont regroupées sous le nom de porphyrie[9].
Notes et références
- Lauralee Sherwood (trad. Alain Lockhart), Physiologie humaine, 2ème édition, Bruxelles, Belgique, De Boeck & Lacier s.a., , 728 p. (ISBN 978-2-8073-0286-0, lire en ligne), p. 315-318
- Adolf Faller, Pierre Sprumont, Michael Schünke, Le corps humain, Bruxelles, Belgique, Éditions De Boeck Université, , 596 p. (ISBN 978-2-8041-5037-2), p. 201-202
- (en) Robert S. Hillman, Kenneth A. Ault, Hematology in Clinical Practice, Third Edition, McGraw-Hill, , 429 p. (ISBN 0-07-137502-3, lire en ligne), p. 1-11
- (en) Molineux G., Foote M.A., Elliott S.G., Erythropoietins and erythropoiesis : molecular, cellular, preclinical, and clinical biology, Boston, Birkhäuser Verlag, , 269 p. (ISBN 978-3-7643-7542-3, lire en ligne
 ), p. 3-6
), p. 3-6 - (en) Lindsay M. Biga, Sierra Dawson, Amy Harwell, Robin Hopkins, Joel Kaufmann, Mike LeMaster, Philip Matern, Katie Morrison-Graham, Devon Quick, Jon Runyeon, Anatomy & Physiology, Oregon, USA, Open Oregon State University, (lire en ligne), Chapter 8.13
- Bone marrow pathology, p. 36-37.
- David L. Nelson et Albert L. Lehninger, Lehninger principles of biochemistry, W.H. Freeman and Company, (ISBN 978-1-4292-3414-6, 1-4292-3414-8 et 978-1-4641-0962-1, OCLC 824794893, lire en ligne)
- (en) Margaret H. Baron, « Early Embryonic Erythropoiesis … Not so Primitive After All », Stem Cells, (DOI 10.1002/stem.1342)
- (en) Loren Hazelwood, Can't Live Without It: The Story of Hemoglobin in Sickness and in Health, Hungtington, New York, Nova Science Pub Inc., , 168 p. (ISBN 978-1560729075, lire en ligne), p. 81-92
- Lauralee Sherwood, Hillar Klandorf et Paul H. Yancey (trad. Jean-Claude Cornec), Physiologie animale, Louvain-la-neuve, Belgique, De Boeck Supérieur s.a., , 816 p. (ISBN 978-2-8073-0286-0), p. 391-393
- (en) Hüseyin Arikan, Kerim Çiçek, « Haematology of amphibians and reptiles: a review », North-Western Journal of Zoology, vol. 10 (1), , p. 190-209, article no 143501 (lire en ligne)
- (en) Volker Hartenstein, « Blood Cells and Blood Cell Development in the Animal Kingdom », Annual Review of Cell and Developmental Biology, vol. 22, , p. 677–712 (lire en ligne)
Voir aussi
- Portail de la médecine
- Portail de l’hématologie