Anémie ferriprive
Une anémie ferriprive ou anémie par carence martiale (en anglais, iron deficiency anemia ou IDA) est une anémie due à une carence des réserves en fer de l'organisme. Il s'agit d'une situation fréquente en médecine.
Pour les articles homonymes, voir IDA.
| Médicament | Fer, gluconate ferreux dihydraté (d), fumarate ferreux (en), sulfate de fer heptahydraté (d), complexe de gluconate ferrique de sodium (en), complexe d'hydroxyde ferrique - saccharose (d), carboxymaltose ferrique et Ferumoxides (d) |
|---|---|
| Spécialité | Hématologie |
| CISP-2 | B80 |
|---|---|
| CIM-10 | D50 |
| CIM-9 | 280 |
| DiseasesDB | 6947 |
| MedlinePlus | 000584 |
| eMedicine | 202333 |
| MeSH | D01 |
![]() Mise en garde médicale
Mise en garde médicale
Épidémiologie
La carence en fer est la première cause d'anémie[1]. Il peut exister également une carence en fer sans anémie et sa prévalence est double de celle de l'anémie ferriprive[2].
20 % des femmes en âge de procréer auraient une anémie ferriprive[3].
30 à 50 % des anémies sont de type ferriprive[4].
Dans le monde, il y a environ 1 milliard de cas d’anémie ferriprive[5].
Mécanismes
Les besoins en fer du sujet normal sont de l'ordre de 9 mg par jour chez l'homme et de 7 à 30 mg par jour chez la femme et l'enfant. La presque totalité de cette quantité est consommée par l'érythropoièse. Les érythroblastes obtiennent essentiellement leur fer de la transferrine, protéine transporteuse qui est présente dans le plasma à la concentration normale de 2 500 mg·L-1 et qui, habituellement, n'est saturée de fer qu'au tiers environ. Le taux de fer sérique est normalement de l'ordre de 1 200 μg·L-1 chez l'homme (à cause de son imprégnation androgénique) et de 1 000 μg·L-1 chez la femme, l'enfant et l'eunuque. Les érythroblastes possèdent un mécanisme actif d'extraction du fer de la transferrine qui leur permet de couvrir leurs besoins même si le taux de saturation de cette protéine descend à 5 - 10 %, c'est-à-dire jusqu'à un taux critique de fer sérique de l'ordre de 20 à 300 μg·L-1.
Lorsque les besoins de fer cessent d'être couverts par l'alimentation, l'organisme fait appel à ses « réserves » qui sont constituées par la ferritine et l'hémosidérine du foie (hépatocytes et cellules de Kuppfer) et des cellules réticulaires de la rate et de la moelle osseuse. Cette mobilisation est effectuée par un échange de fer entre la ferritine des cellules et la transferrine du plasma, cette dernière étant devenue fortement désaturée par l'activité des érythroblastes. L'anémie ferriprive ne se produit que lorsque les réserves sont vidées et que le taux de saturation de la transferrine s'abaisse en dessous du taux critique cité plus haut.
Les réserves en fer de l'organisme et les pertes quotidiennes sont respectivement de 1 200 mg et de 1 mg chez l'homme, de 600 mg et 1,5 mg chez la femme. En pays industrialisés, les besoins sont normalement couverts par l'alimentation. La ferritine donne une estimation des réserves de fer de l'organisme. Son interprétation doit d'abord éliminer un état inflammatoire chronique, une affection maligne, une cytolyse ou une hyperthyroïdie, situations où la ferritine s'élève indépendamment de l'état des réserves.
Lorsque vient à manquer le fer, la synthèse de l'hème, et donc celle de l'hémoglobine (Hb), deviennent insuffisantes mais la production de globules rouges (G.R.) est relativement peu affectée. L'anémie ferriprive sera par conséquent :
- hypochrome, les hématies paraissent pâles et l'indice de coloration (I.C.) est inférieur à l'unité,
- microcytaire, car la concentration sanguine en hémoglobine entre pour un tiers dans le volume du globule rouge normal
- et surtout, la concentration en hémoglobine globulaire sera abaissée.
Les carences martiales entraînent une augmentation de l'absorption du fer qui, de 10 % peut passer à 30 %. Cette absorption nécessite un pH gastrique acide pour maintenir le fer sous forme de fer ferreux. L'anémie témoigne d'un déficit profond des réserves de l'organisme au point que la synthèse de l'hème s'en trouve ralentie. Chaque érythroblaste subit un nombre excessif de mitoses, d'où une diminution du volume globulaire.
L'hepcidine joue également un rôle important dans le métabolisme du fer. Elle se fixe sur la ferroportine, entraînant son internalisation intracellulaire[6]. Le taux sanguin de l'hepcidine est corrélé avec celui de la transferrine[7]. En cas de carence martiale, le taux d'hepcidine chute, permettant une meilleure absorption digestive et le relargage du fer par les réserves de l'organisme[2].
Chez la femme, les besoins exigés pour une grossesse sont de 650 mg. Au cours du dernier trimestre de grossesse, on assiste à l'apparition d'une anémie de dilution.
Chez le nourrisson, les besoins quotidiens sont de 1 mg·kg-1. De plus, il existe chez lui une microcytose avec hypochromie physiologique avec une concentration en hémoglobine avoisinant les 11 g·L-1.
Causes
Les différentes variétés cliniques de l'anémie ferriprive relèvent d'une combinaison en proportions variables des deux causes fondamentales : l'insuffisance d'apport de fer et les accroissements des besoins en fer. Ces causes sont acquises.
Chez la femme en âge de procréer, les principales causes d'anémie ferriprive sont la menstruation et la perte de fer associée à la grossesse[8].
La déficience en fer cause une neurotransmission dopaminergique anormale et peut contribuer aux troubles du comportement[9].
Il existe d'exceptionnelles causes génétiques créant une anémie et rendant le traitement de fer par voie orale inefficace : par mutation du gène TMPRSS6[10],[11]; par dérégulation de l'hepcidine [10],[12]. Une mutation du TMPRSS6 causant l'"anémie par carence en fer réfractaire au traitement de fer" (Iron-refractory iron deficiency anemia, IRIDA)[13],[14].
Insuffisance d'apport de fer
Une insuffisance d'apport de fer peut être due à :
- un apport alimentaire insuffisant (ce qui peut être le cas d'un régime végétarien trop strict[2]) ;
- une mauvaise utilisation alimentaire ;
- soit par manque d'acidité gastrique (qui normalement rend le fer plus résorbable en l'amenant à l'état ionisé) ; ce facteur joue chez les gastrectomisés et dans les gastrites avec anacidité ;
- soit par malabsorption intestinale : dans les stéatorrhées chroniques de toute nature, et chez les sujets porteurs de résections intestinales ou d'une chirurgie bariatrique, dans la maladie cœliaque[15], dans les colites ulcéreuses[15].
Accroissement des besoins en fer
Un accroissement des besoins en fer peut survenir :
- physiologiquement, entre 4 mois et 2 ans, âge où l'enfant investit 6 à 8 mg de fer par jour dans son érythropoièse ;
- physiologiquement encore, chez la femme enceinte et pendant l'allaitement : chaque grossesse coûte environ 750 à 1 000 mg de fer, soit un cinquième des réserves normales ;
- surtout, dans les états hémorragiques chroniques parce que les réserves de fer sont généralement épuisées dans ces cas. Au contraire, une hémorragie aiguë isolée, à moins d'avoir été très abondante, ne laisse derrière elle qu'un bref épisode où le sang présente le tableau de l'anémie ferriprive.
- La vie reproductive de la femme moderne est différente de celle de ses ancêtres [16], l'augmentation des périodes de menstruation chez la femme dans la société moderne encline la femme à devenir carencée en fer[16]. Dans l’histoire de l’humanité, le fait qu'une femme a des menstruations chaque mois est très récent[17],[18]. Les femmes préhistoriques alternaient grossesse et allaitement presque de manière continue, donc sans avoir de menstruation[17], étant enceinte à nouveau avant d'avoir fini l'allaitement du précédent enfant[17]. Les ancêtres de l'homme avaient uniquement une dizaine de menstruations dans leur vie[19].
- la réduction des naissances[20] de manière artificielle entraînant des menstruations régulières peut être une cause d'anémie[21]. Dans les sociétés traditionnelles, et dans l'histoire de l'humanité, les femmes faisaient beaucoup d'enfants[22].
- Le raccourcissement de la période l'allaitement entraine une augmentation de la fréquence des menstruations[20]. Dans les sociétés traditionnelles, par exemple les inuits, les enfants étaient allaités 3 ans en moyenne[23], pour les femmes préhistoriques c'était 5 ans[24]. Or allaiter entraine une aménorrhée de lactation, soit une absence de menstruation et des besoins en fer de 9 mg par jour, soit 2 fois moins qu'une femme avec menstruation. Une étude indique qu'obtenir 18 mg de fer par jour peut rarement être atteint avec les aliments ordinaires disponibles[25]. 18 mg de fer est l'équivalent de 750 g de steak par jour (2,4 mg de fer dans 100 g de steak).
- de multiple dons de sang[15]
Variétés cliniques
Dans le cadre des anémies ferriprives, il est possible d'individualiser quelques syndromes particuliers.
Anémie post-hémorragique chronique
Parmi les causes les plus fréquentes de l'anémie ferriprive, il faut citer les hémorragies chroniques : Elles sont le plus souvent :
- d'origine digestive (Ulcère gastrique, cancer gastrique, hernie hiatale par roulement, hémorroïdes et ankylostomiase...).
- d'origine gynécologique (Ménorragies et métrorragies, une menstruation normale représente en moyenne une perte de 50 mg de fer)
Il existe d'autres causes d'hémorragies chroniques, plus rares.
Chlorose (ou anémie hypochrome de la puberté féminine)
Propre au sexe féminin et survenant chez les adolescentes de 14 à 20 ans, la chlorose était très fréquente au début du XXe siècle mais a aujourd'hui pratiquement disparu. Même sans traitement, le pronostic est bénin. Trois facteurs interviennent dans sa pathogénie :
- l'établissement des premières règles qui sont quelquefois trop abondantes ;
- la poussée de croissance de la puberté qui va de pair avec un développement parallèle de la masse sanguine et crée à ce moment critique un accroissement momentané des besoins en fer.
- un régime très pauvre en fer dû aux habitudes alimentaires. C'est certainement cet élément diététique qui est le plus important dans la cause de la rareté actuelle de ce syndrome.
Anémie dite « hypochrome essentielle » ou la chlorose tardive ou encore la choranémie achylique de Kaznelson
Plus fréquente que la chlorose, elle est, comme elle, pratiquement liée au sexe féminin (9 cas sur 10); cette anémie frappe surtout les femmes entre 30 et 50 ans, ainsi que les personnes ayant une alimentation pauvre en fer.
Sa pathogénie comprend une combinaison en proportions variables des facteurs suivants :
- des grossesses et allaitements répétés ;
- fréquemment l'une ou l'autre affection gynécologique (myome, endométrite, hyperplasie glandulo-kystique) responsable de ménométrorragies chroniques ;
- un régime quelquefois déficient en aliments riches en fer ;
- l'achlorhydrie (ou du moins l'hyposécrétion) gastrique. Ce dernier facteur se retrouve avec une fréquence particulière. On a d'ailleurs noté le caractère souvent familial de l'affection ainsi que la fréquence avec laquelle, dans les familles atteintes, s'observent des cas d'anémie pernicieuse de Biermer.
Anémie hypochrome de la grossesse
Fréquente, même dans les classes aisées, elle s'observe plus souvent chez les plurigravides que lors d'une première grossesse. Sa fréquence, qui, dans nos régions, dépasse de loin celle de l'anémie hyperchrome de la grossesse, justifie la libéralité avec laquelle on peut administrer le fer aux femmes enceintes pendant la seconde moitié de la grossesse.
En fin de grossesse, on observe une dilution du sang sous action humorale, si bien que l'hémoglobine peut atteindre 120 g·L-1 mais on ne peut la laisser descendre en dessous. De toute façon, la découverte d'une hypochromie pose l'indication formelle pour la thérapeutique martiale.
Anémie hypochrome du nourrisson
Le colostrum et le lait maternel sont assez pauvres en fer. De plus lors de l'accouchement, le clampage précoce du cordon ombilical prive le nouveau-né d'une quantité significative de fer et d'hémoglobine qu'il aurait sinon reçu du placenta dans les trois minutes suivant l'accouchement[26]. Enfin, comme la masse sanguine du bébé se développe rapidement la première année de la vie, les réserves du foie, constituées durant la vie fœtale, s'épuisent rapidement après la naissance. Dès que l'alimentation comprend des jus de viande et autres sources de fer, en particulier après la 2de année, le danger d'anémie ferriprive est écarté, mais elle est assez souvent observée entre 4 - 6 mois et 2 ans, y compris (avec ou sans anémie) dans les pays dits « développés »[27],[28],[29].
Cette carence est fréquente, et peut être grave chez l'enfant prématuré ou chez le jumeau car ils naissent avec des réserves en fer insuffisantes. L'enfant trop longtemps soumis à un régime lacté intégral peut aussi être concerné. Même le nourrisson normal présente une chute du taux de fer sérique après l'âge de 6 mois : ce pourquoi les pédiatres recommandent de donner du jus de viande et des légumes dès cet âge.
Chez le nourrisson, une carence en fer a été associée à des problèmes de retard mental[29] et à des altérations du développement psychomoteur[27],[28],[30],[31],[32],[33],[34],[35],[36],[37],[38],[39],[40],[41] qui persistent malgré un traitement de fer à long terme[31],[42],[35],[36],[37],[38],[40],[41] même jusqu'à 19 ans[41].
Une revue d'études faites en 2004 a conclu qu'un clampage plus tardif du cordon ombilical pourrait réduire l'anémie ferriprive des nourrissons nés à terme, même dans les pays industrialisés, et ainsi d'éviter pour ces enfants les conséquences listées ci-dessus, pour toutes ou parties irréversibles à long terme[43].
Chez le nourrisson, le taux de ferritine et la mesure du volume de globules rouges en circulation mesurent mieux les effets hématologiques de la carence en fer que l'hématocrite du sang[44],[45]. Le délai entre la naissance et le clampage du cordon ombilical affecte aussi ces indicateurs car le nouveau-né peut encore recevoir du sang du placenta[44], notamment si le clampage est "retardé", c'est-à-dire que la section du cordon est pratiquée non pas dans la minute, mais après deux à trois minutes après la naissance ou quand les pulsations du cordon ont cessé, avec en revanche une augmentation du risque d'ictère nécessitant une photothérapie[26] ; avec un transfert de sang atteignant 80 mL une minute après la naissance et près de 100 mL 3 min après la naissance[46],[47].
L'anémie est plus fréquente chez les patients avec un trouble psychiatrique chronique[48].
Anémie ferriprive des affections gastro-intestinales
Elle peut s'observer dans les affections qui suppriment l'acidité gastrique (gastrectomie, achylies de toute nature) ou interfèrent avec la résorption intestinale (stéatorrhées, fistules gastro-coliques, résections étendues, etc.). Plus souvent cependant ces affections s'accompagnent d'une anémie macrocytaire due, généralement, à une déficience en acide folique. La découverte d'une anémie microcytaire hypochrome chez des sujets entrant dans cette catégorie devra inciter à rechercher une cause d'hémorragies chroniques (ulcère d'une bouche d'anastomose, cancer, etc.).
Anémie de l'ankylostomiase (ankylostome duodénal)
L'ankylostomiase se manifeste dans une atmosphère chaude et humide, donc dans les pays tropicaux mais aussi dans les mines de charbon. Elle n'entraine de l'anémie que si le régime alimentaire du sujet est pauvre en fer. S'il y a très peu d'ankylostomes, on observe une stimulation de l'érythropoïèse mais si, par contre, il y a beaucoup de parasites, on observe une anémie très grave (les ankylostomes mangent littéralement les villosités du duodénum.
Symptômes cliniques
On peut diviser la symptomatologie
- l'anémie proprement dite,
- l'asidérose due à la carence en fer
- les troubles psychiatriques
- les autres signes
Anémie
Comme elle s'installe de manière insidieuse, l'anémie ferriprive est habituellement bien tolérée. Ses symptômes sont ceux de l'anémie pure. Le syndrome anémique associe à des degrés variables : pâleur, asthénie, dyspnée, céphalées, vertiges, acouphènes et lipothymie, peau pale,pied et mains froids, ongles cassants, manque d'appétit[3],[49]; faiblesse musculaire, épuisement rapide, anorexie, difficulté à se concentrer, maux de tête, palpitations, angine de poitrine[50];hypotension (tension basse[51]), perlèche[52], glossite[52], koilonychie[52], lipothymie[52], des troubles du cycle menstruel chez la femme (durée du cycle irrégulier ou d'une durée anormale, dysménorrhée, syndrome prémenstruel)[53],diminution de l'acidité gastrique[54], atrophie villositaire[54], pica(géophagie, pagophagie)[54],[50].
Les symptômes sont insidueux et peuvent arriver lentement sur plusieurs mois ou années[50].
Le teint est habituellement blanchâtre, exempt de nuance ictérique. La rate n'est en général pas palpable. On peut cependant sentir une pointe de rate dans 33 % des anémies hypochromes essentielles.
Une anisocytose, différence de taille entre plusieurs cellules sanguines d’une même lignée cellulaire, est souvent présente an cas de carence en fer avec ou sans anémie. L'anisocytose est détéctée par l'indice de distribution des globules rouges ou IDR supérieur à 15, de l'hémogramme (prise de sang).
Asidérose
La carence en fer étend ses effets à toutes les cellules de l'organisme qui ont besoin de ce métal pour la synthèse d'un grand nombre d'enzymes, et notamment des cytochromes. Cette carence se manifeste par le syndrome d'asidérose, lequel frappe particulièrement les épithéliums qui, du fait de leur régénération continuelle, sont de grands consommateurs de fer. Les symptômes principaux sont d'ordre digestif et tégumentaire.
Signes digestifs
L'anémie ferriprive peut causer des altérations de la muqueuse buccale : une candidose orale (se traduisant par une langue avec un revêtement blanc)[55],[56],[57], une perlèche ou chéilite angulaire (lésion de la commissure des lèvre)[57].
La glossite est fréquente, se manifestant par une sécheresse de la bouche, des sensations de brûlures[58]. La langue peut devenir lisse et luisante et peut présenter de petites ulcérations douloureuses. Dans l'ensemble la glossite sidéropénique est moins grave cependant que celle qui accompagne l'anémie pernicieuse ou anémie de Biermer.
L'œsophagite est fréquente aussi et donne lieu au syndrome de Plummer-Vinson, encore appelé « dysphagie sidéropénique de Waldenström ». Il s'agit d'une sensation de brûlure rétrosternale et d'une sensation d'arrêt des aliments dans le haut de l'œsophage, deux symptômes qui se manifestent immédiatement après chaque déglutition. À la radiographie on peut noter un petit défaut de remplissage de l'œsophage entre l'empreinte du cartilage cricoïde et l'empreinte de l'aorte. Ces signes cliniques et radiologiques disparaissent rapidement lors de la thérapeutique martiale, faisant ainsi la preuve de la cause.
Au niveau stomacal, on observe une hyposthénie gastrique c'est-à-dire une diminution du processus fermentatif de l'estomac se traduisant par des fermentations « anormales » plus fréquentes et plus intenses, une dilatation atonique de l'estomac et aussi une sécrétion chlorhydrique moindre : l'examen du suc gastrique après repas d'Ewald révèle de l'achlorhydrie dans 85 % des cas, et celle-ci est histamino-réfractaire dans la moitié des cas.
L'endoscopie haute trouve une gastrite superficielle ou atrophique dans 80 % des cas.
La constipation est fréquente.
Signes tégumentaires
La peau est sèche. Elle présente parfois de petits troubles de la pigmentation (par exemple du vitiligo, ou encore, pour les peaux noires, une teinte grisâtre due à une dépigmentation diffuse). Il existe souvent des crevasses au dos de la main et au niveau des commissures labiales. Un prurit rebelle a été également signalé mais paraît rare. Les cheveux et les poils se raréfient et grisonnent prématurément. Les ongles cassent facilement et présentent un aspect caractéristique : ils deviennent concaves, mats et striés dans le sens de la longueur. On peut également observer une coloration bleutée des sclérotiques.
Troubles psychiatriques
La déficience en fer cause une neurotransmission dopaminergique anormale et peut contribuer aux troubles du comportement[9].
Un faible taux de ferritine chez l'enfant et l'adolescent est associé à des troubles psychiatriques[59],[9] : la schizophrénie à l'âge adulte[37], des troubles émotionnels et psychosociaux[39] ; autisme[59], trouble du déficit de l'attention[59], trouble de l'humeur[59], trouble du développement[59].
Les patients souffrant des troubles psychiatriques suivants : trouble bipolaire[48], trouble dépressif[48], trouble obsessionnel compulsif[9], trouble de conversion[48], trouble d'anxiété généralisé[48], schizophrénie[9] sont plus à risque de souffrir d'anémie.
Les troubles de l'humeur, habituellement imputés aux changements hormonaux pendant les règles, pourraient être causés par des niveaux de fer réduits[3].
L'anémie entraine un risque plus élevé de dépression postpartum[60].
Les symptômes dépressifs dans l'anorexie et les troubles alimentaires pourraient être liés à la déficience en fer[61].
Chez les anémiques avec dépression, il existe une plus grande fréquence de troubles gastro-intestinaux tels que reflux, ballonnements, halitose, dyspepsie, constipation[62].
Signe osseux
La carence en fer avec et sans anémie serait un facteur de risque d'ostéopénie et ostéoporose[63],[64],[65],[66].
Autres
Un faible taux de ferritine chez l'enfant a été associé à:
- une altération de la mémoire de reconnaissance auditive[67] ;
- une moindre réussite aux tests mentaux et psychomoteurs à 5 ans[68] ;
- des troubles de l'attention visuelle et de l'acquisition des concepts[69] ;
- un risque plus élevé d'asthme[70] ;
- des troubles du sommeil (à long terme)[71],[35] ;
- des problèmes de maturation neuronale[72] ;
- un clignotement plus lent des yeux[73],
- des problèmes moteurs dans les extrémités supérieures des membres[42],
- une altération à long terme de la réponse à la prolactine[74] ;
- des troubles auditifs et de la réponse visuelle[75]
On a signalé chez les sujets carencés en fer de nombreux dérangements endocriniens, particulièrement une insuffisance génitale (aménorrhée chez la femme, impuissance chez l'homme). Il peut favoriser l'apparition d'un syndrome des jambes sans repos[76].
Biologie
Mesures courantes
Un hémogramme est le plus souvent réalisé.
Le nombre de globules rouges est « en principe » diminué, puisqu'il s'agit d'une anémie, mais dans les cas légers, il peut rester dans les limites de la norme. Il est rare qu'il descende en dessous de 3 millions /mm³. Le taux sanguin d'hémoglobine s'abaisse davantage, l'anémie ferriprive étant hypochrome. L'indice de coloration (IC) est donc inférieur à 1 et le taux d'hémoglobine globulaire est généralement compris entre 15 et 20 pg (picogramme) (N = 29 ± 2 pg). L'hématocrite est également plus affecté que le nombre d'hématies et se situe entre 20 et 35 %, du fait du caractère microcytaire de l'anémie. Le volume globulaire moyen est souvent de l'ordre de 55 à 75 microns3 (N = 87 +- 5 %), du fait de la minceur et de la diminution du diamètre des globules. La concentration moyenne d'hémoglobine globulaire est abaissée, se situant souvent entre 25 et 30 % (N = 34 +- 2 %).
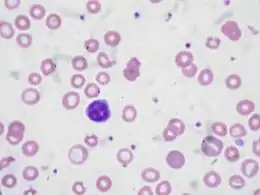
Examen du frottis sanguin
On notera surtout la pâleur de coloration des hématies, pauvre en hémoglobine susceptible de fixer l'éosine du colorant. Certains globules sont presque dépourvus d'hémoglobine et présentent une teinte polychromatophile. Beaucoup d'hématies ont un aspect « en anneau » du fait que leur hémoglobine n'occupe que la périphérie du disque globulaire, laissant tout l'espace central décoloré. On observe une microcytose mais du fait de l'anisocytose, on peut rencontrer une minorité d'éléments de diamètre normal ou même augmenté, portant une charge en Hb normale. La poïkilocytose est courante.
Taux de réticulocytes
Le taux de réticulocytes d'une anémie ferriprive non traitée est souvent normal, quelquefois abaissé ; il s'élève après une hémorragie et se maintient à des valeurs modérément élevées en cas de persistance du saignement.
Résistance osmotique
La résistance osmotique des hématies est souvent normale ou légèrement accrue.
Globules blancs et plaquettes
Il existe souvent une légère leucopénie avec lymphocytose relative, sauf après une hémorragie où il se produit une réaction leucocytaire neutrophile. Le nombre des thrombocytes est en général normal ou élevé, avec une thrombocytose réactionnelle.
Examen de la moelle osseuse
La ponction médullaire ramène en général une moelle richement cellulaire, dans laquelle le rapport granulo-érythropoiétique est abaissé par suite d'une forte hyperplasie de la lignée rouge. On s'aperçoit ainsi que la pauvreté du sang en hématies repose sur un blocage de la maturation.
Données métaboliques
Le taux du fer sérique est extrêmement abaissé, tombant souvent en dessous de 25 µg/100 ml. La concentration de la transferrine est au contraire augmentée, jusqu'au quadruple, de sorte que son taux de saturation devient minime. Le taux de ferritine est diminué. La protoporphyrine globulaire est augmentée. La bilirubinémie est basse, à cause de la réduction de la masse d'hémoglobine à cataboliser. Le plasma peut devenir quasi incolore. Les urines ont une teinte normale.
Un cas plus délicat est l'association d'une vraie carence martiale avec une maladie inflammatoire, cette dernière élevant le taux de ferritine sanguin.
Diagnostic
L'anémie ferriprive est la principale cause d'anémie, mais non la seule anémie hypochrome microcytaire. Elle partage ces caractères avec les thalassémies, les anémies sidéro-achrestiques et quelques syndromes très rares. Elle se distingue de ces affections par deux caractères faciles à vérifier : le taux sanguin très bas du fer sérique et la réponse favorable au traitement martial. (On peut noter une crise réticulocytaire dès les premiers jours de traitement). Le diagnostic d'anémie ferriprive est fréquemment suggéré par le contexte clinique (hémorragies).
L'anémie inflammatoire est aussi hyposidérémique arégénérative et parfois microcytaire mais un taux de transferrine abaissé ou même normal élimine une carence martiale.
Le dosage de l'hepcine est attendue dans le futur dans le but de différencier une carence en fer vraie d’une carence en fer par séquestration[13].
Traitement
Fer
Le seul traitement valable, qui est remarquablement efficace, consiste en l'administration de fer (« thérapeutique martiale »). On le donnera par la bouche sous une forme chélatée à une petite molécule organique qui assurera son passage aisé à travers les cellules épithéliales de l'intestin grêle (fumarate, ascorbate, gluconate, citrate ammoniacal de fer, complexe fer hydroxyde-polymaltose ). Les sels ionisés sont plus irritants pour le tube digestif et ne sont pas mieux résorbés que les chélates.
Pour améliorer la tolérance digestive, on commence par une dose faible que l'on augmentera graduellement. Les comprimés seront ingérés au moment des repas : la résorption est moins bonne mais la tolérance est meilleure.
L'excès de fer peut passer dans les selles et les colorer en noir (sulfure de fer).
L'ingestion de sels de fer par de petits enfants peut avoir des suites mortelles (dose létale = 900 mg de fer-métal par kg). L'antidote est la desferrioxamine.
La réponse à la thérapeutique se manifeste dès les premiers jours par l'apparition de réticulocytes. La montée du taux d'Hb est plus lente : on gagne en général 0,17 g/100 ml d'Hb par jour, soit environ 1 g/100 ml par semaine. Le succès thérapeutique est assuré mais peut exiger plusieurs mois.
Indications de la voie parentérale = limitées aux quatre cas suivants :
- Fer per os = insuffisamment résorbé ;
- Intolérance digestive telle que l'état de nutrition du malade en est compromis
- Patient incapable d'assurer lui-même la régularité de son traitement : déficients intellectuels, etc.
- Cas d'urgence (par exemple anémie ferriprive constatée à la fin de la grossesse)
L'administration du fer par voie parentérale se fait uniquement par injections intramusculaires en effet, par voie sous-cutanée, il y a décomposition sur place d'une bonne partie du chélate, et par voie intra-veineuse, le fer est très toxique comme les autres métaux lourds (ceci est valable même pour les chélates). Un des médicaments utilisés est le carboxymaltose ferrique.
Il existe une forme d'anémie rare (Iron-refractory iron deficiency anemia) dans laquelle le traitement de fer par voie oral n'a aucun impact, seule l'administration intraveineuse permet de corriger partiellement l'anémie[14],[77].
Traitement accessoire
Les transfusions sont généralement superflues à moins qu'il n'y ait urgence ou en cas d'hémorragies persistantes.
Si un traitement oral n’apporte pas le succès escompté ou n’est pas toléré par le patient, un traitement intraveineux est justifié[78].
On ne donnera au début ni vit. B12, ni acide folique, ni aucun autre facteur érythropoiétique, généralement inutiles et susceptibles de brouiller l'interprétation de la réponse au traitement martial. L'exception est le syndrome de malabsorption intestinale, où la déficience porte davantage sur l'acide folique que sur le fer.
Dans le cas de menstruations abondante, avec anémie ou carence en fer sans anémie, l'hysterectomie ou la pose d'un stérilet hormonal au levonorgestrel entraine un taux de ferritine normal au bout de 5 ans[79].
Surveillance du traitement martial
Une crise réticulocytaire est observée à partir du 5e jour.
La seule correction de l'anémie ne suffit pas : il doit aussi avoir normalisation de la transferrine et de la ferritine.
La persistance de l'anémie avec correction du syndrome biochimique doit faire rechercher une autre pathologie, par ex. une thalassémie mineure (électrophorèse de l'hémoglobine).
La persistance de l'anémie et du syndrome biochimique suggère un problème d'adhésion au traitement ou une malabsorption. L'injection IM, deux fois par semaine, de chélate de fer permet d'obtenir la guérison.
Articles connexes
Notes et références
- Kassebaum NJ, Jasrasaria R, Naghavi M et al. A systematic analysis of global anemia burden from 1990 to 2010, Blood, 2014;123:615-624
- Camaschella C, Iron-deficiency anemia, N Engl J Med, 2015;372:1832-1843
- « Iron deficiency during your period can raise risk of mood disorders », sur Mail Online, (consulté le )
- Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L, Iron deficiency anaemia, Lancet, 2016;387:907–916
- « Le rôle de l’enrichissement des aliments dans la lutte contre la malnutrition par carence en micronutriments » (consulté le ) : « tableau 1.2 page 6 Carences en micronutriments : prévalence, facteurs de risque et conséquences pour la santé »
- Nemeth E, Tuttle MS, Powelson J et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization, Science, 2004;306:2090-2093
- Galesloot TE, Vermeulen SH, Geurts-Moespot AJ et al. Serum hepcidin: reference ranges and biochemical correlates in the general population, Blood, 2011;117:e218-e225
- « Prevalence and causes of anemia in the United States, 1976 to 1980 » (consulté le ) : « Iron deficiency anemia (...) In women, menstrual blood loss and the iron losses associated with pregnancy are the major factors. »
- « A REVIEW ON ASSOCIATION BETWEEN PSYCHIATRIC DISORDERS AND IRON DEFICIENCY ANAEMIA IN A TERTIARY CARE TEACHING HOSPITAL » (consulté le )
- (en) Z. Le Lostec, C. Kannengiesser, B. Gury et N. Frenkiel, « Anémie par carence en fer résistant au traitement par voie orale :l’ère des mutations des gènes régulateurs de l’hepcidine », /data/revues/02488663/v30sS2/S0248866309002367/, (lire en ligne, consulté le )
- Du X, She E, Gelbart T et al. The serine protease TMPRSS6 is required to sense iron deficiency, Science, 2008;320:1088-1092
- Par Marc PayetLe 5 avril 2002 à 00h00, « Médecine Carence en fer : la cause enfin trouvée », sur leparisien.fr, (consulté le )
- Netgen, « Marqueurs diagnostiques de la carence en fer : lequel choisir ? », sur Revue Médicale Suisse (consulté le )
- (en) INSERM US14-- ALL RIGHTS RESERVED, « Orphanet: IRIDA syndrome », sur www.orpha.net (consulté le )
- « Iron Deficiency Without Anemia – Common, Important, Neglected », sur www.oatext.com (consulté le )
- D. Hugh Rushton et Julian H. Barth, « What is the evidence for gender differences in ferritin and haemoglobin? », Critical Reviews in Oncology/Hematology, vol. 73, no 1, , p. 1–9 (ISSN 1879-0461, PMID 19394859, DOI 10.1016/j.critrevonc.2009.03.010, lire en ligne, consulté le ) :
« This divergence between genders is aggravated by the lifestyle of modern women who have a very different reproductive history from their forebears. They reach sexual maturity at an earlier age, have fewer pregnancies and breastfeed for shorter periods of time; as a result they menstruate more frequently and therefore become more iron deficient. With the exception of a few countries, women of fertile years around the world have a negative iron balance. »
- « TOUT CE QUE VOUS AVEZ TOUJOURS VOULU SAVOIR SUR LES RÈGLES SANS JAMAIS AVOIR OSÉ LE DEMANDER » (consulté le ), p. 31,46
- D. Hugh Rushton et Julian H. Barth, « What is the evidence for gender differences in ferritin and haemoglobin? », Critical Reviews in Oncology/Hematology, vol. 73, no 1, , p. 1–9 (ISSN 1879-0461, PMID 19394859, DOI 10.1016/j.critrevonc.2009.03.010, lire en ligne, consulté le ) :
« This divergence between genders is aggravated by the lifestyle of modern women who have a very different reproductive history from their forebears. They reach sexual maturity at an earlier age, have fewer pregnancies and breastfeed for shorter periods of time; as a result they menstruate more frequently and therefore become more iron deficient. With the exception of a few countries, women of fertile years around the world have a negative iron balance. »
- (en) Quora, « How And Why Did Women Evolve Periods? », sur Forbes (consulté le )
- D. Hugh Rushton et Julian H. Barth, « What is the evidence for gender differences in ferritin and haemoglobin? », Critical Reviews in Oncology/Hematology, vol. 73, no 1, , p. 1–9 (ISSN 1879-0461, PMID 19394859, DOI 10.1016/j.critrevonc.2009.03.010, lire en ligne, consulté le ) :
« This divergence between genders is aggravated by the lifestyle of modern women who have a very different reproductive history from their forebears. They reach sexual maturity at an earlier age, have fewer pregnancies and breastfeed for shorter periods of time; as a result they menstruate more frequently and therefore become more iron deficient [57,58]. »
- « Impact d’une carence martiale sans anémie sur la performance sportive, intérêt d’une supplémentation ? » (consulté le ) : « page 41 - Dans les pays développés, la plus forte prévalence d’un statut en fer abaissé est observé chez les femmes avant la ménopause, principalement du à des apports trop bas en fer et à des pertes régulières de fer par le biais du cycle menstruel. (...)La principale étiologie de la carence martiale chez les sportives serait les pertes sanguines au cours du cycle menstruel. »
- (en) Quora, « How And Why Did Women Evolve Periods? », sur Forbes (consulté le )
- « Report 2: Breastfeeding among Inuit in Canada » (consulté le )
- « Féminisme biologique, allaitement et travail, unenouvelle forme d’autodétermination des femmes » (consulté le ) : « Les données biologiques de notre espèce sont claires : les humains, comme au demeurant les grands singes, doivent, pour atteindre une santé optimale, être allaités entre deux et sept années. Les travaux de préhistoriens montrent ainsi à partir de l’analyse de la dentition, que les petits humains étaient allaités il y a encore peu de temps, en moyenne cinq années . »
- E. R. Monsen, L. Hallberg, M. Layrisse et D. M. Hegsted, « Estimation of available dietary iron », The American Journal of Clinical Nutrition, vol. 31, no 1, , p. 134–141 (ISSN 0002-9165, PMID 619599, DOI 10.1093/ajcn/31.1.134, lire en ligne, consulté le )
- Abalos E. (2009) Moment du clampage du cordon ombilical chez le nouveau-né à terme : effet sur les résultats maternels et néonatals : Commentaire de la BSG (dernière révision : 2 mars 2009). Bibliothèque de Santé Génésique de l'OMS ; Genève : Organisation mondiale de la Santé.
- (en) Oti-Boateng P, Seshadri R, Petrick S, Gibson RA, Simmer K, « Iron status and dietary iron intake of 6-24-month-old children in Adelaide » J Paediatr Child Health. 1998;34(3):250-3
- (en) Eden AN, Mir MA, « Iron deficiency in 1- to 3-year-old children. A pediatric failure? » Arch Pediatr Adolesc Med. 1997;151(10):986-8
- (en) Dommergues JP, Archambeaud MP, Ducot B, Gerval Y, Hiard C, Rossignol C, Tchernia G. (1989) « Iron deficiency and psychomotor development tests. Longitudinal study between 10 months and 4 years of age », Arch Fr Pediatr. 1989;46(7):487-90.
- (en) Beltrán-Navarro B, Matute E, Vásquez-Garibay E, Zarabozo D, « Effect of Chronic Iron Deficiency on Neuropsychological Domains in Infants » Child Neurol. 2011 Aug 29
- (en) Madan N, Rusia U, Sikka M, Sharma S, Shankar N, « Developmental and neurophysiologic deficits in iron deficiency in children » Indian J Pediatr. 2011 Jan;78(1):58-64.
- (en) Carter RC, Jacobson JL, Burden MJ, Armony-Sivan R, Dodge NC, Angelilli ML, Lozoff B, Jacobson SW, « Iron deficiency anemia and cognitive function in infancy » Pediatrics. 2010;126(2):e427-34.
- (en) Lukowski AF, Koss M, Burden MJ, Jonides J, Nelson CA, Kaciroti N, Jimenez E, Lozoff B, « Iron deficiency in infancy and neurocognitive functioning at 19 years: evidence of long-term deficits in executive function and recognition memory » Nutr Neurosci. 2010;13(2):54-70.
- Monga M, Walia V, Gandhi A, Chandra J, Sharma S (2010) Effect of iron deficiency anemia on visual evoked potential of growing children ; Brain Dev. 2010 Mar;32(3):213-6. Epub 2009 Mar 26
- Peirano PD, Algarín CR, Chamorro R, Reyes S, Garrido MI, Duran S, Lozoff B. (2009) Sleep and neurofunctions throughout child development: lasting effects of early iron deficiency ; J Pediatr Gastroenterol Nutr. 2009 Mar;48 Suppl 1:S8-15
- Georgieff MK. (2008) The role of iron in neurodevelopment: fetal iron deficiency and the developing hippocampus; Biochem Soc Trans. 2008 Dec;36(Pt 6):1267-71
- Insel BJ, Schaefer CA, McKeague IW, Susser ES, Brown AS. (2008) Maternal iron deficiency and the risk of schizophrenia in offspring ; Arch Gen Psychiatry. 2008 Oct;65(10):1136-44
- Youdim MB (2008) Brain iron deficiency and excess; cognitive impairment and neurodegeneration with involvement of striatum and hippocampus ; Neurotox Res. 2008 Aug;14(1):45-56
- Lozoff B, Clark KM, Jing Y, Armony-Sivan R, Angelilli ML, Jacobson SW. (2008) Dose-response relationships between iron deficiency with or without anemia and infant social-emotional behavior ; J Pediatr. 2008 May;152(5):696-702, 702.31-3. Epub 2007 Nov 19
- Lozoff B (2007) Iron deficiency and child development ; Food Nutr Bull. 2007 Dec;28(4 Suppl):S560-71
- Lozoff B, Jimenez E, Smith JB (2006) Double burden of iron deficiency in infancy and low socioeconomic status: a longitudinal analysis of cognitive test scores to age 19 years ; Arch Pediatr Adolesc Med. 2006 Nov;160(11):1108-13
- Shafir T, Angulo-Barroso R, Su J, Jacobson SW, Lozoff B. (2009) Iron deficiency anemia in infancy and reach and grasp development ; Infant Behav Dev. 2009 Dec;32(4):366-75. Epub 2009 Jul 9
- van Rheenen P, Brabin BJ. Emma (2004) Late umbilical cord-clamping as an intervention for reducing iron deficiency anaemia in term infants in developing and industrialised countries: a systematic review ; Ann Trop Paediatr. 2004 Mar;24(1):3-16.
- Strauss RG, Mock DM, Johnson K, Mock NI, Cress G, Knosp L, Lobas L, Schmidt RL. (2003) Circulating RBC volume, measured with biotinylated RBCs, is superior to the Hct to document the hematologic effects of delayed versus immediate umbilical cord clamping in preterm neonates ; Transfusion. 2003 Aug;43(8):1168-72
- Kazal LA Jr. () Failure of hematocrit to detect iron deficiency in infants ; J Fam Pract. 1996 Mar;42(3):237-40
- Linderkamp O, Nelle M, Kraus M, Zilow EP. The effect of early and late cord-clamping on blood viscosity and other hemorheological parameters in full-term neonates. Acta Paediatrica 1992;81:745–750
- Yao AC, Lind J. (1974) Placental transfusion. American Journal of Diseases of Children. 1974;127:128–141
- Sevda Korkmaz, Sevler Yıldız, Tuba Korucu et Burcu Gundogan, « Frequency of anemia in chronic psychiatry patients », Neuropsychiatric Disease and Treatment, vol. 11, , p. 2737–2741 (ISSN 1176-6328, PMID 26543367, PMCID 4622486, DOI 10.2147/NDT.S91581, lire en ligne, consulté le )
- « VIDAL - Anémie ferriprive de l'adulte - Prise en charge », sur www.vidal.fr (consulté le )
- « Iron Deficiency Anemia - an overview | ScienceDirect Topics », sur www.sciencedirect.com (consulté le ) : « The clinical characteristics of iron deficiency anemia are nonspecific and include pallor, rapid exhaustion, muscular weakness, anorexia, lassitude, difficulty in concentrating, headache, palpitations, dyspnea on exertion, angina on effort, peculiar craving for unnatural foods (pica), ankle edema, and abnormalities involving all proliferating tissues, especially mucous membranes and the nails »
- « Anémies » (consulté le )
- « ANÉMIES FERRIPRIVES CHEZ LES PERSONNES ÂGÉES DE 65 ANS ET PLUS : ETUDE D’UNE COHORTE DE 102 PATIENTS » (consulté le )
- « Anemia: Does it Have Effect on Menstruation? » (consulté le )
- Professeur Dominique PLANTAZ, « Anémie par carence martiale chez l’enfant »,
- (en) John Fletcher, Jean Mather, Malcolm J. Lewis et George Whiting, « Mouth Lesions in Iron-Deficient Anemia: Relationship to Candida albicans in Saliva and to Impairment of Lymphocyte Transformation », The Journal of Infectious Diseases, vol. 131, no 1, , p. 44–50 (ISSN 0022-1899, DOI 10.1093/infdis/131.1.44, lire en ligne, consulté le )
- « Case report of oral candidiasis in iron deficiency anemia patients from Basrah, Iraq » (consulté le )
- Shin-Yu Lu, « Perception of iron deficiency from oral mucosa alterations that show a high prevalence of Candida infection », Journal of the Formosan Medical Association, vol. 115, no 8, , p. 619–627 (ISSN 0929-6646, DOI 10.1016/j.jfma.2016.03.011, lire en ligne, consulté le )
- Wu YC, Wang YP, Chang JY et al. Oral manifestations and blood profile in patients with iron deficiency anemia, J Formos Med Assoc, 2014;113:83–87
- Mu-Hong Chen, Tung-Ping Su, Ying-Sheue Chen et Ju-Wei Hsu, « Association between psychiatric disorders and iron deficiency anemia among children and adolescents: a nationwide population-based study », BMC Psychiatry, vol. 13, , p. 161 (ISSN 1471-244X, PMID 23735056, PMCID 3680022, DOI 10.1186/1471-244X-13-161, lire en ligne, consulté le )
- « Anaemia and depletion of iron stores as risk factors for postpartum depression: a literature review » (consulté le )
- Rafal W. Wojciak, « Effect of short-term food restriction on iron metabolism, relative well-being and depression symptoms in healthy women », Eating and weight disorders: EWD, vol. 19, no 3, , p. 321–327 (ISSN 1590-1262, PMID 24353086, PMCID 4143608, DOI 10.1007/s40519-013-0091-2, lire en ligne, consulté le )
- Gulsum Emel Pamuk, Mehmet Sevki Uyanik, Mehmet Serif Top et Umit Tapan, « Gastrointestinal symptoms are closely associated with depression in iron deficiency anemia: a comparative study », Annals of Saudi Medicine, vol. 35, no 1, , p. 31–35 (ISSN 0256-4947, PMID 26142935, PMCID 6152543, DOI 10.5144/0256-4947.2015.31, lire en ligne, consulté le )
- Mei-Lien Pan, Li-Ru Chen, Hsiao-Mei Tsao et Kuo-Hu Chen, « Iron Deficiency Anemia as a Risk Factor for Osteoporosis in Taiwan: A Nationwide Population-Based Study », Nutrients, vol. 9, no 6, (ISSN 2072-6643, PMID 28621741, PMCID 5490595, DOI 10.3390/nu9060616, lire en ligne, consulté le ) :
« Compared with individuals without IDA, patients with a history of IDA had a near two-fold risk for osteoporosis. »
- Laura Toxqui et M. Pilar Vaquero, « Chronic Iron Deficiency as an Emerging Risk Factor for Osteoporosis: A Hypothesis », Nutrients, vol. 7, no 4, , p. 2324–2344 (ISSN 2072-6643, PMID 25849944, PMCID 4425147, DOI 10.3390/nu7042324, lire en ligne, consulté le )
- (en-GB) « Relationship between the presence of anemia and the risk of osteoporosis in women with rheumatoid arthritis », sur Revista de Osteoporosis y Metabolismo Mineral · Publicación Oficial SEIOMM, (consulté le )
- Netgen, « L’anémie du sujet âgé : une pathologie fréquente à ne pas banaliser », sur Revue Médicale Suisse (consulté le ) : « des taux d’hémoglobine de < 140 g/l chez l’homme et < 130 g/l chez la femme seraient des facteurs prédictifs d’ostéoporose. »
- Siddappa AM, Georgieff MK, Wewerka S, Worwa C, Nelson CA, Deregnier RA (2004) Iron deficiency alters auditory recognition memory in newborn infants of diabetic mothers ; Pediatr Res. 2004 Jun;55(6):1034-41.
- Tamura T, Goldenberg RL, Hou J, Johnston KE, Cliver SP, Ramey SL, Nelson KG. (2002) Cord serum ferritin concentrations and mental and psychomotor development of children at five years of age. ; Pediatr. 2002 Feb;140(2):165-70
- Kobe J (1995) The effect of iron deficiency and mental stimulation on Indonesian children's cognitive performance and development ; Med Sci. 1995 Apr;41(1-2):1-17
- Ramakrishnan K, Borade A. (2010) Anemia as a risk factor for childhood asthma. ; Lung India. 2010 Apr;27(2):51-3
- Peirano PD, Algarín CR, Chamorro RA, Reyes SC, Durán SA, Garrido MI, Lozoff B (2010) Sleep alterations and iron deficiency anemia in infancy ; Sleep Med. 2010 Aug;11(7):637-42
- Walter T. (2003) Effect of iron-deficiency anemia on cognitive skills and neuromaturation in infancy and childhood ; Food Nutr Bull. 2003 Dec;24(4 Suppl):S104-10
- Lozoff B, Armony-Sivan R, Kaciroti N, Jing Y, Golub M, Jacobson SW (2010) Eye-blinking rates are slower in infants with iron-deficiency anemia than in nonanemic iron-deficient or iron-sufficientinfants ; J Nutr. 2010 May;140(5):1057-61. Epub 2010 Mar 24
- Felt B, Jimenez E, Smith J, Calatroni A, Kaciroti N, Wheatcroft G, Lozoff B. (2006) Iron deficiency in infancy predicts altered serum prolactin response 10 years later ; Pediatr Res. 2006 Nov;60(5):513-7. Epub 2006 Sep 11.
- Algarín C, Peirano P, Garrido M, Pizarro F, Lozoff B. (2003) Iron deficiency anemia in infancy: long-lasting effects on auditory and visual system functioning ; Pediatr Res. 2003 Feb;53(2):217-23
- Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ, The prevalence and impact of restless legs syndrome on patients with iron deficiency anemia, Am J Hematol, 2013;88:261–264
- Luigia De Falco, Mayka Sanchez, Laura Silvestri et Caroline Kannengiesser, « Iron refractory iron deficiency anemia », Haematologica, vol. 98, no 6, , p. 845–853 (ISSN 0390-6078, PMID 23729726, PMCID 3669438, DOI 10.3324/haematol.2012.075515, lire en ligne, consulté le )
- Netgen, « Diagnostic et traitement de la carence en fer sans anémie », sur Revue Médicale Suisse (consulté le )
- Pirkko Peuranpää, Satu Heliövaara-Peippo, Ian Fraser et Jorma Paavonen, « Effects of anemia and iron deficiency on quality of life in women with heavy menstrual bleeding », Acta Obstetricia Et Gynecologica Scandinavica, vol. 93, no 7, , p. 654–660 (ISSN 1600-0412, PMID 24912842, DOI 10.1111/aogs.12394, lire en ligne, consulté le )
- Portail de la médecine
- Portail de l’hématologie