Éthanedial
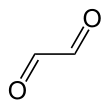
L'éthanedial ou glyoxal est un composé organique de formule brute C2H2O2 et de formule semi-développée O=CH-CH=O. Ce liquide de couleur jaune est le plus petit dialdéhyde existant. C'est aussi une forme tautomère de l'éthynediol (HO–C≡C–OH).
| Éthanedial | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | éthanedial |
| Synonymes |
éthane-1,2-dione, glyoxal |
| No CAS | |
| No ECHA | 100.003.160 |
| SMILES | |
| InChI | |
| Apparence | liquide, prisme jaune sous 15 °C |
| Propriétés chimiques | |
| Formule | C2H2O2 [Isomères] |
| Masse molaire[1] | 58,036 1 ± 0,002 3 g/mol C 41,39 %, H 3,47 %, O 55,14 %, |
| Propriétés physiques | |
| T° fusion | 15 °C[2] |
| T° ébullition | 50,4 °C[2],[3] |
| Solubilité | 600 g l−1 dans l'eau à 20 °C[2] |
| Masse volumique | 1,14 g cm−3[2] |
| Pression de vapeur saturante | 293 mbar à 20 °C[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Production et synthèse
L'éthanedial commercial est préparé soit par l'oxydation en phase gazeuse de l'éthylène glycol (éthane-1,2-diol), catalysée par de l'argent voire du cuivre, soit par l'oxydation en phase liquide d'éthanal en présence d'acide nitrique. La capacité globale de production est d'environ 220 000 tonnes par an avec une baisse de production due à une surcapacité asiatique. La plupart de la production se fait en phase gazeuse. Le premier producteur d'éthanedial était situé sur le site de Lamotte à Trosly-Breuil en France, site dont le propriétaire actuel est Weylchem. Aujourd'hui la production est largement dominée par BASF en Allemagne, sur le site de Ludwigshafen. Ils atteignent 60 000 tonnes par an. Il existe seulement deux sites de production en Amérique (Geismer en Californie et Charlotte en Caroline du nord). Récemment, la Chine s'est dotée de capacités de production supplémentaires.
Au laboratoire, l'éthanedial est synthétisé par oxydation de l'éthanal avec de l'acide sélénique[4]. La préparation de l'éthanedial anhydre se fait par chauffage d'hydrates de ce composé avec du pentoxyde de phosphore dans un dispositif doté d'un recondenseur[5].
Utilisation
Les industries du papier et du textile utilisent de grandes quantités d'éthanedial qui joue le rôle d'agent de réticulation pour des formulations à partir d'amidon. C'est également un initiateur des urées utilisées lors de traitements chimiques augmentant la résistance aux froissements. L'éthanedial sert d'agent de solubilisation et d'agent de réticulation en chimie des polymères :
- protéines (tannage du cuir) ;
- collagène ;
- dérivés cellulosiques (textiles) ;
- hydrocolloides ;
- amidon.
L'éthanedial sert de précurseur pour la production d'acide glyoxylique et d'acide oxalique[6].
C'est un bon intermédiaire en chimie organique, particulièrement pour la synthèse d'hétérocycles comme les imidazoles[7]. Une forme du réactif utilisée en laboratoire est le bis-hemiacétal avec de l'éthylène glycol, 1,4-dioxane-2,3-diol. Ce composé est disponible dans le commerce.
Solution d'éthanedial
Le composé est fourni typiquement en solution aqueuse concentrée à 40 %. Comme d'autres petits aldéhydes, il forme des hydrates. De plus ces hydrates se condensent pour former une série d'oligomères, dont la structure reste mal connue. Pour la plupart des applications, la structure exacte n'a pas de conséquences. Au moins deux hydrates d'éthanedial sont vendus dans le commerce :
- un dimère d'éthanedial, dihydraté : [(CHO)2]2[H2O]2, 1,4-dioxane-trans-2,3-diol (numéro CAS , point de fusion 91 à 95 °C) ;
- un trimère d'éthanedial, dihydraté : [(CHO)2]3(H2O)2 (numéro CAS ).
On estime qu'à des concentrations inférieures à 1 mol/l, l'éthanedial existe majoritairement sous forme de monomère, c'est-à-dire : OCHCHO, OCHCH(OH)2, ou (HO)2CHCH(OH)2. À des concentrations supérieures à 1 mol/l, la forme prédominante est le dimère. Ces dimères sont probablement des dioxanes, de formule [(HO)CH]2O2CHCHO[8]. Les dimères et les trimères peuvent précipiter en raison d'une solubilité plus faible dans des solutions plus froides, à moins de 4,4 °C.
Autre origine
L'éthanedial est un composé inflammable formé lorsqu'on chauffe des mélanges d'huiles et de lipides à haute température.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Glyoxal » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 107-22-2 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire).
- « US20080274046 », sur http://www.uspto.gov/, (consulté le ).
- Ronzio, A. R.; Waugh, T. D., Glyoxal Bisulfite, Org. Synth., coll. « vol. 3 », , p. 438.
- (en) Harries, C.; Temme, F., « Über monomolekulares und trimolekulares Glyoxal », Berichte, vol. 40, , p. 165–172 (DOI 10.1002/cber.19070400124).
A quote from this paper is instructive of the chemistry of that era « Man erhitzt nun das Glyoxal-Phosphorpentoxyd-Gemisch mit freier Flamme und beobachtet bald, dass sich unter Schwarzfärbung des Kolbeninhalte ein flüchtiges grünes Gas bildet, welches sich in der gekühlten Vorlage zu schönen Krystallen von gelber Farbe kondensiert. » (One heats the mixture of (crude) glyoxal and P4O10 with an open flame and soon observes that, upon blackening of the contents, a mobile green gas, which condenses in the cooled flask as beautiful yellow crystals). - Sylvie Latieule, « WeylChem Lamotte : Nous souhaitons devenir la plateforme de chimie verte de la région Hauts-de-France », sur Infochimie, (consulté le ).
- Snyder, H. R. ; Handrick, R. G. et Brooks, L. A., Imidazole, Org. Synth., coll. « vol. 3 », , p. 471.
- (en) Whipple, E. B., « Structure of Glyoxal in Water », J. Am. Chem. Soc., vol. 90, , p. 7183–7186 (DOI 10.1021/ja00727a027).