Histoire évolutive de l'œil
L'œil est un système sensoriel utilisé dans l'ensemble du règne animal. En effet, la lumière donnant un grand nombre d'informations sur l'environnement, elle est, et a été, une force sélective majeure, qui a conduit à la formation d'une grande variété de systèmes capables de percevoir la lumière.
La définition de l'œil varie selon les biologistes, certains considérant qu'un œil est un organe capable de produire une image à partir de différences d'intensités entre photorécepteurs[1]. Dans cet article, l'œil est défini dans un sens plus large, comme étant l'association fonctionnelle d'au moins une cellule photoréceptrice et une cellule pigmentée[2].
L'évolution de l'œil commence pendant la période précambrienne, alors que se forme une opsine primitive, à l'origine des opsines des yeux actuels, responsables de la photoréception. La radiation évolutive du Cambrien est ensuite marquée par l'évolution convergente d'yeux complexes chez de nombreux embranchements formés à cette époque. Les yeux ainsi formés présentent une grande diversité de structures, notamment sur la manière dont la lumière est captée et concentrée. Par la suite, les yeux évoluent sous l'influence des pressions sélectives de leur environnement, et les changements d'habitats ou de mode de vie sont souvent associés à des changements importants dans la structure et la fonction de l'œil.
Diversité des yeux
Environ 1/3 des 33 embranchements animaux existants possèdent des organes photosensibles, et un autre tiers possèdent des yeux, le dernier tiers n'ayant a priori pas d'organes spécialisés dans la détection de la lumière[1]. On constate aujourd'hui une importante diversité, aussi bien dans la structure morphologique, anatomique ou moléculaire de l'œil, que dans le type d'information prélevé à partir de la lumière[3].
Diversité fonctionnelle
Les yeux, s'ils permettent tous de percevoir et d'analyser la lumière, n'en retirent pas tous les mêmes informations. En effet, peuvent-être analysées :
- La direction, ce qui nécessite différentes orientation des pigments.
- L'intensité. Tous les yeux sont capables de percevoir l'intensité lumineuse. Cependant, il existe une grande variabilité dans la sensibilité (intensité minimale perçue) et la qualité de contraste (différence minimale d'intensité perçue) au sein du règne animal.
- La longueur d'onde. Alors que certains yeux ne détectent pas du tout la longueur d'onde de la lumière incidente, de nombreux yeux sont capables de percevoir les couleurs. La perception des couleurs et des contrastes varie grandement selon les embranchements (parfois même les genres) considérés.
- La formation d'une image. La concentration de pigments dans une zone de la rétine, la fovéa, permet la formation d'une image chez certains yeux. Seuls 6 embranchements animaux (les Cnidaires, les Mollusques, les Arthropodes, les Chordés, les Annélides et les Onychophores) sur 33 possèdent des yeux capables de former des images, mais ces embranchements représentent, à eux seuls, 96 % des espèces animales connues[4]. Là encore, la résolution de l'image formée varie énormément d'une espèce à l'autre.
Diversité structurale
Toutes les structures d'œil présentent une variabilité, parfois associée à différentes fonctions :
- Il existe de nombreux pigments différents, composés d'une opsine (5 classes différentes chez les vertébrés) et d'un chromophore (2 différents). Le nombre de pigments différents, et le type de pigments présents, diffèrent entre les espèces, et même entre les différentes cellules photoréceptrices d'une même espèce. De plus, il peut exister un polymorphisme spécifique. au niveau du nombre et du type de pigment présents.
- Les cellules photoréceptrices peuvent être ciliées ou rhabdomériques (et possèdent alors des microvillosités).
- La vision chromatique peut être obtenue par une composition variée de pigments (chez l'homme, par exemple), mais aussi par la présence de gouttelettes lipidiques dans la rétine, et formant un filtre coloré.
- Les yeux peuvent ne contenir qu'une seule chambre oculaire (œil camérulaire, chez les vertébrés et les Céphalopodes, exemple de convergence évolutive) ou être composés de multiples yeux élémentaires appelés ommatidies (œil composé, chez la majorité des Arthropodes).
- S'il y a création d'une image, celle-ci peut-être formée par ombrage, par réfraction ou par réflexion, ces trois types d'images étant trouvés dans la plupart des embranchements pouvant former des images.
- Les crystallines, responsables de la réfraction dans la lentille, sont généralement taxon-spécifique.
- La position et le nombre d'yeux sont très variables selon les espèces.
Pressions sélectives contraignant l'évolution de l'œil
La lumière a été la principale force sélective sur Terre[5], résultant en l'apparition de nombreux systèmes photorécepteurs dans l'ensemble du vivant, permettant le développement de rythmes circadiens et d'horloges biologiques réglés sur la lumière du Soleil, ainsi que d'yeux permettant l'orientation par rapport à la lumière environnante.
L'évolution de l'œil est, en conséquence, dépendante de la quantité et du type de lumière présent dans son environnement, et on observe de très nombreuses adaptations liées à l'environnement lumineux des animaux.
Par ailleurs, la perception de la lumière est limitée par des contraintes physiques, notamment les lois de l'optique, qui limitent le nombre de possibilités pour collecter la lumière. Ceci explique la convergence de structure d'un grand nombre d'yeux. C'est ainsi que les poissons et les céphalopodes primitifs ont développé indépendamment une lentille sphérique, réponse adaptée à la collecte de lumière en milieu aquatique[6].
Formation du proto-œil
Les premières perceptions de la lumière ont probablement évolué au début du Cambrien, grâce à la formation d'une proto-opsine, ancêtre de toutes les opsines actuelles[7]. Cette molécule aurait intégré la membrane de la première cellule photoréceptrice, grâce à un domaine protéique constitué de 7 hélices transmembranaires, lequel aurait été réutilisé à partir des protéines impliquées dans la chémoréception, c'est-à-dire la perception de molécules chimiques.
Cette proto-opsine s'est ensuite associée au rétinal, formant un groupe de photopigments (les opsines se liant au rétinal, ou retinal-binding opsins) présents aussi bien chez les animaux que chez les Eubactéries et certaines algues unicellulaires et qui sont responsables du phototactisme[8].
Par ailleurs, le gène Pax6, jouant un rôle important dans le développement de l'œil chez les Métazoaires, est associé très tôt à ce photopigment au cours de l'évolution. Ainsi, la forme ancestrale de Pax6 était probablement impliquée dans le développement des premiers organes ou organites photosenseurs.
Enfin, on retrouve des cellules ciliées et rhabdomériques dans la plupart des phyla dotés d'yeux, ce qui suggère une différenciation de ces deux types de cellules antérieure à l'explosion cambrienne et l'apparition convergente des nombreuses formes d'yeux.
Diversification de l'œil
Lors de la radiation évolutive du Cambrien, des yeux plus complexes ("pit eye") sont formés à de très nombreuses reprises (au moins 40 fois[9]), de manière indépendante, à partir de l'œil primitif. Ces yeux ont une structure en forme de puits, dans lequel les cellules réceptrices tapissent le fond de la cavité.
Il y a alors évolution de l'opsine dans les différents phyla aboutissant à la formation de différentes familles d'opsines. L'évolution des opsines est alors souvent influencée par l'environnement lumineux des différents animaux. De plus, le mécanisme de collecte de la lumière évolue en parallèle, et aboutit dans de nombreux cas à la création de nouveaux systèmes de collecte de la lumière et de formation d'images, parfois de manière convergente.
Évolution des pigments photosensibles
L'ensemble des organismes animaux dotés d'yeux perçoivent la lumière par des photopigments. Ceux-ci sont tous issus d'un même photopigment primitif ayant évolué avant la radiation cambrienne. Les photopigments présentent donc de nombreuses caractéristiques communes. Ils sont constitués d'une partie protéique membranaire (apoprotéine), l'opsine, et d'une partie lipidique, le chromophore. L'apoprotéine est constituée de 7 hélices transmembranaires séparées par des boucles hydrophiles reliant ces domaines, alternativement cytoplasmique et extracellulaire. Le chromophore est un dérivé de la vitamine A (ou retinal), qui présente un grand nombre de doubles liaisons conjuguées permettant l'absorption de photons à une longueur d'onde particulière par passage d'une configuration 11-cis à une configuration all-trans. Il s'agit toujours du 11-cis-retinal ou du 11-cis-3,4-dehydroretinal. La réponse cellulaire est déclenchée suite à l'activation du photopigment dont l'opsine déclenche, via un second messager, une cascade d'activation.
On remarque que la plupart des opsines actuelles ont un maximum d'absorption dans le bleu, aux alentours de 500 nm. Ceci est dû aux origines des pigments, qui ont tout d'abord évolué dans un milieu aquatique. L'eau absorbant la plupart des radiations lumineuses, seule persiste en profondeur la lumière bleue de longueur d'onde d'environ 480 nm. Ainsi, les pigments ancestraux préférentiellement sélectionnés étaient ceux capables d'absorber ces longueurs d'onde. La spécificité des pigments pour certaines longueurs d'onde préférentielles a ensuite évolué, souvent en adéquation avec l'environnement lumineux.
Deux parties de l'opsine sont extrêmement conservées au cours de l'évolution des différentes lignées animales : la boucle cytoplasmique reliant les hélices 1 et 2, ainsi que le site d'attachement covalent au chromophore situé au sein de la septième hélice transmembranaire. Cette conservation montre l'importance de ces deux sites dans la fonction de l'opsine.
Les autres régions, moins conservées, permettent de suivre l'évolution des opsines dans les différents embranchements animaux. Si l'évolution des opsines est bien étudiée dans certains taxa, tels les Insectes et les Vertébrés, on connait moins la manière dont elles se sont séparées avant la formation des grands embranchements. Cependant, on sait que l'ensemble des opsines des Vertébrés s'individualisent nettement des opsines des autres Métazoaires[10], ce qui montre qu'une seule opsine a été à l'origine des diverses opsines chez les Vertébrés. Ainsi, la suite se concentre sur l'évolution des opsines dans certains embranchements particuliers.
Chez les Vertébrés
On distingue chez les Vertébrés 6 grandes familles d'opsines :
- Les rhodopsines (ou RH1) exprimées préférentiellement dans les cellules en bâtonnets.
- Les pigments proches de la Rhodopsine (Rhodopsin-like pigments ou RH2).
- Les pigments sensibles aux courtes longueurs d'onde de type 1 et 2 (Short wavelength sensitive pigments, ou SWS1 et SWS2).
- Les pigments sensibles aux longueurs d'onde moyennes à longues (Middle and long wavelength sensitive pigments, ou M/LWS).
- Les pigments pinéaux (ou pigments P) ne se trouvent pas dans la rétine, mais exclusivement dans la glande pinéale.
Les opsines de ces 5 familles s'avèrent être plus proches les unes des autres que de n'importe quelle autre opsine animale, et la proximité évolutive est plus proche au sein de chaque famille qu'entre les familles. Ainsi, ces 6 familles de pigments se sont différenciées après la séparation des Vertébrés des autres embranchements animaux, et avant la séparation des Vertébrés en ordres distincts. Ces familles se sont formées par 5 duplications de gènes différentes, puis spécialisation de chacun des deux gènes formés dans la perception de certaines longueurs d'onde. Ainsi, les quatre familles de pigments des cellules en cônes se sont différenciées, d'abord, et les pigments des cellules en bâtonnets se sont ensuite individualisés à partir des pigments de type RH2.
└─o Pigment ancestral des Vertébrés
├─o
│ ├─o Pigments P
│ │
│ └─o Pigments M/LWS
└─o
├─o Pigments SWS1
└─o
├─o Pigments SWS2
└─o
├─o Pigments RH2
│
└─o Pigments RH1
Par la suite, certaines opsines ont été perdues par divers taxons. L'homme, par exemple, ne possède ni pigment SWS2, ni pigment RH2. Ces opsines ont été perdues au cours de l'évolution des Mammifères. Aucun Mammifère ne possède de pigment RH2, et seul l'Ornithorynque possède des pigments SWS2. Ainsi, les pigments RH2 ont régressé chez l'ancêtre des mammifères, alors que les pigments SWS2 ont probablement régressé chez l'ancêtre des Mammifères placentaires, après la séparation des Monotrèmes.
À l'heure actuelle, l'évolution des opsines RH1 (responsable de la vision en faible luminosité), SWS1 (responsable de la vision ultraviolette) et M/LWS (responsable de la vision chromatique en rouge/vert) est mieux connue que celle des autres opsines des Vertébrés.
Méthode d'étude
Une méthode apportant un grand nombre d'informations sur l'évolution des opsines est celle utilisée par S. Yokoyama et al[11]. Elle consiste à construire une phylogénie des différents pigments, puis à prédire, par inférence, la séquence peptidique des opsines ancestrales correspondant aux différents nœuds. Enfin, les pigments ancestraux inférés sont synthétisés, et la longueur d'onde d'absorption maximale des différents pigments, actuels et synthétiques, est mesurée. On peut ainsi avoir une idée du spectre d'absorption des différents pigments ancestraux et de la vision de l'ancêtre, et retracer plus finement les transitions évolutives.
De plus, certaines mutations (sélectionnées après comparaison avec les pigments actuels) sont introduites dans des pigments ancestraux. Leur effet sur la longueur d'onde d'absorption maximale est alors évalué. On peut ainsi chercher à retrouver les mutations ayant des modifications importantes dans les caractéristiques d'absorption des pigments, et qui auraient pu être sélectionnées.
Cette méthode est néanmoins soumise à plusieurs biais. Tout d'abord, l'effet des mutations ponctuelles dépend fortement de la séquence peptidique du reste de la molécule, la même mutation pouvant avoir des modifications de longueur d'onde opposées dans deux pigments différents. Ainsi, on ne peut prédire les changements survenus par le passé à partir des mutations observées sur les pigments contemporains. De plus, la plupart des mutations prédites et étudiées ne se retrouvent jamais dans la nature, et il faudrait étudier l'influence des mutations réellement observées.
La vision en faible luminosité
Les pigments RH1 se trouvent essentiellement dans les cellules en bâtonnets des Vertébrés, et sont par conséquent responsables de la vision en faible luminosité et ne servent pas à la discrimination des couleurs. L'évolution de ces pigments est marquée par de nombreuses mutations responsables de modification de la longueur d'onde d'absorption maximale du photopigment. Si le pigment RH1 de l'ancêtre des Vertébrés (vivant en eau de surface) absorbait le mieux autour de 500 nm, on observe aujourd'hui un décalage de l'absorption du pigment RH1 vers le bleu chez un grand nombre de Vertébrés vivant en milieu aquatique profond. Ceci traduit probablement une adaptation à l'absorption des longueurs d'onde supérieures par l'eau, imposant la sélection convergente dans plusieurs ordres des individus capables de détecter la lumière atteignant les profondeurs.
Perception des couleurs rouges et vertes
Il existe au moins quatre manières de percevoir les couleurs à partir du système dichromatique vert-rouge chez les Vertébrés :
- Grâce aux pigments M/LWS ;
- Grâce aux pigments RH2 (ces derniers ayant perdu leur fonction chez les Mammifères) ;
- Grâce au couplage de l'un ou l'autre des deux chromatophores à la molécule d'opsine. La perception des couleurs peut alors être régulée par l'individu. C'est le cas de nombreux poissons, oiseaux et reptiles qui ne possèdent pas de pigment MWS[12] ;
- Grâce à la présence de différents types de gouttelettes lipidiques dans des cellules photoréceptrices spécialisées. Ces gouttelettes jouent alors le rôle de filtre pour certaines longueurs d'onde et permettent une discrimination des couleurs. On retrouve notamment ce système chez certaines espèces d'oiseaux[13].
L'évolution du système de perception des couleurs par les pigments M/LWS s'est faite de manière convergente chez plusieurs ordres de Vertébrés comme les Cervidés et les Primates. Le pigment ancestral est un pigment LWS dont la longueur d'onde d'absorption maximale avoisinait probablement les 560 nm. Il y a ensuite eu de manière répétée une duplication du gène codant le pigment LWS, et une évolution de l'une de ces copies vers une absorption des longueurs d'onde plus faibles, correspondant au vert. Cette transition vers les faibles longueurs d'onde s'est faite par un nombre limité de mutations, et est principalement due à trois mutations qui ont été sélectionnées de manière répétée dans des familles distinctes de Vertébrés. Il y a donc dans ce cas convergence fonctionnelle et génétique de l'évolution de la vision en rouge/vert.
L'avantage évolutif conféré par la perception des couleurs reste controversé. En effet, si la perception des couleurs permet d'obtenir une quantité plus importante d'informations sur son environnement (notamment sur ses prédateurs, ses proies ou ses partenaires potentiels), elle réussit plus difficilement à déceler les camouflages par la couleur. On a aujourd'hui du mal à prendre en compte tous les avantages sélectifs qui peuvent être impliqués dans la perception ou non des couleurs, et il est probable que cet avantage dépende fortement du contexte écologique de l'espèce.
Perception du violet et des ultraviolets
Chez les Vertébrés, le violet et les ultraviolets sont détectés grâce aux pigments SWS1 et SWS2. Ce dernier pigment ayant perdu sa fonction chez les Mammifères placentaires, il a été beaucoup moins étudié et on connait encore mal son évolution. Nous nous concentrerons donc sur la vision violette et ultraviolette permise par le pigment SWS1 par la suite.
L'ancêtre des Vertébrés possédait un pigment SWS1 dont la longueur d'absorption maximale approchait probablement les 360 nm, ce qui lui permettait probablement de voir les ultraviolets. Cependant ce pigment a évolué plusieurs fois de manière convergente vers une absorption du bleu, notamment chez l'ancêtre des Oiseaux et chez plusieurs ordres de Mammifères. Cette perte répétée de la vision ultraviolette a été sélectionnée pour deux raisons principales : Tout d'abord, les ultraviolets étant très énergétiques, ils peuvent endommager les tissus rétiniens et anéantir la fonction de l'œil. La disposition de pigments jaunes dans la lentille et la cornée, absorbant les ultraviolets et protégeant la rétine, a donc été sélectionnée au cours de l'évolution, ce qui est défavorable à la vision ultraviolette. De plus, le passage de l'absorption maximale des pigments SWS1 vers le bleu permet une discrimination plus fine des tons de bleu et de violet.
Cependant, on observe un maintien de la vision ultraviolette chez plusieurs groupes de Vertébrés. La souris marque par exemple son trajet d'excréments reflétant les ultraviolets, et s'en sert ainsi comme moyen de repère et de communication. Certains oiseaux migrateurs sont même retournés à une vision ultraviolette. Cette réversion aurait été sélectionnée en raison des capacités d'orientation par rapport au Soleil conférées par la vision ultraviolette.
Évolution des chromophores
L'ancêtre des Insectes n'utilisait que le 11-cis retinal (A1) comme chromophore, et la capacité à utiliser le 11-cis-3-hydroxy retinal (A3) n'apparait qu'à la fin du Crétacé[14]. On retrouve des pigments A3 chez 9 ordres d'Insectes, dans lesquels la plupart des espèces utilisent soit le chromophore A1, soit le chromophore A3, et quelques espèces sont capables d'utiliser les deux chromophores.
Le changement de chromophore associé à une même opsine modifie légèrement le spectre d'absorption du pigment. L'utilisation des deux chromophores chez une seule espèce pourrait ainsi permettre une adaptation à des conditions visuelles différentes, notamment chez les Odonates où 44 des 46 espèces étudiées possèdent les deux chromophores A1 et A3.
L'apparition convergente du chromophore A3 pendant le Crétacé pourrait être expliquée par l'augmentation de la concentration en oxygène atmosphérique durant le Carbonifère. En effet, les précurseurs des pigments A1 et A3, respectivement le carotène et les xanthophylles, sont issus des plantes. Or la synthèse de xantophylle par les plantes à partir de carotène nécessite du dioxygène. Ainsi, l'augmentation de la concentration de dioxygène pendant le Carbonifère aurait favorisé la synthèse de xanthophylles chez les plantes et rendu ce précurseur plus accessible pour les Insectes, permettant l'utilisation du chromophore A3.
Phylogénie des opsines
L'étude phylogénétique des molécules d'opsines présentes dans différentes espèces d'insectes permet de délimiter nettement trois groupes monopylétiques distincts regroupant des pigments excités par des longueurs d'onde proche[15]. On découpe ainsi les opsines des Insectes en trois classes, selon qu'elles absorbent dans l'ultra-violet, le bleu ou le vert. Ces trois classes d'opsines sont retrouvées dans la plupart des espèces étudiées, ce qui suggère que la différenciation de ces pigments a eu lieu chez l'ancêtre commun des Insectes. Par ailleurs, des opsines sensibles au rouge sont apparues plusieurs fois de manière convergente chez plusieurs espèces d'insectes. Enfin, on a pu observer une duplication du gène codant une des opsines chez plusieurs espèces, dont la Drosophile.
Évolution des cellules photoréceptrices
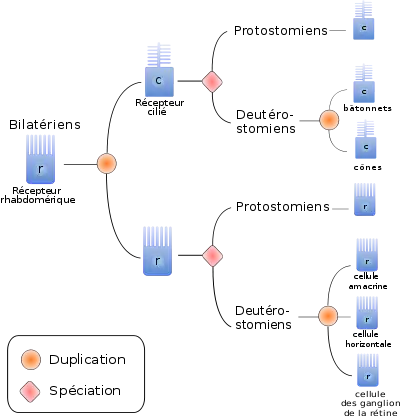
Une manière d'optimiser la perception de la lumière est d'augmenter la surface membranaire des cellules réceptrices. On distingue ainsi trois types de cellules réceptrices, en fonction de la stratégie utilisée pour augmenter la surface cellulaire :
- Les récepteurs ciliés possèdent une expansion cytoplasmique en forme de disque. On les trouve majoritairement chez les Deutérostomiens. L'activation du pigment provoque, dans ces cellules, une fermeture des canaux membranaires sodiques, et par conséquent une hyperpolarisation de la membrane, enclenchant la réponse cellulaire[17].
- Les récepteurs rhabdomériques possèdent des microvillosités au niveau de la membrane porteuse du pigment photosensible. Ces récepteurs, présents surtout chez les Protostomiens, ouvrent les canaux sodiques en réponse à l'activation du pigment, ce qui dépolarise la membrane et déclenche la réponse cellulaire[18].
- Les récepteurs multiciliés possédant de nombreux cils, sont plus rares et trouvés uniquement chez certains Mollusques et Annélides. Ils répondent à l'activation du pigment par une augmentation de la conductance au K+, et ne semblent être impliqués que dans les réponses défensives lors de la détection de mouvement ou d'ombre[19].
On voit tout d'abord qu'il existe un nombre relativement faible de types cellulaires de récepteurs photosensibles chez les animaux. Ceci est probablement dû au faible nombre de possibilités pour utiliser les membranes dans la photoréception.
Par ailleurs, tous les photorécepteurs présents dans les yeux animaux semblent être des cellules homologues, et dérivent donc toutes du même type cellulaire ancestral[16]. En effet, tous les photorécepteurs étudiés utilisent des facteurs de différenciation homologues, tel pax6, et des protéines effectrices homologues, telles que l'opsine, la rhodopsine kinase ou l'arrestine. Par ailleurs, si les deux principaux types de récepteurs sont associés préférentiellement à certains taxons, on trouve des récepteurs ciliés et rhabdomériques chez les Protostomiens comme chez les Deutérostomiens. Ceci suggère une différenciation de ces deux types de cellules antérieure à la séparation Deutérostomiens/Protostomiens.
Enfin, même si la plupart des Vertébrés n'ont pas de cellules rhabdomériques, certaines cellules des Deutérostomes semblent être homologues aux cellules rhabdomériques des Protostomes. Ainsi les cellules des ganglions de la rétine, les cellules amacrines et les cellules horizontales seraient trois types cellulaires frères, dérivés du récepteur rhabdomérique ancestral des Deutérostomiens.
Évolution des mécanismes de formation de l'image
Après l'explosion cambrienne, un œil-puits se développe de manière indépendante dans de nombreux taxons animaux ; en effet, on retrouve des yeux-puits dans 28 des 33 embranchements de Métazoaires. Nombre de ces yeux ont alors évolué en structures plus complexes capable de former de réelles images. Cette évolution convergente de fonction est due à l'important avantage sélectif conférée par la formation d'images précises, riches en information. L'évolution convergente a pu être accélérée par la concurrence entre les différents taxons : si un prédateur développe un œil efficace, la pression de sélection augmente sur les proies, et l'avantage sélectif conféré par la formation d'image par la proie n'en devient que plus grand.
L'évolution de l'œil a créé indépendamment différents mécanismes de formation des images. On recense aujourd'hui 10 mécanismes permettant la formation d'images, et la plupart utilisent un système optique (lentille ou miroir). De plus, même si certains systèmes optiques ont évolué de manière unique, certains autres ont évolué de nombreuses fois indépendamment. Ceci s'explique par le faible nombre de possibilités permettant de former une image d'une part, et par les contraintes imposés par le milieu sur le système optique.
On distingue par leur structure (et non par leur origine évolutive) deux grands types d'yeux :
- L'œil camérulaire, ou œil simple, ou encore œil à une seule chambre. Il ne contient qu'une seule cavité tapissée de cellules réceptrices, issue de l'œil-puits ancestral.
- L'œil composé, constitué d'un grand nombre d'yeux élémentaires appelés ommatidies. Chaque ommatidie correspond à un œil-puits ancestral.
On trouve des yeux camérulaires aussi bien que des yeux composés dans la plupart des 6 embranchements animaux ayant développé un œil complexe.
Les yeux camérulaires
L'œil-puits, présent dans la plupart des embranchements, a subi 3 types de transformations au cours de l'évolution, sélectionnées pour l'augmentation de la qualité visuelle qu'elles procurent. Une image peut ainsi être formée soit par filtrage des rayons incidents (diaphragme), soit par réfraction et concentration de la lumière incidente en certains points (lentille), soit par réflexion des rayons après leur traversée des cellules réceptrices (miroir).
L'augmentation de la taille de la coupe formée par les cellules photo-réceptrices couplée à la réduction de l'ouverture à la lumière permet de concentrer les rayons venant d'une même direction sur un nombre restreint de cellules réceptrices, et permet ainsi à l'œil d'analyser la direction de la lumière et de former une image. Un tel œil, appelé œil en trou d'épingle (pinhole eye), a évolué au moins une fois chez les mollusques, et on le retrouve par exemple chez les Haliotis. Chez le Nautile, une forme panchronique de mollusque céphalopode, l'évolution de muscles permettant de stabiliser l'œil pendant la nage et donc stabiliser l'image a évolué en parallèle de l'œil en trou d'épingle. Cependant, ces yeux possèdent des limitations physiques.
En effet, l'augmentation de la résolution nécessite une réduction de l'ouverture donc une diminution de quantité de lumière perçue (sensibilité). Réciproquement, une augmentation de la sensibilité passe par l'augmentation de l'ouverture, et l'image devient alors plus floue. Il semblerait que le plus simple système optique placé au niveau de l'ouverture ait suffi à augmenter les qualités optiques d'un tel œil. Compte tenu du grand nombre d'apparitions convergentes de lentilles dans les yeux animaux, on ne sait toujours pas pourquoi une telle solution n'a pas évolué dans le cas de cet œil.
L'ajout d'un système réfractif (lentille) à un œil-puits ancestral permet de concentrer les rayons issus d'une même direction vers une zone limitée de la couche réceptrice, ce qui permet la formation d'une image. Les premières lentilles apparues sont homogènes et de forme sphérique. De tels systèmes réfractifs ont évolué au moins 8 fois de manière indépendante : chez les Céphalopodes, chez les Vertébrés, chez les Copépodes, et 4 fois indépendantes chez les Gastéropodes[4]. Il existe aujourd'hui une grande diversité de structure et de composition des lentilles chez les animaux, qui sont toutes issues de lentilles sphériques homogènes.
Chez les animaux aquatiques, des lentilles possédant un gradient d'indice de réfraction se sont développées à plusieurs reprises, dans plusieurs embranchements distincts. Ces lentilles sphériques, appelées lentilles de Matthiessen, ont une densité qui décroît en s'éloignant du centre, ce qui a pour conséquence la formation d'un gradient décroissant d'indice de réfraction du centre vers la périphérie. La lumière est ainsi déviée continument en traversant la lentille, et non pas seulement à l'entrée de la lentille comme c'est le cas lorsque la lentille est homogène. Dans le cas d'un gradient de densité particulier, proche d'un gradient parabolique, l'image ainsi formée est corrigée de toute aberration sphérique. Le fait que de telles lentilles aient évolué presque systématiquement chez les animaux aquatiques suggère qu'il n'existe qu'une solution pour corriger l'aberration sphérique en milieu marin, et que cette solution a été sélectionnée à chaque fois par l'évolution.
D'autres solutions, bien moins répandues, ont néanmoins évolué chez certains animaux marins. Elles impliquent en général plusieurs lentilles issues de lentilles sphériques homogènes. Le Crustacé Pontella, par exemple, a développé un système de 3 lentilles superposées, de formes différentes, qui permettent la correction de l'aberration sphérique[20].
L'œil de certains animaux terrestres, tels les Mammifères et les Araignées, possède un système réfractif supplémentaire placé devant la lentille : la cornée. Celle-ci possède alors l'essentiel du pouvoir de réfraction de l'œil (les 2/3 chez l'homme), la lentille jouant essentiellement un rôle dans l'ajustement du point focal (accommodation). L'évolution d'un œil à cornée à partir d'un œil ne possédant qu'une lentille a probablement nécessité une diminution du pouvoir de réfraction de la lentille alors que celui de la cornée augmentait parallèlement. En effet, une telle transition évolutive ne passe par aucune phase contre sélectionnée, qui empêcherait la formation d'un œil à lentille.
La troisième solution évolutive permettant la formation d'une image consiste à placer derrière la couche de cellules réceptrices une couche cellulaire réfléchissante, agissant comme un miroir. La forme sphérique de ce miroir permet là encore de concentrer les rayons lumineux issus d'une direction sur une zone réceptrice limitée, et donc de former une image. Ce miroir est apparu de manière convergente sous forme d'une multi-couche réfléchissante, chez les Rotifères, les Plathelminthes, les Copépodes et certains Mollusques.
Les yeux composés
Les yeux composés sont répandus dans le règne animal, et présentent une importante diversité. On distingue deux grands types de vision. La vision par apposition ... (focale et afocale). La vision par superposition ... (neurale, réfractive, réflective ou parabolique).
Les yeux composés ont probablement évolué plusieurs fois de manière indépendante chez les Annélides, les Arthropodes et chez les Mollusques bivalves de la famille des Arcacae. Ces yeux sont à chaque fois issus d'un œil-puits, à partir duquel se forme un œil composé peu complexe. Cet œil ancestral est formé de cellules réceptrices placées au fond d'un certain nombre de tubes constitués de cellules pigmentées. On retrouve encore cette forme ancestrale chez certaines espèces contemporaines d'Annélides. Cet œil composé aurait alors évolué à chaque fois en un œil capable d'une vision par apposition focale.
L'évolution à partir de cet œil composé ancestral est encore mal connue. Chez les Arthropodes, on distingue trois groupes principaux possédant des yeux à vision par apposition focale, et l'origine évolutive de la vision chez ces groupes reste discutée [21],[22]. La vision par apposition afocale aurait évolué à partir de la vision par apposition focale. Il semblerait par ailleurs que la vision par superposition neurale ait évolué plusieurs fois à partir de cette dernière. Enfin, la vision par superposition parabolique n'a été découverte récemment et reste mal comprise. Son étude pourrait cependant apporter d'importantes informations évolutives, puisque l'œil impliqué combine des structures trouvées dans les yeux à visions par apposition et par superposition.
Un modèle d'évolution de l'œil

La formation de structures complexes par le seul moyen de la sélection naturelle a souvent été mise en doute par les opposants de la théorie de l'évolution, et l'évolution de l'œil est souvent l'exemple emblématique de ce problème. Charles Darwin lui-même reconnaissait la difficulté que posait l'évolution de l'œil pour sa théorie. La difficulté pour expliquer l'évolution de l'œil par la sélection naturelle consiste à trouver une voie évolutive plausible constituée d'une longue succession de légères modifications, chacune d'entre elles devant être avantageuse et donc sélectionnée.
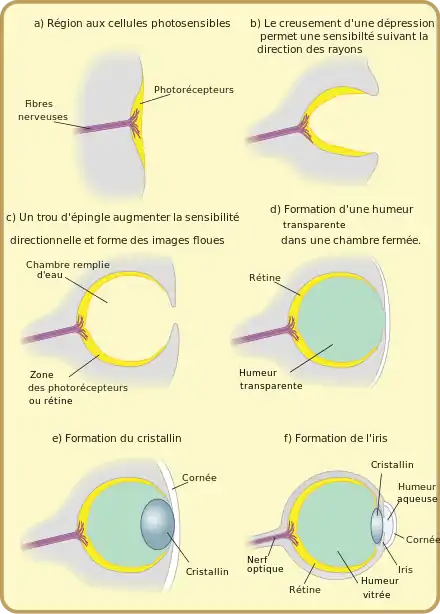
Afin de montrer qu'une telle évolution était possible, et d'estimer le nombre de générations nécessaires à l'évolution d'un œil, Dan Nilsson et Susanne Pelger ont développé en 1994 un modèle d'évolution de l'œil[23]. Pour cela, ils ont imaginé une séquence possible de 8 structures d'œil allant d'une simple couche de cellules photoréceptrices à un œil camérulaire tel qu'on l'observe chez les céphalopodes ou les vertébrés, à partir des lois fondamentales de l'optique, des lois de la sélection naturelle et des exemples réellement observés dans la nature. Ils ont ensuite calculé le nombre de modifications élémentaires nécessaires au passage d'une structure à l'autre. Enfin, ils déduisent de ce calcul le nombre de générations nécessaires à l'évolution d'un œil selon cette séquence et d'après la théorie de la sélection naturelle. En construisant ce modèle pessimiste (la séquence évolutive et toutes les hypothèses de calcul sont choisies de manière à maximiser le nombre de générations), ils estiment qu'il ne faut pas plus de quelques centaines de milliers de générations pour former un œil camérulaire.
Séquence évolutive
La principale difficulté pour estimer le nombre de générations nécessaires à l'évolution d'un œil est le choix de la séquence évolutive suivie. Pour cela, les auteurs ont choisi une séquence de structures cohérentes avec les observations réelles et les apports de l'anatomie comparative, mais ont cherché des structures les plus générales possibles, en essayant d'éviter des structures spécifiques à un taxon particulier. Les auteurs se sont ensuite fondés sur les lois de la sélection naturelle, et ont cherché une fonction sur laquelle la sélection pourrait s'exercer tout au long de la séquence évolutive. Ils ont ainsi choisi de se concentrer sur la résolution spatiale de l'œil. Ce choix permet d'évaluer de manière objective la qualité de chaque structure oculaire, simplement par l'application des lois de l'optique.
La première structure a été choisie comme une lame circulaire de cellules photoréceptrices, coincée en sandwich entre une lame de cellules pigmentées noires au-dessous et une couche transparente protectrice au-dessus. Cette première structure, plausible compte tenu de ce que l'on observer dans la nature, permet de s'affranchir du problème de l'évolution des cellules photoréceptrices, et de ne se consacrer qu'à l'évolution de la structure de l'œil.
Deux types de transformations permettent alors d'améliorer la résolution de cette structure trilaminaire : la courbure de la structure, orientant chaque cellule dans une direction particulière (les différentes cellules sont alors sensibles à des directions différentes), et l'obstruction de l'ouverture par des cellules pigmentées noires. Afin de déterminer dans quel ordre ces transformations ont pu intervenir au cours de l'évolution, Nilsson et Pelger ont étudié l'influence de transformations élémentaires successives des deux types (courbure ou obstruction de l'ouverture) sur la résolution optique. Ils montrent ainsi que la courbure apporte une meilleure amélioration tant que l'œil est moins profond que large.
Par ailleurs, l'obstruction de l'ouverture de l'œil s'accompagne aussi d'une diminution de la quantité de lumière admise. Les cellules photoréceptrices ne réagissant qu'à partir d'une intensité lumineuse donnée, une ouverture trop petite diminue aussi les qualités optiques de la structure. Ainsi, à partir de la théorie de Snyder et Warrant et McIntyre[24], les auteurs montrent qu'il existe une obstruction optimale de l'ouverture de l'œil pour laquelle la résolution obtenue est maximale (pour une intensité extérieure et un diamètre d'œil donné).
Enfin, ils montrent que même une petite augmentation locale d'indice de réfraction du matériau protecteur peut jouer le rôle d'une lentille et améliorer la résolution, et que l'augmentation du pouvoir réfractoire est toujours avantageuse jusqu'à l'obtention d'une lentille optimale d'indice de réfraction de 1,52. De plus, la position optimale de la lentille change en fonction de l'évolution de la forme de l'œil, et la position de la lentille est amenée à évoluer en conséquence.
À partir de ces propriétés sur les mécanismes de la sélection naturelle et de la formation d'une image, Nilsson et Pelger proposent une séquence évolutive de 8 étapes présentée ci-dessous. Lors des étapes 2 et 3, la structure trilaminaire est courbée jusqu'à prendre la forme d'un hémisphère, rempli par la couche protectrice. Les couches photosensible et pigmentée s'agrandissent ensuite lors des étapes 4 et 5 sans que le rayon de courbure de la structure ne change, entraînant ainsi une diminution de la taille du diaphragme. Une lentille est ensuite formée par une augmentation locale de la concentration en protéines dans la couche protectrice (causant une augmentation de l'indice de réfraction). Enfin, la lentille continue de se former lors des étapes 7 et 8 alors que la taille de l'ouverture diminue grâce à une croissance de la couche pigmentée et que la forme de l'œil change. Cette séquence aboutit à un œil camérulaire comme on peut l'observer chez les Vertébrés et les Céphalopodes.
Nombre d'étapes élémentaires nécessaires
Les auteurs calculent ensuite le nombre de modifications élémentaires de 1 % nécessaires à passer d'une structure à l'autre. Ces modifications de 1 % peuvent affecter n'importe quel caractère quantitatif, comme la longueur d'une structure ou la concentration en protéines responsable du changement d'indice de réfraction. Ainsi, il faut 70 étapes de 1 % pour qu'une structure double de taille, puisque . Ainsi, la formation de l'œil par cette séquence évolutive nécessite au total 1829 modifications de 1 %. Par ailleurs, Nilsson et Pelger montrent que la qualité optique de chaque structure est proportionnelle au nombre d'étapes de 1 % nécessaire pour former la structure. Ainsi, il n'existe pas d'étape limitante (c'est-à-dire d'étape nécessitant beaucoup de modifications élémentaires pour une faible augmentation de la résolution spatiale) au cours de leur séquence.
Nombre de générations nécessaires
Nilsson et Pelger utilisent alors la théorie de la sélection naturelle pour calculer le nombre de générations nécessaires à l'évolution d'un œil par cette séquence évolutive. Pour cela, ils se servent de l'équation développée par Falconer en 1989, donnant la relation entre la valeur d'un caractère à une génération donnée, et celle de ce même caractère à la génération suivante: , où est la valeur moyenne du caractère à la génération n, la valeur moyenne du caractère à la génération n+1, l'héritabilité du caractère, l'intensité de la sélection sur ce caractère et le coefficient de variation du caractère.
Les auteurs ont choisi , et des valeurs particulièrement faibles pour le coefficient de variation et l'intensité de sélection afin de maximiser le nombre de générations nécessaires (i=0,01 et ). Ainsi, selon leur modèle, , c'est-à-dire que le caractère change de 0,005 % par génération. Ainsi, si est le nombre de générations nécessaires à former l'œil de l'étape 8, il faut que: , soit .
Critiques
Ces travaux proposent un modèle théorique relatif à l'évolution de la morphologie d'une partie de l'œil. La question de l'évolution forcément concomitante du nerf optique par exemple n'est pas évoquée, ni l'apparition de gènes nouveaux nécessaires à cette évolution.
Conclusion
Ainsi, selon leur modèle volontairement pessimiste, Nilsson et Pelger estiment qu'il faut moins de 400 000 générations pour former un œil camérulaire comme celui des Vertébrés. Les premiers fossiles possédant des yeux datant de 550 millions d'années, l'œil camérulaire a largement eu le temps d'évoluer depuis cette époque. Cependant, l'œil ne peut évoluer comme une structure autonome, et nécessite la présence d'autres structures pour être fonctionnel et apporter un avantage sélectif. Ainsi, le développement du traitement neural de l'information visuelle a pu être un facteur plus limitant que l'évolution de la structure oculaire elle-même. Cette estimation montre ainsi que la structure de l'œil nécessite relativement peu de temps pour évoluer et qu'elle peut répondre rapidement à des modifications des pressions sélectives exercées par le milieu.
Controverses sur l'évolution de l'œil
Plusieurs opposants à la théorie de l'évolution darwinienne, notamment Henri Bergson dans L'évolution créatrice, arguent que certains organes, comme l'œil humain (ou celui du homard), exigent un agencement très précis et concourant de différents éléments pour fonctionner correctement. Ils ne pourraient donc être le résultat d'une évolution progressive par sélection naturelle : une ébauche d'œil ne fonctionnerait pas et ne donnerait pas un avantage sélectif significatif. Arthur Koestler estime même, dans Janus, que cette mutation inutile aurait de fortes chances de se diluer et de disparaitre bien avant que les suivantes n'arrivent pour la compléter.
Bergson s'oppose à Darwin sur un point : la réductibilité du phénomène vivant à une explication mécaniste, surtout pour des raisons épistémologiques liées à la fonction de notre intelligence ; celle-ci, dans une perspective pragmatique, vise l'action et constitue elle-même un outil d'adaptation. Le modèle établi par Darwin, selon lui conséquence de notre faculté de connaître, resterait encore insuffisant et exigerait une explication philosophique et intuitive de l'évolution. L'existence même d'une évolution n'est jamais remise en cause par Bergson ni par Koestler, mais tous deux insistent sur le fait que si son rôle d'élimination est indiscutable, son apport explicatif à des successions d'innovations en cascade reste problématique même sur les durées considérées, essentiellement pour des raisons de dilution de mutations qui, isolées, resteraient sans effet.
En fait, un organe photosensible même élémentaire, capable par exemple de simplement distinguer le jour de la nuit ou le passage d'une ombre, d'un prédateur ou d'un proie potentielle, procure un avantage sélectif suffisant[25] pour qu'on puisse envisager qu'il s'impose rapidement. De là à obtenir un organe beaucoup plus complexe tel que l'œil des vertébrés, le nombre d'étapes est certes considérable et demande une coordination des modifications de plusieurs organes adjacents, mais chaque amélioration accentuera l'avantage sélectif et s'imposera.
Des travaux montrent que l'apparition d'un œil complexe peut être en fait très rapide. En effet, Nilsson et Pelger montrent en 1994 que, sous des hypothèses particulièrement pessimistes, 400 000 générations suffisent à former un œil camérulaire (comme celui des Vertébrés) selon les modèles prédits par la théorie de l'évolution[26].
Le fait que la rétine des céphalopodes et celle des vertébrés ne soit pas « montée » dans le même sens montre que les yeux de ces deux groupes ne sont pas homologues et se sont développés par des voies différentes. Ce montage à l'envers, considéré comme une imperfection chez les vertébrés, est présenté par Richard Dawkins[27] comme une preuve de l'imperfection de l'œil des vertébrés, et donc du fait que ce dernier ne résulte pas de l'application d'un plan préétabli mais au contraire d'adaptations successives, comme un argument contre le créationnisme et le dessein intelligent.
Certaines considérations pourraient montrer ce montage inverse de la rétine des vertébrés comme une imperfection : existence d'un point aveugle, rétine moins attachée au fond de l'œil (?), lumière filtrée par la rétine avant les récepteurs...
Néanmoins, certaines de ces caractéristiques « néfastes » ont été minimisées : comme le point aveugle dont l'étendue a été réduite, une liaison plus forte avec le fond de l'œil (?) Ou bien même, peut être utilisée(s) comme avantage(s) dans certaines circonstances : comme le pouvoir filtrant de la couche rétinienne.
Notes et références
- M.F. Land & D.E. Nilsson, Animal Eyes, Oxford University Press,
- W.J. Gehring & K. Ikeo, « Pax6: Mastering eye morphogenesis and eye evolution », Trends in Genetics, vol. 15, , p. 371-377
- (en) J.N. Lythgoe, The Ecology of Vision, Oxford: Clarendon Press,
- M.F. Land et R.D. Fernald, « The Evolution of Eyes », Annual Review of Neurosciences, vol. 15, , p. 1-29
- R.D. Fernald, « Evolution of Eyes », Current Opinion in Neurobiology, vol. 10, , p. 444-450
- A. Packard, « Cephalopods and fish: the limits of convergence », Bio. Rev., vol. 47, , p. 241-307
- R.D. Fernald, « Evolving eyes », Int. J. Dev. Biol., vol. 48, , p. 701-705
- (en) Liqun Luo, Principles of Neurobiology, Garland Science, , p. 534.
- L.V. Salvini-Plawen & E. Mayr, « Evolution of photoreceptors and eyes », Evol. Biol, vol. 10, , p. 207-263
- S. Yokoyama, « Molecular Évolution Of Vertebrate Visual Pigments », Progress in Retinal and Eye Research, vol. 19, no 4, , p. 385-419
- S. Yokoyama, « Evolution of Dim-Light and Color Vision Pigments », Annual Review of Genomics and Human Genetics, vol. 9, , p. 259-282
- A.G. Palacios, F.J. Parela, R. Srivastava & T.J. Goldsmith, « Spectral sensitivity of cones in the goldfish, Carassius auratus », Vision Research, vol. 38, , p. 2135-2146
- J.K. Bowmaker & A. Knowles, « The visual pigments and oil droplets of the chicken retina », Vision Research, vol. 17, , p. 755-764
- Seki T. & Vogt K., « Evolutionnary aspects of of the diversity of visual pigment chromophores in the class Insecta », Comp. Biochem. Physiol. B, vol. 119, , p. 53-64
- (en) Adriana D. Briscoe et Lars Chittka, « The evolution of color vision in inects », Annual Review of Entomology, vol. 46, , p. 471-510 (ISSN 0066-4170, résumé)
- D. Arendt, « Evolution of eyes and photoreceptor cell types », International Journal of Developmental Biology, vol. 47, , p. 563-571
- K.W. Yau & D.A. Baylor, « Cyclic GMP-activated conductance of retinal photoreceptor cells », Annu. Rev. Neurosci., vol. 12, , p. 289-327
- M.G.F. Fuortes œ P.M. O'Bryan, « Generators potentials in invertebrate photoreceptors », Handbook of Sensory Physiology, , p. 321-338
- M.F. Land, « Functional aspects of the optical and retinal organization of the mollusc eye », Symp. Zool. Soc. London, vol. 23, , p. 75-96
- (en) M.A. Ali, Photoreception and Vision in Invertebrates, New York: Plenum, , p. 401-438
- (en) S.M. Manton & D.T. Anderson, The Origin of Major Invertebrate Groups, London: Academic, , « Polyphyly and the evolution of arthropods », p. 269-321
- (en) H.F. Paulus, Arthropod phylogeny, New York: Van Nostrand Reinhold, , « Eye structure and the monophyly of arthropoda », p. 299-383
- (en) D.E. Nilsson et S. Pelger, « A pessimistic estimate of the time required for an eye to evolve », Proc. R. Soc. Lond. B, vol. 256, , p. 53-58
- (en) E.J. Warrant et P.D. McIntyre, « Arthropod eye design and the pysical limits to spatial resolving power », Progresss in Neurobiology, vol. 40, no 4, , p. 413-461 (ISSN 0301-0082)
- Dans certaines circonstances, comme celles du Cambrien.
- Nilsson & Pelger, A pessimistic estimate of the time required for an eye to evolve.Proc. Biol. Sci .1994 Apr 22;256(1345):53-8
- L'Horloger Aveugle, 1986.
Voir aussi
Bibliographie
- Jean Deutsch, La méduse qui fait de l'œil et autres merveilles de l'évolution, Le Seuil, 2017
- « L’épopée de l’œil, une ode à la diversité du vivant », Le Monde, (lire en ligne, consulté le )
- « Sur l'évolution de la vision chez les Vertébrés. »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- (en) Russell D Fernald, « Evolution of eyes », Current Opinion in Neurobiology, vol. 10, no 4, , p. 444–450 (ISSN 0959-4388, DOI 10.1016/S0959-4388(00)00114-8, lire en ligne, consulté le )
Articles connexes
- Théorie synthétique de l'évolution
- Œil
- Développement de l'œil des vertébrés
- Vision des oiseaux
- Vision de l'insecte
- Portail origine et évolution du vivant
- Portail de l’œil et de la vue