Céphalopode
Cephalopoda

| Règne | Animalia |
|---|---|
| Sous-règne | Bilateria |
| Infra-règne | Protostomia |
| Super-embr. | Lophozoa |
| Embranchement | Mollusca |
Sous-classes de rang inférieur
Les céphalopodes (Cephalopoda, du grec ancien κεφαλή / képhalé, « tête », et πούς / pous, « pied ») sont une classe de mollusques apparus à la fin du Cambrien (500 millions d'années) dont la tête est munie de tentacules, appelés aussi bras. Ce nom générique inclut notamment les pieuvres, calmars et seiches (groupe des coléoïdes), et les nautiles (groupe des nautiloïdes). Environ 800 espèces vivantes sont connues et de nouvelles espèces continuent d'être décrites. Environ 11 000 taxons éteints ont été décrits, bien que le corps mou des céphalopodes ne facilite pas la fossilisation. Cephalopoda est un clade[2], présentant comme synapomorphie la plus évidente la présence de tentacules préhensiles. Leur tête, distincte de la masse viscérale, comporte un véritable cerveau contenu dans un crâne cartilagineux, des yeux perfectionnés, un bec chitineux, etc. Elle est munie d'une couronne péribuccale de bras musclés et protractiles munis de ventouses et/ou de crochets. Le manteau ventral, contractile, constitue avec le siphon un puissant organe de locomotion. Leur taille varie de quelques centimètres à une dizaine de mètres. Les céphalopodes actuels sont des prédateurs marins : ils se nourrissent de mollusques, de poissons, et de crustacés. Ils capturent leurs proies avec leurs bras, et les déchiquettent avec leur bec corné.
Depuis l'Antiquité romaine, des céphalopodes sont utilisés en cuisine pour leur goût et leurs apports nutritionnels par les populations du littoral méditerranéen. Leur pêche commerciale se renforce. Leur croissance rapide, leur prolificité et leur dynamique de population depuis les années 1950 leur permettent - avec les méduses - de faire partie des quelques taxons qui semblent le mieux s'adapter à la dégradation des milieux marins, au détriment d'autres espèces[3].
La teuthologie est la branche des sciences naturelles qui étudie les céphalopodes du point de vue phylogénétique.
Description
Tête
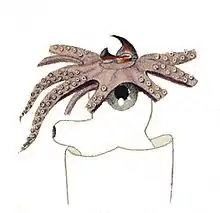
L'organisation anatomique des céphalopodes est marquée par la présence :
- d'un entonnoir dérivant du pied des mollusques servant à la locomotion et à l'irrigation,
- de bras portant des ventouses entourant la bouche et formant une couronne de tentacules,
- d'une paire de mâchoires cornées qui se fossilisent parfois (ce sont les aptychus) ou d'un opercule.
- d'yeux performants.
- suivant les groupes, d'une coquille à chambre et siphon, d'une coquille interne parfois réduite à une plume chitineuse ou encore d'aucune ossature (comme pour les poulpes).
Leur coquille, quand ils en possèdent une, est composée d'une partie cloisonnée dite phragmocône.
La tête est pourvue d'un orifice buccal avec un bec et une radula avec des glandes salivaires. Un crâne cartilagineux solide[réf. souhaitée] renferme un cerveau très complexe, et donne attache aux muscles des bras et du dos.
Le bec chitineux est formé de deux mandibules. Il ressemble à ceux des Psittaciformes mais la partie inférieure chevauche la partie supérieure. Bien qu'extrêmement dur à son extrémité tranchante, il a aussi la propriété d'être élastique, parce que le matériau qui le constitue est moins rigide près des tissus musculaires. Cette variation de rigidité est fonction de rapports différents en chitine, en eau, en une molécule nommée DOPA et en protéines enrichies en histidine, un acide aminé[4]. Le bord tranchant contient également du carbonate de calcium. La forme et la taille des becs de calmars sont spécifiques à chaque espèce.
Les céphalopodes possèdent une vision binoculaire avec des yeux de chaque côté de la tête, la plupart du temps assez grands. Ces yeux sont assez proches de ceux des vertébrés mais le processus évolutif qui les a fait apparaître est différent de celui qui a eu lieu chez les vertébrés. La structure interne est différente, la rétine et le nerf optique sont externes : les céphalopodes n'ont donc pas de points aveugles. Chaque œil contient un cristallin dur. L'accommodation est réalisée par le déplacement de ce cristallin, qui se déplace comme la lentille d'une caméra ou d'un télescope, au lieu de se contracter comme celui de l'œil humain. Leurs yeux sont « renversés », c'est-à-dire que les cellules de la rétine sont tournées vers la source lumineuse[5].
Les céphalopodes perçoivent les sons grâce à leurs statocystes. Le système nerveux est extrêmement condensé. De la fusion des ganglions cérébroïdes, palléaux et pédieux résulte un véritable cerveau, d'où partent la plupart des nerfs. Il révèle une céphalisation poussée et les capacités de résolution de problèmes observées chez les poulpes, par exemple, sont étonnantes.
Appendices céphaliques
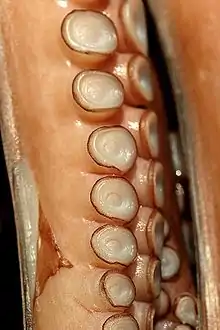

Leur tête est munie d'une couronne péribuccale de bras qui servent à la capture des proies, à l'accouplement et à la reptation sur le sol. Les bras sont réunis à leur base par une membrane, mais elle reste discrète chez le calmar contrairement à d'autres céphalopodes comme les pieuvres[5] (le calmar à ombrelle fait exception).
Les Decabrachia, c'est-à-dire des céphalopodes à dix bras, ont généralement huit bras fonctionnant par paire et deux longs tentacules, aussi appelés « fouets » et aux extrémités plus larges appelées « massues ». On peut en compter huit chez les Octobrachia. Les membres des nautiles (Nautiloidea), qui sont au nombre d'environ 90 et dépourvus totalement de ventouses, sont appelés tentacules. Il existe des exceptions, les espèces de la famille des octopoteuthidés (Decabrachia), comme leur nom l'indique, ne possèdent que 8 bras ; c'est au cours de leur maturation sexuelle que les juvéniles voient leurs deux longs tentacules régresser.
Le volume des bras reste constant : en contractant les muscles circulaires le rayon diminue, permettant l'augmentation rapide de la longueur. Généralement, un allongement de 70 % est obtenu en diminuant légèrement la largeur de 23 %[6]. Chez les plus grandes espèces, ils sont bordés, à l'extrémité, de deux rangées de crochets pivotants très acérés. Plus la proie se débat, plus les crochets s’enfoncent dans sa chair[7]. Une membrane de protection autour des crochets, sur les tentacules et les bras, empêche l'animal de s’auto-mutiler.
Ces appendices sont parfois porteurs de ventouses (ce n'est pas le cas des nautiles), qui les recouvrent plus ou moins complètement, et sont disposées en rangées. Chaque ventouse est un instrument perfectionné qui s'applique sur sa cible. Un organe fonctionnant comme un piston fait le vide à l'intérieur, assurant l'adhésion. Ces ventouses peuvent être surmontées d'un anneau corné qui améliore encore leur adhérence. Dans certains genres, l'anneau est renforcé par des petites dents et des crochets tranchants lui permettant d'avoir une meilleure prise sur sa proie. Les ventouses sont indépendantes les unes des autres ; les bras et les tentacules ont une grosse fibre nerveuse centrale (très épaisse pour permettre à chaque ventouse d'être contrôlée de manière indépendante) entourée de muscles circulaires et radiaux.
Manteau
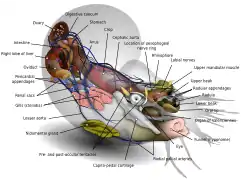
Le manteau prend de nombreuses formes et textures : en forme de fuseau (calmar), en forme de bourse (octopodes) ou de spirale (nautile). Il contient une forte cavité renfermant des branchies complexes, et dans laquelle s'ouvrent les organes reproducteurs, urinaires, et l'anus. La masse des viscères y est adossée.
Une grande partie de l'organisme est contenue dans le manteau, doté de deux nageoires latérales chez les petits calmars tels que ceux du genre Loligo ou bien d'une seule grande nageoire sommitale comme chez les calmars géants[8], voire une paire d'ailettes latérales comme chez Grimalditeuthis bonplandi ou une deuxième nageoire, foliacée, au bout du pédoncule caudal comme pour le juvénile de Chiroteuthis veranyi[9].
Ce manteau en forme de fuseau contient une vaste cavité, la cavité palléale, où se trouve la masse viscérale qui comprend les principaux organes internes ; cette cavité est recouverte par un mince épiderme membraneux. C'est à l'intérieur de cette cavité que les branchies effectuent leurs échanges gazeux, mais aussi que les organes reproducteurs, urinaires, et digestifs déversent leurs productions (gamètes, urine, excréments)[6].
La peau, qui recouvre le corps entier, forme un repli qui limite la cavité branchiale (les nautiloïdes sont tétrabranchiaux, 4 branchies, et les coléoïdes sont dibranchiaux, 2 branchies) : c'est le « manteau ». Elle est entièrement couverte d'organes colorés (chromatophores) qui, sous l'action du cerveau, permettent aux céphalopodes de changer brusquement de couleur, voire de texture de peau pour exprimer des « sentiments » et/ou mieux se fondre dans leur environnement (camouflage). Au-dessus des cellules pigmentées existent des cellules irisées, qui réfléchissent la lumière. Ces capacités de camouflage adaptatif (dynamique[10]) que sont une source d'inspiration pour le biomimétisme et la robotique molle[11].
Ces animaux sont très forts, et de grands nageurs. La musculature du corps et des tentacules est très puissante. Chez les coléoïdes, les octopodes n'ont pas de nageoires et rampent, contrairement aux décapodes qui en possèdent une (triangulaire en position antérieur pour le calmar et tout autour du corps pour les seiches). La présence, la régression ou l'absence de coquille est une raison pour laquelle ils nagent mieux que le reste des mollusques. Les nautiloïdes possèdent une coquille qui les handicapent dans leurs déplacements. Par contre, chez les coléoïdes, les décapodes possèdent une coquille interne en position dorsale, mais les octopodes eux sont sans coquille.
Leur cœur est très perfectionné. La circulation est elle-même assez perfectionnée. Il y a des artères, des veines, des capillaires. Le système n'est pas totalement fermé, mais une partie du sang seulement passe par des lacunes, avant de revenir au cœur. Le sang est teinté de bleu par de l'hémocyanine, substance à base de cuivre qui joue un rôle analogue à l'hémoglobine pour le transport de l'oxygène.
Les céphalopodes ont deux cœurs branchiaux et un cœur systémique. Les deux premiers propulsent le sang vers les branchies pour qu'il se charge en dioxygène, alors que le cœur systémique distribue le sang oxygéné au reste du corps. Le cœur systémique est composé de trois chambres, un ventricule inférieur et deux oreillettes supérieures. Le sang des céphalopodes est de couleur bleue car il contient de l'hémocyanine dont le fonctionnement repose sur la chimie du cuivre et de l'oxygène, et non pas de l'hémoglobine comme les vertébrés qui elle repose sur la chimie du fer et de l'oxygène. Les cœurs, légèrement verdâtres, sont entourés par les sacs rénaux, c'est-à-dire le système excréteur principal. Les reins sont difficiles à identifier, ils s'étendent du cœur (situé sur la face postérieure de la poche du noir) jusqu'à l'organe analogue au foie.
Ils ont un gros foie, un pancréas, un intestin complexe, des reins très développés.
Coloration


Les céphalopodes peuvent changer de couleur et de motif en quelques millisecondes, que ce soit pour le signalement (tant au sein de l'espèce que pour avertir les prédateurs) ou le camouflage actif, à mesure que leurs chromatophores se développent ou se contractent. Bien que les changements de couleur semblent dépendre principalement de la vision, il existe des preuves que les cellules de la peau, en particulier les chromatophores, peuvent détecter la lumière et s’adapter aux conditions de luminosité indépendamment des yeux. La coloration est généralement plus forte chez les espèces côtières que chez celles vivant en haute mer, dont les fonctions ont tendance à se limiter à un camouflage. La plupart des pieuvres imitent certaines structures dans leur champ de vision plutôt que d'imiter les couleurs de leur environnement.
Des traces de coloration d'origine ont été détectées dans des fossiles de céphalopodes datant du Silurien; ces individus orthoconiques portaient des bandes concentriques, qui auraient servi de camouflage. Les céphalopodes du Dévonien portent des motifs colorés plus complexes, de fonction inconnue.
Coquille
Comme la plupart des mollusques, les céphalopodes n'ont pas de squelette mais une coquille formée à partir de l'ectoderme (couche externe de l'embryon) et composée de carbonate de calcium. Dans le cas des coléoïdes la coquille a évolué vers une structure interne rigide (« plume » des calmars, « os » de seiches...). La minéralisation plus ou moins intense de la coquille, par formation de carbonate, est en relation avec l'acidité de la matrice organique de la coquille ; la coquille des nautiles a une matrice acide, tandis que la plume des calmars a une matrice moins acide, voire basique.
Cas des nautiloïdes
Les nautiles sont les seuls céphalopodes existant avec une vraie coquille externe. Elle est cloisonnée, parcourue par un siphon, et entoure le corps.
Cas des coléoïdes
Chez les coléoïdes c'est une invagination de l'ectoderme qui conduit à une « coquille interne » lovée dans le manteau. Cette coquille interne est donc une structure rigide pouvant faire penser à un os, et d'ailleurs couramment appelée os de seiche dans le cas de Sepia.
Sa forme est différente pour chaque espèce de coléoïdes, et c'est souvent cette forme qui permet de déterminer l'espèce d'un spécimen :
- celle des calmars ou de certains octopodes, appelée plume ou gladius (glaive en latin), constituée de chitine et de carbonate, est plutôt allongée et semi-transparente. Elle a l'aspect d'une règle de section circulaire en plastique ou d'une plume d'oiseau, d'où son nom ;
- celle des seiches (ou Sepiida), plus large et d'une forme caractéristique, est appelée sépion ou simplement os de seiche. Assez légère, elle sert aussi de flotteur ;
- les Cirrates possèdent, pour leurs nageoires en forme d'arc, un cartilage interne qui est parfois considérés comme un "vestige de coquille" ;
- les poulpes sont soit pourvus d'une paire de tige en forme de stylet, soit dépourvus de coquille ; certains calmars en sont aussi dépourvus ; une telle disparition de coquilles est probablement due à une résorption du carbonate de calcium.
- les spirules possèdent une coquille enroulée analogue à celle des Nautiles, mais interne. Elle se forme d'abord comme une structure organique, puis est ensuite très rapidement minéralisée ;
- la femelle argonaute sécrète une mince coquille spécialisée dans laquelle elle réside, elle est populairement considérée comme une « coquille », même si elle n'est pas attachée au corps de l'animal.
Cas des ammonoïdes

Le plus grand groupe de céphalopodes à coquilles sont les ammonites, un groupe aujourd'hui éteint, mais leurs coquilles sont très fréquentes sous forme de fossiles.
Siphon
Entre la tête et le corps se trouve un organe tubulaire, le siphon, qui permet d'évacuer l'eau de la cavité palléale et de nager à reculons, par propulsion à réaction.
Le manteau a des contractions rythmiques et très énergiques. Chaque fois qu'il se dilate, l'eau entre par l'ouverture de la poche. À chaque contraction, elle est chassée brusquement par l'entonnoir. Il en résulte un déplacement de l'animal en sens contraire du courant d'eau. Sous le siphon s'ouvre une glande qui secrète du noir, quelques gouttes suffisent à troubler l'eau autour du céphalopode, et lui permettre de s'échapper, en combinant cette action avec la transformation de sa coloration par le jeu des chromatophores.
Reproduction

Les sexes sont séparés. La reproduction chez les céphalopodes est aussi très perfectionnée.
Chez le mâle, un ou deux bras sont modifiés et permettent l'accouplement (hectocotyle). Les spermatozoïdes sont regroupés dans des sacs, ou spermatophores, que le mâle saisit avec un de ses bras et introduit dans la cavité palléale de la femelle. Parfois, le bras copulateur se détache dans l'opération, ce qui l'a fait prendre par les anciens naturalistes pour un ver parasite.
Les œufs sont gros, et riches en vitellus (œufs télolécithes). Le plus souvent, ils sont pondus réunis en pontes glaireuses ou en grappes noires (seiches), ce que l'on appelle les "raisins de mer". Chez l'argonaute, la femelle sécrète une nacelle calcaire pour les contenir.
La segmentation de l'œuf est partielle. Le développement est direct.
Écologie et comportement
Intelligence

Les céphalopodes sont considérés comme les plus intelligents des invertébrés, ils ont des sens développés et un gros cerveau (plus grand que celui des gastéropodes). Le système nerveux des céphalopodes est le plus complexe des invertébrés et leur cerveau bien développé a une masse corporelle qui se situe entre celui des vertébrés ectothermes et endothermiques. Le cerveau est protégé dans un crâne cartilagineux. Les fibres nerveuses géantes du manteau de céphalopodes sont utilisés depuis de nombreuses années comme matériel expérimental en neurophysiologie ; leur grand diamètre (en raison de l'absence de la myélinisation) les rend relativement faciles à étudier par rapport à d'autres animaux.
Les céphalopodes sont des créatures sociales ; lorsqu'ils sont isolés de leur propre espèce, ils rejoignent parfois des bancs.
Alimentation
Les céphalopodes sont en général des chasseurs efficaces et rapides, soit de poissons (pour les espèces pélagiques) soit de crustacés et de mollusques (pour les espèces épibenthiques, notamment les poulpes). Leur bec puissant permet de briser les éventuelles coquilles de ces proies, et les bras de les déloger de leur cachette et de les maintenir.
Locomotion

La plupart des céphalopodes peuvent se déplacer avec une propulsion par réaction, un mode de locomotion très énergivore par rapport à la locomotion d'ondulation utilisée par les poissons. L'efficacité d'un jet d'eau produit avec une hélice étant plus efficace que celui de la fusée. Plus la taille des animaux augmente, plus l'efficacité relative de la propulsion par jets diminue. La propulsion des larves est donc beaucoup plus efficace que celle des individus juvéniles et adultes. Depuis l'ère paléozoïque, la concurrence avec les poissons a produit un environnement où une locomotion efficace était essentielle à la survie, la propulsion par jets fit un retour, avec des nageoires et des bras utilisés pour maintenir une vitesse constante. La propulsion par réaction n'a jamais été leur seul mode de locomotion : le mouvement d'arrêt-démarrage fourni par la propulsion permet d'atteindre rapidement des pointes de grande vitesse - pour éviter les assauts des prédateurs ou capturer des proies. En effet, les céphalopodes sont les invertébrés marins les plus rapides : ils peuvent ainsi semer la plupart des poissons. Le jet est complété avec un mouvement des nageoires. Chez le calmar, les nageoires battent chaque fois qu'un jet est libéré afin d'amplifier la poussée ; elles sont ensuite étendues entre chaque jet, probablement pour éviter de dévier. L'eau oxygénée est aspirée dans la cavité du manteau, elle passe par les branchies avec la contraction musculaire de cette cavité, l'eau est ensuite expulsé par le siphon, créé par un pli du manteau. La différence de taille entre la partie postérieure et antérieure permet à l'organisme de produire un jet sous haute pression. La vitesse de l'organisme peut être calculée avec précision en fonction de la masse et de la morphologie de l'animal donné. Le mouvement des céphalopodes va généralement vers l'arrière, en propulsant l'eau en avant par le siphon, mais la direction peut être contrôlée en le pointant dans des directions différentes. Certains céphalopodes accompagnent cette expulsion de l'eau avec un bruit d'éclatement pour effrayer les prédateurs potentiels.
Les céphalopodes utilisent une méthode similaire à la propulsion en dépit de leur taille croissante (à mesure qu'ils grandissent) changeant la dynamique de l'eau dans laquelle ils se trouvent. Ainsi leurs paralarves n'utilisent pas beaucoup leurs ailerons (qui sont moins efficaces à faibles nombres de Reynolds) et utilisent principalement leurs jets pour se propulser vers le haut, tandis que les grandes céphalopodes adultes ont tendance à nager moins efficacement et avec plus de dépendance à l'égard de leurs nageoires.

On pense que les premiers céphalopodes produisaient des jets en rentrant leur corps dans leur coquille, comme les nautiles actuels. Les nautiles sont également capables de créer un jet par ondulation de leur siphon ; ce flux lent de l'eau est plus adapté à l'extraction de l'oxygène de l'eau. Le jet des nautiles est beaucoup plus lent que celui des coléoïdes, mais moins de force musculaire et d'énergie sont nécessaires à sa production. La force du jet chez les céphalopodes est commandé principalement par le diamètre maximal de l'orifice du siphon (ou peut-être, le diamètre moyen du siphon) et par le diamètre de la cavité du manteau. Les variations de la taille de l'orifice sont utilisés tout au plus aux vitesses intermédiaires. La vitesse absolue obtenue est limitée par la nécessité d'inhaler de l'eau pour ensuite l'expulser. Cette vitesse maximale correspond à huit fois la longueur de leur corps par seconde, une vitesse que peuvent atteindre la plupart des céphalopodes après deux coups de siphon. L'eau remplit la cavité en entrant non seulement par les orifices, mais aussi par le siphon lui-même. Les calmars peuvent expulser jusqu'à 94 % du fluide contenu dans leur cavité dans un seul coup de jet . Pour s'adapter aux changements rapides de la pression de l'eau et l'expulsion, les orifices sont très flexibles et peuvent modifier leur taille par un facteur de vingt. Le rayon du siphon, au contraire, ne change que d'un facteur de l'ordre de 1,5.
Certaines espèces de poulpes sont également capables de marcher sur le plancher océanique. Les calmars et les seiches peuvent se déplacer sur de courtes distances dans n'importe quelle direction par l'ondulation d'un lambeau du muscle autour du manteau.
La plupart des céphalopodes flottent dans la colonne d'eau avec une flottabilité neutre ou presque, environ 2-3 % plus dense que l'eau de mer. Ils y parviennent de différentes manières. Certains, comme les nautiles, émettent un gaz dans l'écart entre le manteau et la coquille, d'autres font suinter de l'eau douce de leurs reins, évacuant l'eau salée plus dense de la cavité du corps ; d'autres, comme certains poissons, accumulent des huiles dans leur foie et quelques pieuvres ont un corps gélatineux avec des ions de chlore légers remplaçant le sulfate de leur corps.
Certains céphalopodes sont capables de voler dans les airs sur des distances allant jusqu'à 50 m. Alors que les céphalopodes ne sont pas particulièrement aérodynamiques, ils atteignent ces distances impressionnantes par propulsion par jets ; l'eau continue d'être expulsée du siphon propulsant l'organisme dans les airs. Les animaux déploient leurs nageoires et les tentacules pour former des ailes et contrôler activement leur force de portance avec la posture du corps. Une espèce a été observée avec un film de mucus entre ses bras déployés tandis que l'autre a été observée mettre les tentacules dans une disposition circulaire.
Répartition et habitat


Droite : Benthoctopus sp. sur le Mont Davidson à 2422 m de profondeur
Les céphalopodes vivent dans tous les océans de la Terre. Aucun d'eux ne peut tolérer l'eau douce, hormis le calmar court, vivant dans la baie de Chesapeake, qui fait figure d'exception puisqu'il tolère l'eau saumâtre. Les céphalopodes occupent presque toutes les niches écologiques océaniques : allant de la plaine abyssale à la surface de l'océan, du littoral à la haute mer. Leur diversité est plus riche près de l'équateur (~ 40 espèces récupérées dans les filets à 11 ° N par une étude de la diversité) et diminue vers les pôles (~ 5 espèces capturées à 60 ° N).
État des populations dans le monde
Beaucoup de céphalopodes semblent faire partie des rares espèces marines qui s'adaptent rapidement à l'anthropisation des océans et aux changements globaux associés. Il semble que partout où les humains ont modifié l'environnement marin les céphalopodes en profitent, au détriment d’autres espèces. Ils seraient actuellement parmi les animaux les plus adaptés pour survivre dans un océan en proie au réchauffement, à l’eutrophisation, à l’acidification des océans, à l’appauvrissement en poissons[12] à la suite des activités humaines[13],[14].
Une analyse de 60 ans de données provenant d'inventaires de la biodiversité et des ressources halieutiques, et de statistiques jugées fiables sur la pêche dans le monde, publiée en mai 2016 dans « Current Biology » confirme que les captures de céphalopodes ont proportionnellement augmenté dans le monde depuis les années 1950, et plus encore depuis la fin des années 1990, et pas uniquement pour les espèces pélagiques comme le calmar de Humboldt (Dosidicus gigas)[3]. Les chercheurs ont vérifié qu’il ne s’agit pas uniquement d’un effet de changement de pratiques et techniques de pêche par exemple dû au recul de la ressource halieutique piscicole, à une évolution de la demande des consommateurs ou aux prix du fioul. Des espèces côtières (dont la seiche Sepia elegans) en profitent aussi[3].
Une explication pourrait être que les céphalopodes sont (comme les rongeurs sur terre, ou les pigeons en ville) très adaptables aux changements de leur environnement, peut-être grâce à leur cycle rapide de reproduction (la plupart des espèces ne vivent qu’un ou deux ans et meurent après la reproduction, ce qui favorise une sélection naturelle et une adaptation génétique rapide). Les scientifiques supputent que la surpêche est en partie responsable, car elle a fait fortement régresser des poissons prédateurs qui se nourrissent de céphalopodes, de leurs larves, ou qui étaient en concurrence alimentaire avec eux. Les vides écologiques ainsi créés par l’Humain dans la chaîne alimentaire, les réseaux trophiques et les niches écologiques marines sont alors « remplis » par des espèces ubiquistes et adaptables (et les céphalopodes en font partie[15]).
Le réchauffement des océans accélère en outre leur croissance (déjà parmi les plus rapides du monde animal), mais tant que leur amplitude thermique optimale n'est pas dépassée, et tant que la nourriture n'est pas limitée. N'ayant pas de squelette, ils ont une croissance plus rapide et moins besoin du calcium qui devient difficile à trouver dans les zones en cours d’acidification.
Même si plusieurs pêcheries de céphalopodes montrent des signes de surexploitation, l'explosion globale de leurs populations (pourtant très recherchées par la pêche industrielle dans le cas du calmar) a et aura encore des effets considérables sur l'océan, notamment car ce sont des espèces voraces (consommant 30 % de leur poids corporel chaque jour à l'âge adulte, selon Pecl[16], et volontiers cannibales quand la nourriture manque).
Les pêcheries, confrontées au recul des poissons dans l'océan, y compris en zone profonde cherchent depuis plusieurs années à reconcentrer leurs efforts sur de nouvelles ressources (dont via l'aquaculture et la pêche d'invertébrés)... avec quels nouveaux impacts immédiats et différés ? s'interrogent les prospectivistes et scientifiques dont certains plaident pour une gestion adéquate basée sur un suivi scientifique attentif[17].
Systématique
Classification
Les céphalopodes sont des mollusques marins dont certains ont pu faire partie, à des époques géologiques variées, des principaux prédateurs des océans.
La classe des céphalopodes se subdivise en trois groupes (dont deux seulement subsistent à nos jours)[18] :
- la sous-classe des Nautiloïdes, avec quelques espèces (apparue au Cambrien),
- la sous-classe des Ammonoïdes (apparu au Dévonien - s'est éteinte au Crétacé supérieur),
- la sous-classe des Coléoïdes, qui comprend les calmars, les seiches, les octopodes et les vampires des abysses avec plus de 700 espèces. (apparu au Dévonien).
On peut remarquer que les coléoïdes à coquilles ne forment pas un clade ni même un groupe paraphylétique (voir à ce sujet, dans la section Coquille ci-dessus, quelles sont les espèces qui sont dépourvues de coquille).
- Les types d'organisation présentés ici sont des grades évolutifs ne correspondant généralement pas à des groupes monophylétiques, mais paraphylétiques (ne comportant pas tous les descendants d'un même ancêtre — exemple : les descendants d'ancêtres vermiformes ne sont pas tous aujourd'hui des vers, etc.).
- En jaune : les principales explosions radiatives.
Taxinomie

|
Selon World Register of Marine Species (23 décembre 2013)[18] : ...
|
Selon ITIS (23 décembre 2013)[19] :
|

 Octopodes (« poulpes »)
Octopodes (« poulpes »)
.jpg.webp)


Origine, évolution et paléontologie


Les plus vieux céphalopodes connus ont été trouvés dans des strates chinoises vieilles de 515 millions d'années (Cambrien) : ce sont des mollusques allongés et pourvus d'une coquille conique. Les nautiloïdes (groupe actuel le plus dérivé) auraient divergé des autres groupes de céphalopodes (les Bactritida, qui sont sans doute le groupe ancêtre de tous les autres céphalopodes actuels) environ au Dévonien (419,2 ±3,2 à 358,9 ±0,4)[20].
Le registre fossile paléozoïque est complexe, car si certains groupes présentent un excellent potentiel de fossilisation (notamment les ammonites), d'autres ont un corps essentiellement mou et ne laissent donc que très peu de traces après leur mort (en particulier les pieuvres), ce qui biaise énormément le registre et laisse de larges parts d'ombre[20].
Leur coquille est supposément apparue au Cambrien (d'après la datation des premiers Mollusques) et ce probablement en réponse à l'apparition de prédateurs. Par la suite, il semblerait que les premiers mollusques se soient détachés du fond marin et ont alors commencé à se laisser flotter à l'aide de gaz dans la coquille.
On peut émettre l'hypothèse qu'une fois apte à la nage, leur pied ne leur servait plu à se déplacer, c'est alors qu'est apparu le siphon permettant d'orienter la nage. Ce pied devenu inutile a alors (hypothétiquement) pu devenir petit à petit un membre servant à saisir les objets. Ces peut être ce-dit pieds qui a donné lieu, au cours de l'évolution au développement des tentacules que l'on observe également chez le nautile. [21]
Classification avec les ordres éteints selon BioLib (27 janvier 2018)[22] :
- sous-classe Actinoceratoidea †
- ordre Actinocerida Teichert, 1933 †
- genre Eushantungoceras †
- genre Loxoceras M'Coy, 1844 †
- genre Sactoceras Hyatt, 1884 †
- sous-classe Ammonoidea Zittel, 1884 †
- super-ordre Mesoammonoidea †
- ordre Prolecanitida †
- ordre Ceratitida Hyatt, 1884 †
- super-ordre Neoammonoidea †
- ordre Ammonitida †
- super-ordre Palaeoammonoidea †
- ordre Agoniatitida Ruzhencev, 1957 †
- ordre Clymeniida †
- ordre Goniatitida †
- ordre Meekoceratida †
- ordre Otoceratida †
- ordre Xenodiscida †
- genre Pachylytoceras †
- genre Speetoniceras Spath, 1924 †
- super-ordre Mesoammonoidea †
- sous-classe Aptychi †
- genre Cornaptychus †
- genre Granulaptychus †
- genre Laevaptychus †
- genre Lamellaptychus Trauth, 1927 †
- genre Praestriaptychus †
- genre Rhyncholithus †
- genre Striaptychus †
- sous-classe Bactritoidea †
- ordre Bactritida Shimanskiy, 1951 †
- famille Bactritidae †
- famille Parabactritidae †
- ordre Bactritida Shimanskiy, 1951 †
- sous-classe Coleoidea Bather, 1888
- cohorte Neocoleoidea Haas, 1997
- super-ordre Decapodiformes Leach, 1817
- super-ordre Octobrachia Fioroni, 1981
- ordre Octopoda Leach, 1818
- ordre Vampyromorpha Grimpe, 1917
- cohorte Belemnoidea Gray, 1849 †
- super-ordre Belemnoida Gray, 1849 †
- ordre Aulacoceratida Stolley, 1919 †
- ordre Belemnitida Gray, 1849 †
- ordre Belemnoteuthina Stolley, 1919 †
- ordre Diplobelida Jeletzky, 1965 †
- ordre Phragmoteuthidida Jeletzky, 1965 †
- super-ordre Belemnoida Gray, 1849 †
- cohorte Neocoleoidea Haas, 1997
- sous-classe Endoceratoidea †
- ordre Endocerida Teichert, 1933 †
- sous-classe Nautiloidea Agassiz, 1847
- ordre 'Ellesmerocerida †
- ordre Oncocerida Flower, 1950 †
- ordre Nautilida Blainville, 1825
- ordre Discosorida †
- ordre Tarphycerida Flower, 1950 †
- genre Placenticeras Meek, 1876 †
- genre Pleuronoceras †
- sous-classe Orthoceratoidea M'Coy, 1844 †
- ordre Ascocerida Kuhn, 1949 †
- ordre Dissidocerida Zhuravleva, 1994 †
- ordre Lituitida Starobogatov, 1983 †
- ordre Orthocerida Kuhn, 1940 †
- ordre Pseudorthocerida Barskov, 1963 †
Les céphalopodes et l'homme
Pêche

Gastronomie
Parmi les céphalopodes utilisés en cuisine, seuls certains coléoïdes, c'est-à-dire quelques poulpes, seiches et calmars sont consommés. Certaines espèces de poulpes sont d'ailleurs toxiques. Ces animaux sont consommés depuis très longtemps, la plus ancienne transcription de recette de cuisine connue date de l'Antiquité romaine dans un ouvrage de Marcus Gavius Apicius[23].
L'encre de seiche, le sépia, est utilisée comme pigment en dessin et en cuisine.
Culture

Dès le XVIe siècle, des coquilles de nautiles du Pacifique occidental ont été très prisées par les collectionneurs et, en conséquence, elles sont souvent très richement montées. Souvent, la couche externe de la coquille sera dépouillée afin de révéler la surface nacrée située dessous. Les meilleurs artisans les transforment en objets d'art[24].
Annexes
Articles connexes
Bibliographie
- (en) Voss, N. A. Sweeney, M. J, Systematics and Biogeography of Cephalopods., vol. I, Smithsonian Contributions to Zoology, 586: 277-599, (lire en ligne)
- (en) Voss, N. A. Sweeney, M. J, Systematics and Biogeography of Cephalopods., vol. II, Smithsonian Contributions to Zoology, 586: 277-599, (lire en ligne)
- Sander Rang, « Documents pour servir à l’histoire naturelle des Céphalopodes cryptodibranches », Magasin de zoologie, Paris, Éd. Lequien fils, vol. 7, , p. 5-77 (lire en ligne [PDF], consulté le ).
Références taxinomiques
- (en) Référence World Register of Marine Species : taxon Cephalopoda Cuvier, 1797 (+ liste ordres + liste familles)
- (en) Référence Paleobiology Database : Cephalopoda Leach 1817
- (fr+en) Référence ITIS : Cephalopoda Cuvier, 1797
- (en) Référence Fonds documentaire ARKive : Cephalopoda
- (en) Référence Tree of Life Web Project : Cephalopoda
- (en) Référence BioLib : Cephalopoda Cuvier, 1795
- (en) Référence Animal Diversity Web : Cephalopoda
- (en) Référence uBio : Cephalopoda Cuvier, 1797
- (en) Référence Catalogue of Life : Cephalopoda (consulté le )
- (en) Référence NCBI : Cephalopoda (taxons inclus)
Notes et références
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 28 janvier 2016
- G. Lecointre et H. Le Guyader, Classification phylogénétique du vivant, Paris, Belin, .
- (en) Zoë A. Doubleday, Thomas A. A. Prowse, Alexander Arkhipkin, Graham J. Pierce, Jayson Semmens, Michael Steer, Stephen C. Leporati, Sílvia Lourenço, Antoni Quetglas, Warwick Sauer et Bronwyn M. Gillanders, « Global proliferation of cephalopods », Current Biology, vol. 26, no 10, , R406–R407 (DOI https://dx.doi.org/10.1016/j.cub.2016.04.002).
- « Le mystère du bec du calmar: un couteau sans manche », sur techno-science.net
- Tous les animaux du monde : Les invertébrés, t. 8, Librairie Larousse, (ISBN 2-03-015180-7), p. 182
- (en) Karl M. Wilbur, M. R. Trueman et E. R. Clarke, The Mollusca : 11. Form and Function, t. 11, New York, Academic Press, (ISBN 0-12-728702-7)
- (en) Blog du Museum of New Zealand Te Papa Tongarewa, « Hooks and suckers », sur blog.tepapa.govt.nz
- Michel Raynal, « Le « monstre de Floride » de 1896 : Cachalot ou pieuvre géante ? », sur pagesperso-orange.fr (consulté le ).
- « Résultats des campagnes scientifiques accomplies sur son yacht par Albert Ier, prince souverain de Monaco. », sur archive.org (consulté le ).
- Phan, L., Kautz, R., Leung, E. M., Naughton, K. L., Van Dyke, Y., & Gorodetsky, A. A. (2016). Dynamic materials inspired by cephalopods. Chemistry of Materials, 28(19), 6804-6816.
- J. H. Pikul & al. (2017) “Stretchable surfaces with programmable 3D texture morphing for synthetic camouflaging skins “| Science 13 Oct 2017|Vol. 358, Issue 6360, pp. 210-214 | DOI: 10.1126/science.aan5627|résumé
- The state of world fisheries and aquaculture (2012). Fisheries, F.A.O. and Department, Aquaculture.
- Monahan P (2016) « World octopus and squid populations are booming », in Climate Oceanography Plants & Animals DOI: 10.1126/science.aaf5741
- Patrick Monahan Top stories: World octopus and squid populations are booming (dans le monde les populations de poulpes et calmars sont en plein essor), Science News, 27 mai 2016
- Caddy, J.F & Rodhouse P.G (1998), Cephalopod and groundfish landings: evidence for ecological change in global fisheries?. Rev. Fish. Biol. Fish. ; 8: 431–444.
- Pecl G.T & Jackson G.D (2008) The potential impacts of climate change on inshore squid: biology, ecology and fisheries. Rev. Fish. Biol. Fish; 18: 373–385
- Anderson, S.C., Flemming, J.M., Watson, R & Lotze (2011), Rapid global expansion of invertebrate fisheries: trends, drivers, and ecosystem effects, H.K. PLoS One. ; 6: e14735
- World Register of Marine Species, consulté le 23 décembre 2013
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 23 décembre 2013
- (en) Mark Carnall, « I, for one, welcome our new cephalopod overlords ... but what are they? », sur The Guardian, .
- Godfrey-Smith, Peter, (1965- ...), Le prince des profondeurs (ISBN 978-2-08-142226-1 et 2-08-142226-3, OCLC 1028549972, lire en ligne)
- BioLib, consulté le 27 janvier 2018
- Dictionnaire classique d'histoire naturelle Par Bory de Saint-Vincent
- (en) Royal Collection Trust (pour la Reine Elisabeth II), « Nautilus cup », royalcollection.org.uk, (consulté le )
- Portail des mollusques et de la malacologie
- Portail de la biologie marine
- Portail de la paléontologie

