Heteroptera
Hétéroptères, Punaises
.jpg.webp)
| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Sous-embr. | Hexapoda |
| Classe | Insecta |
| Sous-classe | Pterygota |
| Infra-classe | Neoptera |
| Super-ordre | Hemipteroidea |
| Ordre | Hemiptera |
Pour les articles homonymes, voir Punaise.
Les Hétéroptères (Heteroptera) ou punaises, sont un sous-ordre d'insectes de l'ordre des hémiptères, qui sont des insectes ptérygotes hétérométaboles, et se caractérisent par un appareil buccal de type piqueur-suceur, deux paires d'ailes, dont les antérieures sont partiellement cornées et partiellement membraneuses, et des antennes généralement longues (sauf chez les Nepomorpha).
Ce sous-ordre comprend 90 familles[1] regroupant plus de 45 000 espèces[2]. Il est l'un des sous-ordres des hémiptères, qui en compte 4 ou 5 (la définition est encore discutée), avec les Sternorhynches (pucerons, cochenilles, psylles), Coleorhynches, les Cicadomorphes (Cigales, Cicadelles, Cercopes), et les Fulgoromorphes (Fulgores, etc.), ces deux derniers groupes souvent regroupés au sein des Auchenorhynches.
Dénomination, étymologie
Les « Hétéroptères », du grec ancien ἕτερος, héteros, « autre, dual, différent », et -ptère, πτερόν, pterón, « aile », signifiant donc « insectes aux ailes différentes », sont dénommés ainsi en raison de leur ailes supérieures uniques chez les insectes, appelées « hémélytres », et généralement séparées en une partie rigide et coriacée et une partie fine et membraneuse, et différentes des ailes postérieures, entièrement membraneuses. Au sein des Hémiptères, cette appellation s'opposait, lors de sa création par Latreille en 1810, à celle des « Homoptères », soit qui ne présentent pas cette double structure de l'aile, terme ddésignant un ancien sous-ordre aujourd'hui obsolète.
Le terme commun de « punaise » vient de l'adjectif ancien français « punais », « qui sent mauvais, puant », (du latin populaire putinasius[3]), en raison de l'odeur particulière que peuvent diffuser certaines espèces courantes.
En anglais, elles sont appelées « true bugs », en allemand Wanzen (du Moyen haut-allemand wantlūs, Wandlaus en allemand moderne, de Wand « mur » et Laus, « pou »), en italien cimice, du latin cimex, « punaise », en espagnol chinche, même origine.
Caractéristiques
Les Hétéroptères ont en commun avec les Hémiptères les caractéristiques suivantes:
- un rostre, transformation des pièces buccales en un organe piqueur-suceur;
- des antennes de 1 à 10 articles, (invisibles d'en-dessus chez les punaises aquatiques);
- 4 ailes;
- un scutellum, bien développé (le plus souvent).
Les Hétéroptères présentent en plus les caractères propres suivants permettant de les reconnaître aisément:
- les ailes antérieures (« hémélytres ») sont presque toujours composées de deux parties: la partie antérieure rigide, coriacée (la « corie »), et la partie postérieure fine, membraneuse (la « membrane »), avec quelques exceptions;
- le rostre est inséré à l'avant de la tête;
- des antennes de 4 ou 5 articles (invisibles chez les punaises aquatiques).
- la présence d'une glande odorifère métathoracique ou dorsoabdominale.
Morphologie


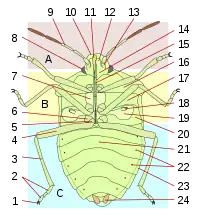
Comme tous les insectes, les punaises ont un corps articulé en trois parties, tête, thorax et abdomen, avec divers appendices (antennes, pattes, ailes).
La tête comporte des yeux composés, aux formes diverses (hémisphériques, réniformes), et entre ceux-ci ou en arrière, chez certains groupes, des yeux simples appelés ocelles. Les antennes comportent quatre ou cinq segments, de forme, de longueur et de structure variable, qui comportent des organes sensoriels importants (sensilles). En avant et en dessous de la tête est inséré un rostre, issu de la transformation des mandibules, composé de parties formant un tube (labre et labium), qui ménagent des canaux salivaires et alimentaires, et dans lesquelles des stylets acérés permettent de perforer les cibles (végétaux, animaux). Il est articulé (trois ou quatre segments de longueur variable) sauf chez les Corixidae, chez lesquels les segments sont fusionnés. La base du rostre peut être insérée entre deux buccules, petites excroissances. Le rostre est séparé de la partie avant du thorax par la gorge, ce qui n'est pas le cas chez les autres hémiptères.
Le thorax comporte trois parties, prothorax antérieur, mésothorax médian et métathorax postérieur. Le prothorax est appelé pronotum en face dorsale, et est un critère de détermination très important, quant à sa forme (quadrangulaire, trapézoïdale), ses marges, d'éventuels bourrelets, callosités, élargissements, excroissances, motifs, ponctuation, etc. Le mésonotum comporte une pièce centrale souvent triangulaire appelée scutellum, également déterminante pour l'identification. Il recouvre souvent la base des ailes pour les protéger. Chez certains groupes, comme les Scutelleridae, le scutellum recouvre tout l'abdomen, faisant penser aux élytres des coléoptères. La face ventrale présente des pleures (parties latérales) et des sternum (parties centrales) pour chaque section (propleures, mésosternum, etc.). Sur les métapleures (pleures du métathorax) s'ouvre l'orifice de la glande odorifère, accompagné d'une aire évaporatoire, parfois d'une gouttière qui servent également à l'identification. Chez les larves, les glandes odorifères ouvrent sur la face dorsale de l'abdomen, caractère qui persiste chez les adultes de certains groupes.
Le thorax porte également les pattes et les ailes. Les pattes sont composées de coxa (hanche), trochanter, fémur, tibia, et tarses (entre 1 et 3 articles), qui portent des griffes et d'autres organes (arolia). Fémurs et tibias peuvent présenter des épines ou d'autres excroissances. Chez plusieurs groupes prédateurs, les pattes antérieures sont ravisseuses, le tibia étant opposable au fémur et venant s'insérer dans une gouttière. Les pattes postérieures peuvent être adaptées au saut ou à la nage (avec des franges ciliées les transformant en pales natatoires).
Les ailes antérieures sont caractéristiques du sous-ordre, avec une partie antérieure coriacée, la « corie », et une partie postérieure fine, parfois veinée, la membrane. La corie, en tant qu'organe caractéristique, et signe de « punaiséité », se retrouve dans le nom de très nombreuses espèces ou familles de punaises: « Arachnocoris », « Carpocoris », « Dolycoris », « Anthocoridae », « Potamocoridae », « Pyrrhocoridae », etc. La corie se compose elle-même de plusieurs parties, le clavus, qui, lorsque l'aile est repliée, se place contre le scutellum, l'endocorie, l'exocorie, et, chez certains groupes (Miridae, Anthocoridae etc.), d'une partie terminale distincte, le cunéus. Les ailes postérieures sont toujours membraneuses. Chez un certain nombre d'espèces, les ailes sont réduites voire absentes. Certaines espèces peuvent présenter un polymorphisme alaire, avec des individus aux ailes entièrement développées (macroptères), et d'autres aux ailes atrophiées (brachyptères, microptères) ou absentes (aptères).
L'abdomen comprend les organes internes. Il est segmenté en sternites (face ventrale) et tergites (face dorsale). Chez certains groupes, un élargissement de l'abdomen avec des paratergites forment un connexivum parfois coloré et caractéristique. Les pièces génitales sont au bout de l'abdomen. Chez le mâle, la capsule génitale est appelée pygophore, qui peut être articulé comme une rotule, permettant une mobilité lors de l'accouplement. Le pygophore comporte le phallus, et, de chaque côté des appendices, les paramères. Leur forme sont des critères déterminants pour la majorité des espèces. Les femelles ont extérieurement des plaques génitales, certaines avec un ovipositeur, ainsi que des organes internes, vagin, spermathèque, glandes.[2]
Le corps peut être plus ou moins recouvert de pilosité, plus ou moins dense et/ou plus ou moins longue. Les Gerromorpha ont une pubescence ventrale dense et hydrofuge. Les parties coriacées (tête, pronotum, scutellum, cories), peuvent être plus ou moins ponctuées, et chez certains groupes, développer des structures particulières, alvéolées (par exemple Tingidae) ou avec des excroissances nombreuses.
Les larves ont 5 stades de développement après leur éclosion, passant par des mues. Elles n'ont pas d'ailes mais seulement des ébauches alaires, selon les différents stades.
 Ponte de Nezara viridula, ici parasitée par une guêpe du genre Anastatus (Eupelmidae).
Ponte de Nezara viridula, ici parasitée par une guêpe du genre Anastatus (Eupelmidae). Nezara viridula, juvéniles stade I.
Nezara viridula, juvéniles stade I. Nezara viridula, juvénile stade II.
Nezara viridula, juvénile stade II. Nezara viridula, juvéniles stade III. Encore groupés, mais loin des œufs.
Nezara viridula, juvéniles stade III. Encore groupés, mais loin des œufs. Nezara viridula, juvénile stade IV. A ce stade, sont souvent dispersés.
Nezara viridula, juvénile stade IV. A ce stade, sont souvent dispersés. Nezara viridula, juvénile stade V. Ébauche des ailes
Nezara viridula, juvénile stade V. Ébauche des ailes Nezara viridula adulte.
Nezara viridula adulte. Adulte émergeant lors de sa mue imaginale, la dernière mue. Graphosoma italicum.
Adulte émergeant lors de sa mue imaginale, la dernière mue. Graphosoma italicum. Exuvie d'une larve de punaise en gros plan
Exuvie d'une larve de punaise en gros plan
Répartition et habitat
Les punaises se rencontrent partout dans le monde. Leurs habitats sont très divers et de trois types:
- les habitats aquatiques (Nepomorpha), les punaises vivant sous l'eau, qu'elle soit stagnante ou courante, douce, saumâtre ou marine;
- les habitats subaquatiques, à la surface de l'eau (Gerromorpha);
- et les habitats terrestres, que ce soit sur les rives, sous des pierres, dans la litières sous des écorces, dans les plantes, des zones humides aux plus sèches.
D'un point de vue évolutif phylogénétique, il semble que le plus récent ancêtre commun des Hétéroptères était terrestre, avec deux glissements vers le mode de vie aquatique chez les Nepomorpha et subaquatiques (surface de l'eau) chez les Gerromorpha[1].
Biologie
Alimentation
Les punaises ont trois modes d'alimentation: phytophages, prédatrices ou ectoparasites hématophages. Certaines ont un régime mixte (phytophage et prédatrices). Dans tous les cas, elles utilisent leur rostre, organe piqueur-suceur tourné vers l'arrière, sous la tête, composé de plusieurs segments (sauf chez les Corixidae), à l'intérieur duquel, des stylets mobiles permettent de piquer, avec des échancrures formant des canaux[4].
Phytophagie
La plupart des punaises Cimicomorphes et Pentatomomorphes se nourrissent de sèves végétales, piquant les tiges, les feuilles, les fruits, les graines. Les Corixidae (Nepomorpha) mangent des algues et des plantes aquatiques, les Cydnidae (Pentatomomorpha) des racines. Certaines sont mycophages (Aradidae)[1].
Prédation
Les infra-ordres Nepomorpha, Gerromorpha, Dipsocoromorpha, Enicocephalomorpha, Leptopodomorpha sont surtout prédateurs, mais aussi les Reduviidae, les Anthocoridae, les Lyctocoridae, quelques Miridae (Cimicomorpha), les Asopinae (Pentatomorpha) , voire charognards (Gerromorpha). Il semble que l'ancêtre commun des Hétéroptères soit passé de la phytophagie au mode d'alimentation prédateur, mode retrouvé dans les infra-ordres basaux, et que des glissements vers la phytophagie ou d'autres modes d'alimentation ont eu lieu plusieurs fois[1].
 Velia caprai (Veliidae, Gerromorpha) avec un diptère
Velia caprai (Veliidae, Gerromorpha) avec un diptère Punaise à antennes plates (Miridae, Cimicomorpha), avec une proie, mouche
Punaise à antennes plates (Miridae, Cimicomorpha), avec une proie, mouche_with_bee_(Apis_ssp)_prey.jpg.webp) Réduve irascible (Rhynocoris iracundus, Reduviidae, Cimicomorpha) avec sa proie (abeille, Apis sp.)
Réduve irascible (Rhynocoris iracundus, Reduviidae, Cimicomorpha) avec sa proie (abeille, Apis sp.).jpg.webp) Ectrichodia crux (Reduviidae, Cimicomorpha) avec sa proie, une iule (Juliformia sp.), Afrique du Sud
Ectrichodia crux (Reduviidae, Cimicomorpha) avec sa proie, une iule (Juliformia sp.), Afrique du Sud Nepidae sp. (Nepomorpha) avec un petit poisson
Nepidae sp. (Nepomorpha) avec un petit poisson
Hématophagie
Un petit nombre enfin sont ectoparasites hématophages : les Cimicidae (dont les punaises des lits) et les Triatominae (Reduviidae) sur des oiseaux et des mammifères, y compris l'humain ; les Polyctenidae sur des chauves-souris[2].
Digestion
Chez les punaises prédatrices, comme chez d'autres arthropodes, la digestion est externe, car elles n'ont pas de pièces buccales masticatrices. Les glandes salivaires injectent un venin neurotoxique et des sucs digestifs dans la proie, qui la paralysent et la liquéfie, puis la punaise peut aspirer les fluides, comme le font les punaises phytophages[5]. Cela explique le caractère très douloureux de piqûres par des Nèpes, des Belostomes ou des Notonectes.
Les punaises peuvent abriter des bactéries symbiotes, qui leur fournissent des oligo-éléments ou vitamines qu'elles ne peuvent synthétiser, ou qui sont impliquées dans leur digestion. Par exemple, des mycobactéries du genre Rhodoccocus sont observées chez les punaises triatomes vectrices de la maladie de Chagas (et chez un autre arthropode piqueur, la tique Ixodes ricinus[6]). Elles jouent un rôle dans la physiologie du repas sanguin.
Conséquences sur les cultures
Chez certaines (chez les Pentatomidae, Tingidae, Miridae, Lygaeidae), la prise de nourriture peut provoquer des dégâts directs aux végétaux (baisse de croissance, dessèchement des cellules de l'épiderme causant le phénomène de « grillures ») ou des dégâts indirects (transmission d'agents phytopathogènes véhiculés par la salive lors de la prise du bol alimentaire, à l'origine de phénomènes de nanismes, de jaunisses, de balais de sorcières et de dépérissements variés), mais elles sont rarement en nombre suffisant pour créer de tels dégâts[7].
D'autres espèces (chez les Miridae, les Anthocoridae, les Pentatomidae, les Nabidae) sont prédatrices et constituent des auxiliaires des cultures en lutte biologique, en mangeant des espèces nuisibles (pucerons, thrips, acariens, aleurodes, œufs de papillons et de cicadelles, larves de mouches…)[8].
Conséquences sur la santé
Les parasites hématophages des vertébrés, telle la punaise des lits peuvent causer des infestations très désagréables. Certains Triatominae peuvent être des vecteurs de la maladie de Chagas (tripanosome), telles la vinchuca (Triatoma infestans), Triatoma protracta, ou Rhodnius prolixus, causant plus de 7 000 décès par an, et des atteintes à la qualité de vie des personnes affectées[5].
Vol
La plupart des espèces sont capables de voler, y compris les espèces aquatiques et de surface de l'eau. Toutefois, certaines familles ou espèces sont brachyptères, microptères ou aptères, avec chez certaines espèces un polymorphisme alaire.
Reproduction
Les punaises se reproduisent avec différentes positions d'accouplement: tandems en ligne tête-bêche (cul à cul) comme chez le Gendarme (Pyrrhocoridae); le mâle sur la femelle, mais avec ses organes génitaux atteignant la femelle par en dessous, ou non; ou côte à côte (en V)[9]. Les organes génitaux peuvent permettre une rotation de 180°. Chez certaines espèces, le mâle reste accouplé après l'insémination, pour empêcher un autre mâle de féconder la femelle[10].
- Positions d'accouplement chez les Hétéroptères
 Accouplement superposé, sur l'eau, chez Gerris sp., Gerridae (Gerromorpha)
Accouplement superposé, sur l'eau, chez Gerris sp., Gerridae (Gerromorpha).jpg.webp)
 Accouplement chez Chrysocoris stollii, la punaise du litchi, Scutelleridae (Pentatomorpha)
Accouplement chez Chrysocoris stollii, la punaise du litchi, Scutelleridae (Pentatomorpha) Tandem (cul à cul) chez la punaise des baies, Dolycoris baccarum, Pentatomidae
Tandem (cul à cul) chez la punaise des baies, Dolycoris baccarum, Pentatomidae Tandem chez la punaise arlequin, ou Graphosome rayé, Pentatomidae
Tandem chez la punaise arlequin, ou Graphosome rayé, Pentatomidae_-_Paarung_(1).jpg.webp) Tandem de Gendarmes (Pyrrhocoridae, Pentatomomorpha) montrant la capacité de rotation du pygophore
Tandem de Gendarmes (Pyrrhocoridae, Pentatomomorpha) montrant la capacité de rotation du pygophore
Le mécanisme de castration chimique existe chez les punaises, notamment Lygus hesperus (en) : lors de l'accouplement, le mâle transfère à la femelle un composé répulsif avec son spermatophore, l'acétate de myristyle qui a une fonction anaphrodisiaque, la femelle perdant alors son pouvoir de séduction[11].
Chez certains groupes (notamment de Cimicimorpha), la fécondation a lieu par copulation traumatique, par laquelle le mâle transperce directement l'abdomen de la femelle, causant une mortalité ou une diminution de l'espérance de vie des femelles.
Si l'immense majorité des punaises sont ovipares, il existe des exemples d'ovoviviparité, d'ovoviviparité incomplète et de viviparité, qui ont été documentés pour les familles Polyctenidae, Cimicidae, Anthocoridae, Plokiophilidae, Microphysidae, quelques espèces d'Aradidae et de Lygaeidae[12].
Soins parentaux
On a pu constater des soins parentaux chez plus de 60 genres (dans 14 familles et 4 infra-ordres)[13], notamment chez Elasmucha grisea [14]ou Elasmucha lateralis[15], chez Sastragala (Acanthosomatidae, Pentatomomorpha) dont la femelle garde les œufs, puis les juvéniles (jusqu'aux stades 2 à 5). Lorsque ces derniers deviennent trop grands pour rester sous elle, elle continue à les défendre en faisant vibrer ses ailes pour intimider les prédateurs. Chez les Belostomatidae, espèces aquatiques (Nepomorpha), le mâle protège les œufs: chez Belostoma et chez Abedus, la femelle pond sur les hémélytres du mâle qui porte les œufs jusqu'à leur éclosion. Chez Lethocerus, les œufs sont pondus sur des végétaux légèrement au-dessus de l'eau, et le mâle surveille la ponte et la mouille régulièrement pour éviter la dessication[16]. Chez des espèces de Rhynocoris (Reduviidae, Cimicomorpha), les œufs sont gardés par le mâle chez R. tristis, et par la femelle chez R. carmelita[17]. Chez la tribu des Apiomerini (Reduviidae, Harpactorinae), la femelle récolte et stocke de la résine, dont elle enduit les œufs qu'elle a pondus, pour les protéger de la dessication et de la prédation[18],[19].
 Femelle de Pentatomidae (Carpocoris sp.) en train de pondre
Femelle de Pentatomidae (Carpocoris sp.) en train de pondre.jpg.webp) Femelle d'Elasmucha grisea veillant sur ses œufs en attendant l'éclosion
Femelle d'Elasmucha grisea veillant sur ses œufs en attendant l'éclosion Mâle d'Abedus indentatus (Belostomatidae, Nepomorpha), portant les œufs sur sont dos.
Mâle d'Abedus indentatus (Belostomatidae, Nepomorpha), portant les œufs sur sont dos.
Odeur

Les punaises possèdent des glandes odoriférantes défensives, également appelées « glandes répugnatoires » à fonction répulsives, dissuasives, toxiques et antimicrobiennes[20]. Elles s'ouvrent sur le dessus de l'abdomen chez les larves, et chez les adultes, latéro-ventralement, entre les pattes médianes et postérieures (bien que dans certains groupes, la position dorsale persiste chez l'adulte). L'« odeur de punaise » est caractéristique de certaines espèces (Pentatomidae, Coreidae), peut être perçue comme malodorante. C'est cette caractéristique qui leur a valu leur nom commun français de « punaises ».
Défenses
Ces productions odoriférantes font partie d'une stratégie multimodale de défense des Hétéroptères [21], dont les principales sont des signaux visuels, en arborant des couleurs vives afin de signaler un danger (aposématisme)[22], comme chez le gendarme, Graphosome rayé, ou divers Lygaeidae, ou au contraire par des couleurs cryptiques; des signaux acoustiques d'avertissement stridulatoires; et des substances chimiques soit synthétisées par des glandes exocrines, soit prises dans les plantes-hôtes. Ainsi, des espèces de Lygaeidae (Tropidothorax, Oncopeltus, Lygaeus, Spilostethus, etc.) peuvent se nourrir de graines d'Asclepiadiaceae toxiques (Vincetoxicum, Cynanchum), et présentent une livrée rouge et noire avec des taches blanches ou jaunes très voyantes[23].
Prédateurs et parasites
Malgré leurs défenses, les hétéroptères peuvent être également les proies de nombreux organismes. Parmi ceux-ci, on peut mentionner les Hétéroptères prédateurs, comme les Nabidae, les Reduviidae ou les Anthocoridae. La prédation peut également être exercée par des Guêpes Sphécides, des fourmis, par des Araignées ou des Myriapodes (par exemple Lithobius), par des oiseaux insectivores, ou encore par des reptiles (lézards).
.jpg.webp) Asilidae (Diptera) ayant capturé une Tessarotoma papillosa (Tessaratomidae, Pentatomorpha)
Asilidae (Diptera) ayant capturé une Tessarotoma papillosa (Tessaratomidae, Pentatomorpha) Punaise Rhynocoris (Reduviidae) mangeant une punaise Pentatomidae
Punaise Rhynocoris (Reduviidae) mangeant une punaise Pentatomidae Larve de Pentatomoidea (probable Elasmostethus, Acanthosomatidae) capturée par une araignée Xysticus acerbus (Thomisidae)
Larve de Pentatomoidea (probable Elasmostethus, Acanthosomatidae) capturée par une araignée Xysticus acerbus (Thomisidae).jpg.webp) Pentatomidae capturée par un Viréo à tête bleue (Vireonidae)
Pentatomidae capturée par un Viréo à tête bleue (Vireonidae).jpg.webp) Goéland à bec cerclé tentant de capturer une Pentatomidae
Goéland à bec cerclé tentant de capturer une Pentatomidae
Les Hétéroptères ont également des endoparasites, notamment des Bactéries, des Protozoaires, des vers Nématodes, des insectes Hyménoptères ou Diptères, comme les Tachinaires (notamment Phasiinae), ainsi que des ectoparasites acariens[24]. Les Phasiinae (Ectophasia, Trichopoda, etc.), par exemple, pondent des œufs sur les punaises adultes (Pentatomidae, Scutelleridae, Coreidae, Lygaeidae), dont la punaise n'arrive pas à se débarrasser. Dès qu'elle éclot, la larve pénètre dans la punaise en perforant sa cuticule, puis se met à la manger de l'intérieur, sans toucher directement les organes vitaux, ce qui lui permet de laisser l'insecte adulte vivant, et même d'hiverner en lui. Une fois mature, elle émerge de l'insecte par l'extrémité de l'abdomen, entraînant la mort rapide de la punaise[25],[26].
 Œuf de Trichopoda pictipennis sur la tête d'une Nezara viridula (forme torquata)
Œuf de Trichopoda pictipennis sur la tête d'une Nezara viridula (forme torquata).jpg.webp) Guêpe samourai (Trissolcus japonicus) pondant dans des œufs d'Halyomorpha halys (Pentatomidae).
Guêpe samourai (Trissolcus japonicus) pondant dans des œufs d'Halyomorpha halys (Pentatomidae)..jpg.webp) Guêpe samourai (Trissolcus japonicus) émergeant d'un œuf d'Halyomorpha halys (Pentatomidae) parasité.
Guêpe samourai (Trissolcus japonicus) émergeant d'un œuf d'Halyomorpha halys (Pentatomidae) parasité._(11838791835).jpg.webp) Platymeris guttatipennis (Reduviidae) avec des acariens sur le scutellum.
Platymeris guttatipennis (Reduviidae) avec des acariens sur le scutellum. Mezira tremulae (Aradidae) couverte d'acariens hors de sa portée pour s'en débarrasser.
Mezira tremulae (Aradidae) couverte d'acariens hors de sa portée pour s'en débarrasser.
Systématique
Historiquement, les trois types de milieux où se rencontrent les punaises, aquatiques, subaquatiques et terrestres, avaient donné lieu à une classification des Hétéroptères en trois catégories par Dufour en 1833 : les « Hydrocorises »(du grec kóris, « punaise » et hydro, « eau »), qui correspondant aux Nepomorpha actuels; les « Amphibicorises » (du grec ancien ἀμφίβιος, amphíbios (« qui vit dans deux éléments »), qui correspondent aux actuels Gerromorpha, et les « Géocorises »(du grec geo, « terre »), punaises terrestres[27]. Pour certains auteurs, les deux dernières catégories étaient réunies en une seule, les Géocorises[28]. Ces termes ont été utilisés jusqu'à la fin des années 70.
Les infra-ordres d'Heteroptera
La classification des Hétéroptères en sept infra-ordres est reconnue depuis les travaux de Schuh en 1979, qui a réanalysé, selon une approche cladistique, les données collectées par Cobben en 1978 sur l'évolution des appareils buccaux et les méthodes d'alimentation[29],[30].
Selon ITIS (16 janv. 2013)[31] et Weirauch & Schuh (2011)[32] :
- infra-ordre Cimicomorpha ;
- infra-ordre Dipsocoromorpha ;
- infra-ordre Enicocephalomorpha ;
- infra-ordre Gerromorpha ;
- infra-ordre Leptopodomorpha ;
- infra-ordre Nepomorpha ;
- infra-ordre Pentatomomorpha.
Bien que la monophylie des sept infra-ordres ait été démontrée par diverses études[33], leurs relations de parenté ne sont pas encore pleinement établies et plusieurs hypothèses phylogénétiques restent à confirmer[32]. Les Hétéroptères dériveraient des †Scytinopteroidea, une super-famille fossile de Cicadomorpha. Selon Li et al. (2012), le groupe basal des Hétéroptères seraient les Nepomorpha, apparus au début du Trias. Les six autres infra-ordres seraient apparus sur une courte période au cours du Trias moyen. Cimicomorpha et Pentatomomorpha apparaissent comme des groupes frères dans un clade commun, mais les relations avec les quatre autres infra-ordres restent à préciser. La plupart des super-familles de Cimicomorpha et de Pentatomomorpha seraient apparues au Jurassique, mais leurs familles modernes se seraient surtout diversifiées à partir du Crétacé, qui coïncide avec l'apparition et le développement des plantes à fleurs il y a 140 millions d'années[34].
Arbres phylogénétiques
Selon Weirauch et al. (2018), les relations entre infra-ordres seraient les suivantes, avec les Nepomorpha comme groupe basal[35]:
- Heteroptera
- Nepomorpha
-
- Geoheteroptera
- Leptopodomorpha
- Terheteroptera
Selon Liu et al. (2018), dont l'analyse est basée sur le génome mitochondrial, le groupe basal n'est plus les Nepomorpha, mais un clade contenant les Dispocoromopha, les Gerromorpha et les Enicocephalomorpha[36]:
- Heteroptera
- Panheteroptera
- Nepomorpha
-
- Leptopodomorpha
- Terheteroptera
Liste de familles par infra-ordre
Selon BioLib (2 avril 2022)[37], complété ou corrigé à partir de Aberlenc & al. (2020) et de Schuh & Weirauch (2020)[38],[39] :
- infra-ordre Enicocephalomorpha Stichel, 1955 (425 espèces)
- super-famille Enicocephaloidea Stål, 1860
- famille Enicocephalidae Stål, 1860
- famille Aenictopecheidae Usinger, 1932
- super-famille Enicocephaloidea Stål, 1860
- infra-ordre Dipsocoromorpha Dohrn, 1859
- super-famille Dipsocoroidea Dohrn, 1859 (395 espèces)
- famille Ceratocombidae Fieber, 1860
- famille Dipsocoridae Dohrn, 1859
- famille Hypsipterygidae Drake, 1961
- famille Schizopteridae Reuter, 1891
- famille †Cuneocoridae Handlirsch, 1920
- famille Stemmocryptidae Štys, 1983
- super-famille Dipsocoroidea Dohrn, 1859 (395 espèces)
- infra-ordre Gerromorpha Leach, 1815 (2120 espèces)
- super-famille Gerroidea Leach, 1815
- famille Gerridae Leach, 1815
- famille Veliidae Brullé, 1836
- famille Hermatobatidae Coutière & Martin, 1901
- super-famille Hebroidea Amyot & Serville, 1843
- famille Hebridae Amyot & Serville, 1843
- super-famille Hydrometroidea Billberg, 1820
- famille Hydrometridae Billberg, 1820
- famille Macroveliidae McKinstry, 1942
- famille Paraphrynoveliidae Andersen, 1978
- super-famille Mesovelioidea Douglas & Scott, 1867
- famille Mesoveliidae Douglas & Scott, 1867
- famille Madeoveliidae Poisson, 1959
- super-famille Gerroidea Leach, 1815
- infra-ordre Leptopodomorpha Brullé, 1836 (381 espèces)
- super-famille Leptopodoidea Brullé, 1836
- famille Leptopodidae Brullé, 1836
- famille Omaniidae Cobben, 1970
- famille †Palaeoleptidae Poinar & Buckley, 2009
- super-famille Saldoidea Amyot & Serville, 1843
- famille Aepophilidae Puton, 1879
- famille Saldidae Amyot & Serville, 1843
- famille †Archegocimicidae Handlirsch, 1906
- super-famille Leptopodoidea Brullé, 1836
- infra-ordre Nepomorpha Latreille, 1802 (2309 espèces)
- super-famille Aphelocheiroidea Fieber, 1851
- famille Aphelocheiridae Fieber, 1851
- famille Potamocoridae Usinger, 1941
- super-famille Corixoidea Leach, 1815
- famille Corixidae Leach, 1815
- famille †Shurabellidae Popov, 1971
- super-famille Naucoroidea Leach, 1815
- famille Naucoridae Leach, 1815
- famille †Leptaphelocheiridae Polhemus, 2000
- famille †Triassocoridae Tillyard, 1922
- genre †Canteronecta Mazzoni, 1985
- super-famille Nepoidea Latreille, 1802
- famille Belostomatidae Leach, 1815
- famille Nepidae Latreille, 1802
- super-famille Notonectoidea Latreille, 1802
- famille Notonectidae Latreille, 1802
- super-famille Ochteroidea Kirkaldy, 1906
- famille Ochteridae Kirkaldy, 1906
- famille Gelastocoridae Kirkaldy, 1897
- famille †Propreocoridae Popov, Dolling & Whalley, 1994
- super-famille Pleoidea Fieber, 1851
- famille Pleidae Fieber, 1851
- famille Helotrephidae Esaki & China, 1927
- famille †Mesotrephidae Popov, 1971
- famille †Scaphocoridae Popov, 1968
- famille †Pseudonerthridae Martins-Neto & Goodwyn, 2005
- famille †Pterocimicidae Popov & al., 1994
- genre †Morrisonnepa Lara, Foster, Kirkland & Howells, 2020
- super-famille Aphelocheiroidea Fieber, 1851
- infra-ordre Cimicomorpha Latreille, 1802 (21277 espèces)
- super-famille Cimicoidea Latreille, 1802
- famille Anthocoridae Fieber, 1837
- famille Cimicidae Latreille, 1802
- famille Nabidae A. Costa, 1853
- famille Curaliidae Schuh, Weirauch & Henry, 2008
- famille Lyctocoridae Reuter, 1884
- famille Plokiophilidae China, 1953
- famille Polyctenidae Westwood, 1874
- famille †Taimyrocoridae Popov, 2016
- famille †Torrirostratidae Yao & al., 2014
- genre †Electrocoris Usinger, 1942
- super-famille Miroidea Hahn, 1833
- famille Microphysidae Dohrn, 1859
- famille Miridae Hahn, 1833
- famille †Ebboidae Perrichot & al., 2006
- super-famille Reduvioidea Latreille, 1807
- famille Reduviidae Latreille, 1807
- famille Pachynomidae Stål, 1873
- famille †Ceresopseidae Becker-Migdisova, 1958
- super-famille Tingoidea Laporte, 1832
- famille Tingidae Laporte, 1832
- famille †Hispanocaderidae Golub & Popov, 2012
- famille †Ignotingidae Zhang, Golub, Popov & Shcherbakov, 2005
- super-famille Joppeicoidea Reuter, 1910
- famille Joppeicidae Reuter, 1910
- super-famille Thaumastocoroidea Kirkaldy, 1908
- famille Thaumastocoridae Kirkaldy, 1908
- famille Velocipedidae Bergroth, 1891
- famille †Vetanthocoridae Yao & al., 2006
- genre †Sternocoris Popov, 1986
- super-famille Cimicoidea Latreille, 1802
- infra-ordre Pentatomomorpha Leach, 1815 (18411 espèces)
- super-famille Aradoidea Brullé, 1836
- famille Aradidae Brullé, 1836
- famille Termitaphididae Myers, 1924
- famille †Kobdocoridae Popov, 1986
- super-famille Coreoidea Leach, 1815
- famille Alydidae Amyot & Serville, 1843
- famille Coreidae Leach, 1815
- famille Rhopalidae Amyot & Audinet-Serville, 1843
- famille Stenocephalidae Dallas, 1852
- famille Hyocephalidae Stål, 1874
- famille †Trisegmentatidae Zhang, Sun & Zhang, 1994
- famille †Yuripopovinidae Azar, Nel, Engel, Garrouste & Matocq, 2011
- genre †Cacalydus Scudder, 1890
- genre †Corizites Popov, 1986
- genre †Cratocoris Martins-Neto, Popov & Zamboni, 1999
- genre †Etirocoris Scudder, 1890
- genre †Litholygaeus Popov, 1986
- genre †Monocoris Popov, 1986
- super-famille Lygaeoidea Schilling, 1829
- famille Artheneidae Stål, 1872
- famille Berytidae Fieber, 1851
- famille Blissidae Stål, 1862
- famille Colobathristidae Stål, 1865
- famille Cryptorhamphidae Hamid, 1971
- famille Cymidae Baerensprung, 1860
- famille Geocoridae Baerensprung, 1860
- famille Heterogastridae Stål, 1872
- famille Lygaeidae Schilling, 1829
- famille Malcidae Stål, 1865
- famille Meschiidae Malipatil, 2014
- famille Ninidae Barber, 1956
- famille Oxycarenidae Stål, 1862
- famille Piesmatidae Amyot & Serville, 1843, parfois classé dans une super-famille Piesmatoidea Amyot & Serville, 1843
- famille Rhyparochromidae Amyot & Audinet-Serville, 1843
- genre Phasmosomus Kiritshenko, 1938
- famille †Pachymeridiidae Handlirsch, 1906
- super-famille Pentatomoidea Leach, 1815
- famille Acanthosomatidae Signoret, 1863
- famille Canopidae McAtee & Malloch, 1928
- famille Cydnidae Billberg, 1820
- famille Dinidoridae Stål, 1868
- famille Lestoniidae China, 1955
- famille Megarididae McAtee & Malloch, 1928
- famille Parastrachiidae Oshanin, 1922 (ou Parastrachiinae, Cydnidae)
- famille Pentatomidae Leach, 1815
- famille Phloeidae Dallas, 1851
- famille Plataspidae Dallas, 1851
- famille Scutelleridae Leach, 1815
- famille Tessaratomidae Stål, 1864
- famille Thaumastellidae Seidenstücker, 1960 (ou Thaumastellinae, Cydnidae)
- famille Thyreocoridae Amyot & Audinet-Serville, 1843 (ou Thyreocorinae, Cydnidae)
- famille Urostylididae Dallas, 1851
- famille †Mesopentacoridae Popov, 1968
- famille †Primipentatomidae Yao, Cai, Rider & Ren, 2013
- famille †Probascanionidae Handlirsch, 1921
- famille †Protocoridae Handlirsch, 1906
- famille †Venicoridae Yao & al., 2012
- genre †Chinchekoala Petrulevicius, 2016
- super-famille Idostoloidea
- famille Henicocoridae Woodward, 1968
- famille Idiostolidae Scudder, 1962
- super-famille Pyrrhocoroidea Amyot & Serville, 1843
- famille Largidae Amyot & Audinet-Serville, 1843
- famille Pyrrhocoridae Amyot & Audinet-Serville, 1843
- genre †Rhepocoris Scudder, 1890
- super-famille Aradoidea Brullé, 1836
- famille †Eocimicidae Handlirsch, 1906
- famille †Galgulidae Westwood, 1840
- famille †Hadrocoridae Handlirsch, 1920
- famille †Xishanidae Hong, 1981
- genre †Anacoloptera Handlirsch, 1906
- genre †Berytopsis Heer, 1853
- genre †Galerucites Oppenheim, 1888
- genre †Hebeicoris Hong, 1983
- genre †Heterochterus Evans, 1971
- genre †Liasocoris Wendt, 1940
- genre †Sinocoris Hong, 1983
- genre †Sphongophoriella Becker-Migdisova, 1958
Écologie
Agroscope signale une augmentation des signalements de punaises (Heteroptera) dans les cultures. Il s'agit en particulier de punaise ornée du chou Eurydema et autres punaises des brassicacées, de punaise des baies Dolycoris baccarum, et de punaises ternes Lygus. Leur prolifération est attribuée au réchauffement climatique[40].

Aspects culturels
- Les Français utilisent parfois l'exclamation « punaise ! » pour exprimer un sentiment de surprise aussi bien positif que négatif (expression familière, substitut édulcoré de l'interjection « putain ! »).
- Une « punaise de sacristie » est une personne dévote très attachée à l'Église (expression familière).
Liens externes
- (en) Référence Tree of Life Web Project : Heteroptera (consulté le )
- (en) Référence Orthoptera Species File : Atractomorpha heteroptera Bey-Bienko, 1951 Non valide (consulté le )
- (en) Référence Fauna Europaea : Heteroptera (consulté le )
- (fr+en) Référence ITIS : Heteroptera Latreille, 1810 (consulté le )
- (en) Référence Paleobiology Database : Heteroptera Latreille 1810 (consulté le )
- (en) Référence World Register of Marine Species : taxon Heteroptera (+ liste espèces) (consulté le )
- (en) Référence NCBI : Heteroptera (taxons inclus) (consulté le )
- (en) Référence uBio : Heteroptera Rafinesque 1814 (consulté le )
- Atlas des hétéroptères non-aquatiques du Luxembourg.
Notes et références
- (en) Weirauch, C., Schuh, R.T., Cassis, G. et Wheeler, W.C., « Revisiting habitat and lifestyle transitions in Heteroptera (Insecta: Hemiptera): insights from a combined morphological and molecular phylogeny. », Cladistics, vol. 35, no 1, , p. 67-105 (DOI 10.1111/cla.12233).
- Henri-Pierre Aberlenc (coordination), Les insectes du monde : biodiversité, classification, clés de détermination des familles, Museo Éditions & Éditions Quae, (ISBN 978-2-37375-101-7 et 2-37375-101-1, OCLC 1250021162, lire en ligne), tome 1, pp. 506-523 et 541-574, tome 2 pp. 210-259
- « PUNAIS : Etymologie de PUNAIS », sur www.cnrtl.fr (consulté le )
- « Pièces buccales des insectes : synthèse générale - », (consulté le )
- (en) Andrew Walker, Christiane Weirauch, Bryan Fry et Glenn King, « Venoms of Heteropteran Insects: A Treasure Trove of Diverse Pharmacological Toolkits », Toxins, vol. 8, no 2, , p. 43 (ISSN 2072-6651, PMID 26907342, PMCID PMC4773796, DOI 10.3390/toxins8020043, lire en ligne, consulté le )
- Halos et al., 2006.
- Philippe Ryckewaert, Guide de reconnaissance des insectes et acariens des cultures maraîchères des Petites Antilles, Quæ, , p. 25-27.
- Lydie Suty, La lutte biologique. Vers de nouveaux équilibres écologiques, Quæ, , p. 189
- (en) Bernhard A. Huber, « Mating positions and the evolution of asymmetric insect genitalia », Genetica, vol. 138, no 1, , p. 19–25 (ISSN 0016-6707 et 1573-6857, DOI 10.1007/s10709-008-9339-6, lire en ligne, consulté le )
- Alois Honek, Zdenka Martinkova et Marek Brabec, « Mating activity of Pyrrhocoris apterus (Heteroptera: Pyrrhocoridae) in nature », European Journal of Entomology, vol. 116, , p. 187–193 (DOI 10.14411/eje.2019.020, lire en ligne, consulté le )
- (en) C. S. Brent et J. A. Byers, « Female attractiveness modulated by a male-derived antiaphrodisiac pheromone in a plant bug », Animal Behaviour, vol. 82, no 5, , p. 937-943
- Ilya A. Gavrilov-Zimin, « Egg retention, viviparity and ovoviviparity in Paraneoptera », Comparative Cytogenetics, vol. 15, no 3, , p. 239–252 (ISSN 1993-078X et 1993-0771, DOI 10.3897/CompCytogen.v15.i3.70216, lire en ligne, consulté le )
- (en) Jing-Fu Tsai, Shin-ichi Kudo et Kazunori Yoshizawa, « Maternal care in Acanthosomatinae (Insecta: Heteroptera: Acanthosomatidae)—correlated evolution with morphological change », BMC Evolutionary Biology, vol. 15, no 1, , p. 258 (ISSN 1471-2148, PMID 26586480, PMCID PMC4653913, DOI 10.1186/s12862-015-0537-4, lire en ligne, consulté le )
- Roland Lupoli et François Dusoulier, Les Punaises Pentatomoidea de France, Fontenay-sous-Bois, Ancyrosoma, , 429 p. (ISBN 978-2-9536661-1-3), p. 47
- « Acanthosomatidae punaises Hétéroptère Hémiptère », sur entomofaune.qc.ca (consulté le )
- (en) Shin-ya Ohba, José Ricardo I. Ribeiro et Melania Santer, « Paternal Care in Giant Water Bugs », dans Aquatic Insects, Springer International Publishing, (ISBN 978-3-030-16326-6, DOI 10.1007/978-3-030-16327-3_12, lire en ligne), p. 321–340
- (en) James D. J. Gilbert, Lisa K. Thomas et Andrea Manica, « Quantifying the benefits and costs of parental care in assassin bugs », Ecological Entomology, vol. 35, no 5, , p. 639–651 (DOI 10.1111/j.1365-2311.2010.01221.x, lire en ligne, consulté le )
- (en) Dimitri Forero, Dong-Hwan Choe et Christiane Weirauch, « Resin gathering in neotropical resin bugs (Insecta: Hemiptera: Reduviidae): Functional and comparative morphology », Journal of Morphology, vol. 272, no 2, , p. 204–229 (DOI 10.1002/jmor.10907, lire en ligne, consulté le )
- (en) Dimitri Forero et Christiane Weirauch, « Resin-enabled maternal care is an old evolutionary strategy in New World resin bugs (Hemiptera: Reduviidae) », Zoological Journal of the Linnean Society, (DOI 10.1111/zoj.12454, lire en ligne, consulté le )
- (en) Koji Noge, « Studies on chemical ecology of the heteropteran scent gland components », Journal of Pesticide Science, vol. 40, no 3, , p. 143–145 (ISSN 1348-589X et 1349-0923, DOI 10.1584/jpestics.J15-03, lire en ligne, consulté le )
- (en) Alice Exnerová, Eva Landová, Pavel Štys et Roman Fuchs, « Reactions of passerine birds to aposematic and non-aposematic firebugs (Pyrrhocoris apterus ; Heteroptera): REACTIONS OF PASSERINES TOWARDS PYRRHOCORIS APTERUS », Biological Journal of the Linnean Society, vol. 78, no 4, , p. 517–525 (DOI 10.1046/j.0024-4066.2002.00161.x, lire en ligne, consulté le )
- (en) Scott A. Fabricant et Carolynn L. Smith, « Is the hibiscus harlequin bug aposematic? The importance of testing multiple predators », Ecology and Evolution, vol. 4, no 2, , p. 113–120 (ISSN 2045-7758 et 2045-7758, PMID 24558567, PMCID PMC3925375, DOI 10.1002/ece3.914, lire en ligne, consulté le )
- Jean Fédération française des sociétés de sciences naturelles, Hémiptères Lygaeidae euro-méditerranéens, Féderation Française des Sociétés de Sciences Naturelles, (ISBN 2-903052-18-2, 978-2-903052-18-8 et 2-903052-19-0, OCLC 41971044, lire en ligne)
- Jean Péricart, Hémiptères Nabidae d'Europe occidentale et du Maghreb, Fédération française des sociétés de sciences naturelles, (ISBN 2-903052-05-0 et 978-2-903052-05-8, OCLC 20135224, lire en ligne)
- Gaël Pétremand, Serge Fischer, Gaëtan Jaccard et Sophie Rochefort, « First detection of the southern green stink bug parasitoid Trichopoda pennipes (Fabr.) (Diptera: Tachinidae) in Western Switzerland », Conférence à la Société Entomologique Suisse, (DOI 10.13140/RG.2.2.32890.49605, lire en ligne, consulté le )
- Antonio Ricarte, Piluca Álvarez Fidalgo et Marián Álvarez Fidalgo, « Distribución actualizada y fenología de Trichopoda pennipes (Fabricius, 1781) (Diptera: Tachinidae) en la Península Ibérica », Graellsia, vol. 76, no 2, , p. 116 (ISSN 1989-953X et 0367-5041, DOI 10.3989/graellsia.2020.v76.271, lire en ligne, consulté le )
- Léon Dufour, Recherches anatomiques et physiologiques sur les hémiptères : accompagnées de considérations relatives à l'histoire naturelle et à la classification de ces insectes, Paris, coll. « Mémoires des savans étrangers », 183-?, 333 p. (lire en ligne), pp. 139-140
- Raymond Poisson, Faune de France. Hétéroptères aquatiques, vol. 61, Paul Lechevalier, , p. 2
- (en) Panizzi, Antônio R. et Grazia, Jocélia, « Introduction to true bugs (Heteroptera) of the neotropics. », dans True bugs (Heteroptera) of the neotropics, Dordrecht, Springer, (lire en ligne), p. 4.
- (en) Schuh, Randall T., « The Influence of Cladistics on Heteropteran Classification », Annual Review of Entomology, vol. 31, no 1, , p. 67-93 (DOI 10.1146/annurev.ento.31.1.67, lire en ligne).
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 16 janv. 2013
- (en) Weirauch, C. & Schuh, R.T., 2011. Systematics and Evolution of Heteroptera: 25 Years of Progress. Annual Review of Entomology, 56, 487-510. Article en ligne
- (en) Xie et al., « 18S rRNA hyper-elongation and the phylogeny of Euhemiptera (Insecta: Hemiptera) », Molecular phylogenetics and evolution, vol. 47, no 2, (lire en ligne).
- (en) Min Li, Ying Tian, Ying Zhao et Wenjun Bu, « Higher Level Phylogeny and the First Divergence Time Estimation of Heteroptera (Insecta: Hemiptera) Based on Multiple Genes », PLoS ONE, vol. 7, no 2, , e32152 (ISSN 1932-6203, PMID 22384163, PMCID PMC3288068, DOI 10.1371/journal.pone.0032152, lire en ligne, consulté le )
- (en) Christiane Weirauch, Randall T. Schuh, Gerasimos Cassis et Ward C. Wheeler, « Revisiting habitat and lifestyle transitions in Heteroptera (Insecta: Hemiptera): insights from a combined morphological and molecular phylogeny », Cladistics, vol. 35, no 1, , p. 67–105 (ISSN 0748-3007 et 1096-0031, DOI 10.1111/cla.12233, lire en ligne, consulté le )
- (en) Yingqi Liu, Fan Song, Pei Jiang et John-James Wilson, « Compositional heterogeneity in true bug mitochondrial phylogenomics », Molecular Phylogenetics and Evolution, vol. 118, , p. 135–144 (DOI 10.1016/j.ympev.2017.09.025, lire en ligne, consulté le )
- BioLib, consulté le 2 avril 2022
- Henri-Pierre Aberlenc (coordination), Les insectes du monde : biodiversité, classification, clés de détermination des familles, Plaissan & Versailles, Museo Éditions & Éditions Quae, (ISBN 978-2-37375-101-7 et 2-37375-101-1, OCLC 1250021162, lire en ligne), tome 1, pp. 506 ss, tome 2 pp. 209 ss
- (en) Randall T. Schuh et Christiane Weirauch, True bugs of the world (Hemiptera, Heteroptera) : classification and natural history., Manchester, Siri Scientific Press, , 800 p. (ISBN 978-0-9957496-9-6 et 0-9957496-9-8, OCLC 1125224106, lire en ligne)
- Cornelia Sauer, Matthias Lutz, Serge Fischer, Lucia Albertoni, Mauro Jermini et Samuel Hauenstein, « Augmentation des signalements d’attaques de diverses espèces de punaises en cultures maraîchères », Extension cultures maraîchères, Agroscope, , p. 3 (info_22_2019_e.pdf)
- Portail de l’entomologie

