Évolution de la communication visuelle
La communication est l’échange d’informations entre un émetteur et un receveur. Dawkins et Krebs (1978) définissent la communication comme étant l’action d’un émetteur qui influence le système sensoriel d’un récepteur, ce qui change le comportement du récepteur au bénéfice du premier, le bénéfice se manifestant par une augmentation de la fitness de l’émetteur[1].
Les signaux sont les véhicules convoyant l’information lors de la communication. Ils sont définis par Otte (1974) comme des caractéristiques morphologiques, physiologiques et comportementales des organismes maintenus par la sélection naturelle parce qu’ils convoient de l’information[2]. On notera cependant que ces traits peuvent transmettre de l’information sans avoir été originellement sélectionnés pour cette fonction (cf. cooptation).
La communication visuelle concerne l’ensemble des interactions s’accordant avec la définition de communication selon Dawkins et Krebs[1], et dont le mode de transmission de l’information est un ou des signaux visuels, c’est-à-dire, un ensemble d‘ondes électromagnétiques visibles, ou encore : de la lumière visible (cf. Nature du signal visuel). Le sens associé à ce moyen de communication est la vue.
La communication visuelle est marquée par plusieurs étapes depuis la production et l'émission du signal jusqu'aux décisions du récepteur basées sur le signal reçu. Les divers mécanismes de l'évolution (dérive génétique, sélection sexuelle (cf. 1.1), sélection sur les traits affectant la survie (cf. 1.2), mutations, migrations) peuvent opérer indépendamment et différemment à chacune de ces étapes.
Mécanismes évolutifs
L’évolution telle que décrite par Charles Darwin dans son ouvrage “De l’origine des espèces par le moyen de la sélection naturelle” (1859) est la transformation des traits des individus d’une population (microévolution), d’une espèce ou d’un clade (macroévolution) dans le temps pouvant mener à la spéciation[3]. Depuis Darwin, de nouveaux éléments ont été ajoutés à la théorie de l’évolution jusqu’à aboutir à une théorie synthétique de l'évolution. Cette théorie reprend la mécanique de la sélection naturelle de Darwin mais inclut également les mécanismes de l'hérédité découvert par Gregor Mendel à la fin du XIXe siècle ainsi que les résultats des travaux en génétique des populations pour expliquer l’évolution comme étant le changement dans le temps de la fréquence des allèles au sein d’une population.
L’évolution repose sur plusieurs mécanismes dont la sélection naturelle, mais pas uniquement. Les mutations génétiques aléatoires, la dérive génétique, et les migrations sont autant de mécanismes qui façonnent l'évolution des populations et des espèces.
La sélection naturelle ne peut s’opérer que si trois conditions sont réunies dans une population :
1/ la population présente une variabilité phénotypique (variabilité d’un trait)
2/ ce trait doit affecter la fitness (la valeur sélective) des individus
3/ ce trait est transmissible par hérédité génétique
La fitness ou valeur sélective représente le succès reproducteur relatif d’un individu dans une population tout au long de sa vie. Il peut être évalué de manière directe par le nombre total de descendants de l'individu atteignant la maturité sexuelle dans la génération suivante[4]. La fitness d’un individu peut-être aussi formalisée comme étant le produit de sa fécondité et de sa survie relativement à celles des autres individus de la population. Les individus avec les meilleures fitness propagent leurs gènes dans la population : il y a évolution. Finalement, la sélection naturelle peut être vue comme le fait que les traits qui favorisent la survie et la reproduction (et donc la fitness) dans un milieu donné voient leur fréquence s'accroître d'une génération à l'autre. En particulier, la sélection s’appliquant sur les traits liés à des différences de succès reproducteur basées sur la variabilité d’accès aux partenaires sexuels est définie comme étant la sélection sexuelle[5].
Ainsi, la sélection naturelle explique l’adaptation des espèces à leur environnement (a minima leur environnement passé récent). Une adaptation évolutive est une caractéristique sélectionnée par la sélection naturelle car elle permet à l’individu d’augmenter sa fitness relative au sein de la population. En conséquence, elle permet à la population de se maintenir car sa fitness moyenne augmente. L’adaptation désigne à la fois le résultat (le trait sélectionné) et le phénomène par lequel les organismes sont en adéquation avec leur milieu.
La communication visuelle, comme toute caractéristique des organismes vivants n’échappe pas aux forces de sélection.
Principe

La sélection sexuelle constitue un moteur majeur dans l’évolution des systèmes de communication visuelle. Darwin est le premier à parler de sélection sexuelle[3]. Chez un grand nombre d’espèces, il observe que les mâles présentent une incroyable diversité de traits et notamment des signaux visuels (couleurs vives, motifs complexes, ornements exagérés) qui ne semblent apporter aucun avantage en termes de survie. Il en résulte un dimorphisme sexuel entre mâles et femelles. Le Paon en est un exemple bien connu : le mâle porte des couleurs vives et déploie une queue impressionnante lors de la parade nuptiale tandis que la femelle porte une queue courte et des couleurs plus ternes (cf. figure 1). Darwin en 1859 explique ces différences par la sélection sexuelle qu’il décrit comme reposant sur « une lutte entre mâles pour la possession des femelles et dont le résultat pour le compétiteur non dominant ne serait pas la mort mais la production de peu ou d’aucun descendants »[3]. La sélection sexuelle se traduit alors par des différences du nombre d’accouplements et donc de fécondité.
Elle repose sur deux mécanismes :
- La sélection intersexuelle : choix du partenaire s’exerçant généralement par les femelles sur les mâles. Cette différence entre mâles et femelles peut s’expliquer par la théorie de Trivers sur l’investissement parental : l’investissement dans la production d’un descendant réduit la capacité du parent à investir dans la production d’autres descendants. Cet investissement est souvent plus important chez les femelles qui deviennent le sexe limitant et optimisent leur fitness par le choix de leurs partenaires[6].
- La sélection intrasexuelle : compétition entre les individus de même sexe (généralement mâles) pour l’accès aux partenaires (femelles)[6].
Évolution de la préférence
Dans le cadre de la sélection intersexuelle, des traits et notamment des signaux visuels (couleurs, motifs, ornements) ayant pour but l’attraction du partenaire sexuel ont pu être sélectionnés s’ils augmentent la fitness de l’émetteur. Ces traits peuvent devenir exagérés si, malgré un coût pour la survie, les individus qui les portent bénéficient d’un fort succès reproducteur via l’attraction des femelles. Pour qu’ils soient sélectionnés, le trait ainsi que la préférence doivent être héritables.
- Hypothèse des signaux honnêtes
Beaucoup de ces traits portés par les mâles permettent d’indiquer à la femelle la qualité du mâle soit en termes de bénéfices directs (protection, apport de nourriture) soit en tant qu’indicateurs de « bons gènes » qui seront transmis à la descendance (survie plus élevée). Ces signaux sont dits honnêtes quand ils indiquent avec exactitude la qualité du mâle (état de santé, vigueur…)[7]. La théorie du handicap formulée par Zahavi (1975)[8] permet d’expliquer l’évolution de ces traits dit « honnêtes » par le fait que ces caractères qui ont évolué par sélection sexuelle confèrent un coût de survie aux individus qui les portent (ex : vulnérabilité aux prédateurs accrue). Certains signaux seraient donc trop coûteux pour être simulés et seraient donc nécessairement « honnêtes »[9].
- Biais sensoriel
Selon cette hypothèse, le trait de préférence préexiste dans le système sensoriel de la femelle qui aurait évolué dans un contexte autre que la sélection sexuelle. Lorsque les mâles développent un trait exploitant cette préférence, ce trait serait alors positivement sélectionné. Des études ont démontré que les femelles de nombreuses espèces avaient tendance à préférer les mâles portant des motifs symétriques. Cette préadaptation du système sensoriel à détecter les motifs symétriques aurait été sélectionnée car apportant un avantage à distinguer les objets par rapport à leur position et leur orientation dans le champ de vision[6].
- Emballement évolutif de Fisher. Selon la théorie de l'emballement évolutif ou runaway développée par Fisher en 1930[10] il existe un rétrocontrôle positif entre le trait porté par le mâle et la préférence chez la femelle :
- Une préférence forte chez la femelle lui permettra de mieux distinguer les mâles porteurs de « bons gènes » et ainsi d’optimiser la fitness de ses descendants.
- Le trait sera d’autant plus avantageux que la préférence sera forte. Cela explique la présence d’ornements extravagants renforçant la détectabilité par les femelles.
Le modèle de Russel Lande[11] montre qu'une liaison génétique ou covariance non nulle entre le trait et la préférence conduit sous certaines conditions à un emballement évolutif. Ces conditions dépendent de la force de cette covariance mais aussi des gradients de sélection sexuelle et de sélection via la survie associée au trait : un emballement évolutif peut se produire lorsque la covariance génétique entre le trait et la préférence ainsi que la sélection sexuelle sont particulièrement fortes.
Principe
La sélection naturelle agit sur l'ensemble des traits affectant la survie des individus[12]. En effet, la fitness d’un individu dépend directement de sa capacité à survivre : pour être en mesure de se reproduire, si possible plusieurs fois, il faut avant tout pouvoir survivre. Les individus survivant mieux peuvent réaliser plus d’événements de reproduction et donc transmettre davantage leurs gènes à la génération future via leurs descendants : leur fitness est supérieure. Mieux survivre, correspond, selon le principe de niche écologique de G.E. Hutchinson (1957)[13], à augmenter sa niche réalisée. D’un point de vue évolutif, des phénotypes ayant une meilleure fitness ont une niche réalisée plus grande car ils sont de meilleurs compétiteurs, mais peuvent aussi avoir une niche fondamentale plus large, en acquérant la capacité à détecter et exploiter de nouvelles ressources. Ces mécanismes d'évolution influencent la capacité à survivre dans une niche donnée, et résultent dans l’évolution des traits biologiques des populations lorsque l'environnement change.
Stratégie de prédation et anti-prédateur
Les pressions dues à la prédation favorisent les proies présentant les meilleures stratégies anti-prédation et les prédateurs les plus performants[14]. Les caractéristiques de communication visuelle sont sélectionnés pour que les proies augmentent leur capacité à échapper aux prédateurs, en les impressionnant (comportement déimatique), en indiquant une dangerosité réelle ou non (aposémantisme, mimétisme, comportement déimatique…), ou encore en se substituant de leur champ visuel (camouflage, encre…). Chez les prédateurs, la compétition se matérialise par une concurrence pour l’accès aux ressources (i.e. les proies) où les capacités visuelles de détection sont fondamentales.
Compétition interspécifique
La compétition interspécifique se matérialise par une compétition pour l’accès à la même ressource (e.g. nourriture, territoire...), par deux espèces différentes[15]. Ici, les capacités visuelles de détection sont fondamentales. Les capacités à effrayer un compétiteur, ainsi qu’à indiquer son territoire entrent aussi en compte.
Compétition intraspécifique
La compétition intraspécifique favorise les individus qui ont une meilleure capacité à survivre que leurs congénères de la même espèce, en particulier lorsqu’une ressource limitante entraîne cette compétition[16]. La ressource peut être nutritive (nourriture, eau...), ou non (nid, terrier, territoire…). Dans ce contexte, la communication visuelle peut fournir des avantages multiples : être impressionnant, mieux distinguer la ressource, marquer visuellement son territoire…
Coûts et compromis évolutifs
Produire et maintenir des structures associées à la communication visuelle représente un coût énergétique pour les organismes alors que leur quantité d’énergie est limitée. Les organismes présentent des stratégies variables d'allocation de l’énergie aux différentes fonctions telles que la survie et la reproduction. Un compromis évolutif ou “trade off” existe lorsque la valeur d’un trait lié positivement à la fitness ne peut augmenter sans la diminution de la valeur d’un autre trait lié à la fitness. C’est l’opposition des deux forces de sélection qui génère ce compromis. Chez les guppys, la variation de la diversité des patterns de coloration résulte d’un compromis entre la sélection naturelle (pression de prédation), et la sélection sexuelle, favorisant une coloration vive[17].
Lorsque les structures associées aux signaux visuels ne représentent plus d’avantage évolutif dans un environnement, ces structures tendent à régresser. Ce coût a été mis en évidence chez le tétra cavernicole Astyanax mexicanus. Le changement dans ses conditions de vie (milieu lotique à un milieu cavernicole) l’ont amené à évoluer au cours du temps et à perdre certains caractères, comme la vue. Il peut alors allouer son énergie dans d’autres fonctions qui maximisent sa fitness[18].
Inertie phylogénétique
L’évolution des individus est modelée par les pressions environnementales mais est aussi contrainte par les caractéristiques intrinsèques des organismes héritées de leurs ancêtres : c’est le principe d’inertie phylogénétique. La trajectoire évolutive passée des organismes influence les possibilités d’évolution future de ces mêmes organismes (i.e. les caractéristiques actuelles déterminent dans quelle mesure l'évolution peut être déviée dans une direction ou une autre, ainsi que la force avec laquelle sa vitesse peut être accélérée ou ralentie[19]. Ainsi, l’inertie phylogénétique peut-être vu comme une capacité de résistance à la sélection.
Du point de vue de la communication visuelle, la taille de l’œil sera par exemple limitée par la plasticité du crâne, en particulier la cavité orbitaire, chez les Vertébrés. Du point de vue des structures émettrices, on ne verra jamais un mammifère arborer un plumage coloré.
Évolution des structures réceptrices
Approche physique
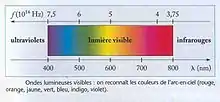
Un signal visuel est un ensemble d’ondes électromagnétiques captées par les structures réceptrices associées à la vue (e.g. l’œil chez la plupart des animaux). Le spectre visible correspond à l’ensemble des longueurs d’onde perçues par un système sensoriel visuel donné (e.g. chez l’Homme : 380 à 780nm). Les variations des longueurs d’onde coïncident avec les variations de perception de couleur. De nombreux organismes possèdent des structures réceptrices de la vision capables de capter la lumière pour des longueurs d’onde inférieures (vision ultra-violette) ou supérieures (vision infra-rouge) aux limites du spectre visible humain (cf. figure 2).
Un objet peut produire sa propre lumière par incandescence (émission de lumière due à la chaleur) ou par luminescence (émission de lumière due à des transitions électroniques au sein des atomes à la suite d'un apport énergétique (i.e. excitation). Dans le monde vivant, certains organismes sont capables de produire leur propre lumière via le phénomène de bioluminescence (cf. 3.4.2.5).
Un objet peut également être une source secondaire de lumière. La couleur qu’il émet est alors le résultat d’interactions multiples entre le spectre de la lumière qui l’éclaire et sa matière. On distingue alors les couleurs pigmentaires, conséquence de l'absorption par les pigments d’une partie du spectre de la lumière incidente, et les couleurs structurelles, conséquence des interactions entre la lumière incidente et la structure de l’objet (effets d’interférences, de diffractions, de diffusions et de réflexions). Dans tous les cas, la couleur d’un objet n’est pas seulement la conséquence de ses propriétés intrinsèques (liées à sa matière) mais dépend également de la qualité de la lumière qui l’éclaire (i.e. la lumière incidente).

Étant donné que le milieu de vie des organismes peut modifier très nettement la qualité de la lumière incidente (généralement issue du soleil), les systèmes de communication visuelle sont soumis à des contraintes environnementales très variables selon le milieu, engendrant des adaptations spécifiques. Une illustration de ce phénomène sont les conséquences des différences d’atténuation des couleurs dans l’océan, selon le gradient de profondeur (cf. figure 3), sur la coloration des organismes marins. En effet, la plupart des organismes mésopélagiques et mésobenthiques sont soit rouges, soit noirs, ce qui, dans cet environnement où la lumière rouge est absente (car absorbée par la colonne d’eau supérieure), favorise le camouflage (cf. 3.4.2.1)). En contrepartie, les prédateurs de la zone ont développé des capacités de bioluminescence (cf. 3.4.2.5)) pour augmenter leur pouvoir de détection des proies[20].
Composantes du signal visuel
La plupart des animaux sont capables de percevoir des signaux visuels et d’en extraire de l’information en analysant leurs différentes composantes: mouvement, forme, luminosité et couleur (saturation et teinte).
Disparités de perception
La perception complexe des signaux lumineux et toutes leurs composantes est le fruit d’une longue évolution depuis la première molécule photoreceptrice jusqu’aux yeux très performants de certains oiseaux, céphalopodes, insectes et mammifères (humains compris) (cf. 2.2))
Tous les organismes ne sont pas égaux face à la perception visuelle. Chaque lignée a suivi un chemin évolutif différent menant vers des adaptations de son système visuel sélectionnées par des pressions évolutives hétérogènes (cf. 1.1) . La vision humaine n’est ni unique, ni même la plus performante du monde vivant. D’autres organismes perçoivent les signaux visuels dans un spectre plus large que le spectre lumineux visible [21], avec une meilleure acuité[22], un champ de vision plus large[23], ou possèdent une plus grande sensibilité à la luminosité[24], et parfois tout cela à la fois dans le cas des crevettes-mantes[25] !
La diversité des structures cognitives associées à la vision (cf. 2.5.3) rend l'expérience sensorielle de la vision unique pour chaque espèce, voir chaque individu. Néanmoins, des similarités peuvent être observées : il a été démontré, entre autres, que les bourdons perçoivent la saturation des couleurs[26] et que les poulets peuvent catégoriser les signaux chromatiques [27] et donc perçoivent la composante de teinte du signal lumineux.
Évolution de l’œil

Histoire évolutive
Nilsson et Pelger[28] ont considéré l’émergence de l’œil comme une succession d’étapes transformant à la fois la physiologie et la morphologie de l’élément récepteur en 1829 étapes à travers 350,000 générations soit 500,000 ans (cf. figure 4). La première innovation est décrite comme l’initiation de cellules photosensibles se développant entre des cellules transparentes et cellules pigmentées. La sensibilisation aux variations lumineuses confère un avantage évolutif dans l’appréhension de l’espace qui a permis aux gastéropodes tels que les patelles d’effectuer des ascensions verticales afin de se nourrir.
L’expansion de la couche photosensible via une courbure de plus en plus prononcée donne une spécificité de détection directive propre à chaque photorécepteur offrant une meilleure acuité visuelle. Cette innovation rend capable d’identifier la direction de la source lumineuse. De plus, la couche cellulaire la plus externe s’imprègne d’un liquide offrant un meilleur indice de réfraction que l’eau, optimisant ainsi la propagation de la lumière à l‘intérieur de la structure. L’expansion courbée se poursuit jusqu’à l’obtention d’un orifice terminant la sphère optique qui protège l’œil d’éventuels dommages. L’acuité visuelle ainsi que la résolution sont améliorées permettant la formation d’une image sommaire sur la rétine. Ces capacités permettent aux animaux de se mouvoir d’une manière plus précise et d’envisager d’établir des interactions visuelles (e.g : relation de prédation nautile/crustacés)
Graduellement, on assiste à une pigmentation au voisinage de l’orifice accroissant encore l’indice de réfraction. Cet îlot pigmentaire qui va donner le cristallin chez les vertébrés agit comme une lentille et va donc concentrer la lumière pour la transporter sur la rétine. Cette lentille primitive sous une forme ellipsoïde se destine à devenir sphérique et va migrer vers le centre de l’œil où l’apparition d’une iris qui dirige l’ouverture focale de la lentille et donc adapte l’œil aux variations de la luminosité vient compléter le processus évolutif. Cela permet en outre aux animaux comme les chats d’avoir une vision nocturne.
À ce stade la structure réceptrice est capable d’identifier un objet de manière nette et précise dans une dimension spatiale et d’adapter une vision par rapport à son environnement.
Aspect phylogénique : homologie ou convergence évolutive ?
L’émergence de l’œil s’est développée de manière indépendante de nombreuses fois dans le règne animal. Malgré tout, des composantes communes existent (opsines, gènes de développement (PAX6), cellules rhabdomériques) et c’est à travers divers processus (duplications, mutations et cooptations) que le système visuel est propre à chacun selon son biotope.
L’ancêtre commun des cnidaires, vertébrés et céphalopodes est pourvu de cellules photoréceptrices qui ont évolué par déterminisme environnemental en une structure réceptrice propre aux besoins de chacun. On trouve alors un arrangement structural différent chez les céphalopodes et les vertébrés.
Soumis à des pressions de sélection adaptatives, l’œil a la capacité d’intégrer de nouveaux types de flux d’échanges à son mode de vie.
Évolution des cellules photoréceptrices
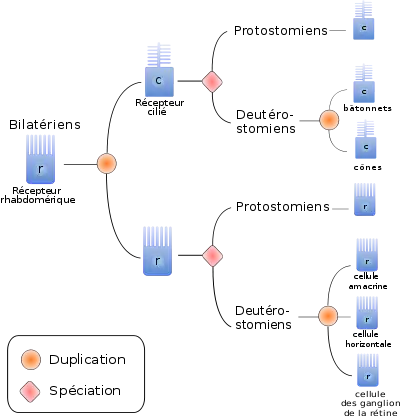
Deux types de cellules photoréceptrices ont probablement évolué chez les Urbilatériens. Chacune a augmenté sa surface membranaire afin de stocker plus de pigments et ainsi améliorer la capture des photons : les cellules ciliées, par multiplication des cils stockant l’opsine c ; les cellules rhabdomériques par expansion apicale stockant des opsines-r.
Chaque type cellulaire implique des mécanismes de communication cellulaire différents déclenchant des réponses physiologiques propres à chacune des cellules permettant une diversité potentielle plus large des systèmes de communication visuelle.
Par exemple, cette diversification des types de cellules photoréceptrices explique la genèse des cellules amacrines d’origine rhabdomérique (cf. figure 5). Ces dernières ont permis de stabiliser le mouvement d’une image en action dans l’œil complexe des Vertébrés permettant ainsi de développer une vision coordonnée avec le mouvement[29].
Évolution des photopigments
Au sein des cellules photorécepteptrices, des molécules transmembranaires sensibles à la lumière permettent la genèse de l’influx nerveux, ce sont les photopigments. On en distingue 2 types : les non-visuels nommés cryptochromes et ceux impliqués dans la vision, qualifiés d‘opsines.
Évolution des opsines en milieu marin
À l’origine les premières opsines (c-opsines) assurent la régénération de leur chromophore (partie sensible à la lumière) grâce à un système enzymatique. L’apparition de r-opsines dont la régénération est assurée par une photoisomérase (enzyme stimulée par l’énergie lumineuse des photons) a abouti à une augmentation de la vitesse de reconversion. Cette évolution primitive, datée avant la division des embranchements des cnidaires et des bilatériens, a permis une amélioration significative de l’efficacité du système visuel, en particulier dans les eaux de surface où l’intensité lumineuse est plus importante[30].
Le fait que les opsines plutôt que les cryptochromes soient devenues usuelles pour la vision ne s’explique pas uniquement par une vitesse de réaction plus élevée mais aussi par une sensibilité spectrale plus large et notamment dans le vert ayant permis une exploration du champ terrestre.
Évolution des opsines en milieu terrestre
La qualité et la quantité de lumière dans le milieu ont contribué au développement des photopigments. La conquête du milieu terrestre, soumis à des variations d’intensité lumineuse fortes, a induit une diversification et une spécialisation des capacités visuelles des organismes via une spécialisation des photopigments. C’est ainsi que des animaux comme le papillon Papilio xantus, possédant huit photorécepteurs, présente une très haute résolution de vision lui permettant de distinguer des variations colorimétriques de l’ordre du nanomètre [31]. Cette évolution a été influencée à la fois par des interactions interspécifiques (i.e. activité de butinage) et intraspécifiques (i.e. motifs de parade sexuelle des ailes).
L’évolution des opsines reflète une réponse adaptative par rapport à un environnement en constante évolution où transite un signal qui doit être capté par une structure visuelle. C’est par des modifications comme des mutations ou duplications que la sensibilité spectrale d’un individu devient optimale pour son usage.
Évolution du système nerveux
Une fois traité par l’œil, l’information perçue est envoyée au système nerveux sous forme de signal bioélectrique. Le système nerveux peut prendre la forme de simples plexus nerveux chez les cnidaires et les vers plats, ou d’un centre nerveux, composé d’un cortex cérébral (avec cortex visuel) ou de ganglions. Les neurones spécialisés dans la perception sensorielle répondent sélectivement à une information précise, comme l’agencement dans l’espace, les couleurs, la luminosité, les formes… Dans le cerveau, certaines parties sont dédiées à des traitements spécifiques de l’information visuelle, comme la position dans l’espace. Chez l’Homme, 30 % du cortex cérébral participe à la vision[32].
Structures cognitives et évolution de la communication visuelle
Les structures cognitives de la vision ont influencé la communication visuelle à travers de nombreux mécanismes. Traiter toutes les informations visuelles est trop coûteux en énergie. Des mécanismes d’attention qui permettent la concentration sur certaines informations seulement, tout en ignorant ou diminuant les autres, sont apparus. En jouant sur ce mécanisme, certaines espèces d’insectes forment des essaims où l’accumulation de mouvements rend plus difficile la concentration sur une cible précise[33].
L'incapacité à traiter l’ensemble des informations induit l’apparition d’un trade-off entre la vitesse de décision et l'exactitude du traitement du signal visuel[34]. En effet plus un individu prend du temps pour choisir une ressource parmi d’autres, moins il n’en aura pour la récolter, l’utiliser ou la communiquer à ses congénères. On trouve ce genre de trade-offs dans la prédation, mais aussi dans le choix des fleurs par les abeilles[35]. Il en va de même pour l’estimation du mâle le plus attractif lors de la sélection intersexuelle.

Des biais du système sensoriel sont présents dans les structures cognitives. Par exemple, la coloration rouge du ventre du mâle épinoche Gasterosteus aculeatus (cf. Figure 6) est probablement due à une pression de sélection venant de la préférence des femelles envers les nourritures rouges[36].
Les biais acquis par apprentissage sont sans doute aussi importants pour l’évolution des signaux que les biais du système sensoriel[37]. Il peut s’agir d’apprendre à éviter les animaux aposématiques ou de l’apprentissage de la reconnaissance de fleurs les plus nutritives par les abeilles. On appelle ces changements dans la réponse à un stimulus discriminé par apprentissage, des « changements de pics ».
Évolution des signaux visuels
Mécanismes d'apparition et de renforcement
Un signal lumineux devient un signal visuel lorsqu'une information transmise entre l’émetteur et le receveur y est associée et que celle-ci entraîne une modification du comportement du receveur au profit de l’émetteur. On peut ainsi décrire divers mécanismes permettant la conversion d’un signal lumineux neutre en un signal visuel utilisé pour communiquer.
La cooptation consiste en l’adoption d’une caractéristique morphologique, physiologique ou comportementale déjà présente chez l’organisme dans un but de communication. Dans ce cas, le trait qui transmet l’information visuelle n’a pas été sélectionné originellement pour cet usage. Un exemple classique est l’utilisation de photopigments comme la mélanine pour former des motifs utiles pour le camouflage (cf. 3.4.2.1)) alors que sa fonction première est la protection contre les rayonnements UV grâce à sa forte capacité d'absorption[38].
La ritualisation consiste en l’association d’une signification à un signal originellement neutre à la suite de la répétition, exagération et codification de ce signal. La valeur informative du signal s'accroît avec sa visibilité et sa clarté. Chez les humains par exemple, l’agitation de la main en guise de salutation est considérée comme dérivant du temps où les gens portaient des armes et montraient leurs mains vides avant d’approcher un étranger. Maintenant, ce comportement s’est transformé en signal, même en l’absence d’armes[39].

Une fois le signal visuel présent, sa valeur informative peut être renforcée par deux procédés: la stéréotypie et la redondance. La stéréotypie consiste en la réduction de la variation du signal ce qui entraîne une augmentation de sa clarté et de sa détectabilité : le signal est codifié. La redondance consiste en l’utilisation de multiples signaux (visuels) pour transmettre la même information permettant là aussi de limiter la confusion et d’augmenter la clarté du message. Un exemple célèbre est le comportement défensif du lézard à collerette (Chlamydosaurus kingii). Lorsqu’il cherche à effrayer un prédateur ou un concurrent, ce lézard australien se redresse sur ses pattes avant, ouvre sa gueule pour exposer une bouche revêtue de rose ou jaune brillant, et déploie son imposante collerette veinée de rouge vif (cf. Figure 7). La multiplication des signaux visuels ne rend que plus claire l’information que cherche à transmettre le lézard à son opposant[40].
Compromis évolutif entre détectabilité et fiabilité
Les signaux visuels permettent difficilement de maximiser à la fois leur détectabilité (optimisation de la forme) et leur fiabilité (optimisation du fond, de l’information). Ainsi, un facteur important de divergence concerne le trade-off entre ces deux propriétés des signaux visuels. Certains organismes seront sélectionnés car ils présentent un signal aisément détectable quand d’autres seront favorisés par la fiabilité de leur signal. Ces organismes emprunteront ainsi un chemin évolutif différent menant à une diversification des signaux visuels.
Un exemple explicite de ce trade-off est proposé par les plantes à fruits charnus de la jungle vénézuélienne. Schaefer et Schmidt (2004) ont en effet montré que la couleur de ces fruits divergeaient selon une dichotomie : couleur associée au contenu (l’information), ou couleur associée à la détectabilité. En effet, les fruits les plus contrastés par rapport au feuillage vert (i.e. les fruits rouges) ne donnent pas d’information quant à leur contenu nutritif ; alors que les fruits aux couleurs moins contrastées (i.e. du vert au orange) sont moins facilement détectables mais fournissent une indication quant à leur teneur en sucres, protéines et tanins[41]. On observe donc que les plantes locales suivent deux stratégies bien différentes pour attirer les animaux frugivores qui disperseront leurs graines. Cette dichotomie de stratégies entre une détectabilité ou une fiabilité de l’information transmise est un mécanisme majeur de la divergence des signaux qui explique leur grande diversité actuelle.
- Cas de la sélection sexuelle
Une étude réalisée par Schluter et Price en 1993[7] a montré que la détectabilité, c'est-à-dire la précision avec laquelle les femelles sont capables de percevoir la différence entre les mâles, joue un rôle majeur dans l’évolution à la fois de l’ornement et de la préférence.
À partir de formulations mathématiques des valeurs de la fitness du mâle et de la femelle, une valeur d'équilibre pour la préférence chez la femelle émerge telle que :
avec :
: valeur à l'équilibre de la préférence chez la femelle
: avantage de fécondité lié à la condition/qualité du mâle = bénéfice pour la femelle de s’accoupler avec ce mâle
: précision avec laquelle la femelle peut distinguer les différences entre mâles = détectabilité du trait
: honnêteté du trait mâle
: paramètre inversement proportionnel au coût de la préférence permettant de prendre en compte la forme de la courbe de survie en fonction de la valeur de y
Ce résultat montre l’influence positive à la fois de l’honnêteté et de la détectabilité du trait sur la préférence femelle. La préférence d’un trait peut également augmenter même si le trait n’est pas tout à fait honnête si la détectabilité du trait est suffisamment importante. En prenant en compte deux paramètres, Schluter et Price ont démontré que la femelle devrait favoriser un trait maximisant le produit (honnêteté)*(détectabilité). Un signal visuel moins honnête pourrait donc remplacer un signal honnête si sa détectabilité est suffisamment importante.
Impact de la stochasticité environnementale

L’environnement affecte la transmission et la perception des signaux visuels. De plus, la variabilité constante de l’environnement dans le temps et l’espace oblige les organismes à s’adapter constamment et à acquérir de nouvelles caractéristiques maximisant de nouveau la détectabilité ou la fiabilité de leurs signaux visuels. Ainsi, des différences géographiques dans les mécanismes de perceptions et les comportements de signalisation sont observables en fonction des propriétés physiques des habitats.
Par exemple, les habitats mésiques et xériques diffèrent par la qualité et la quantité de leur lumière ambiante car ils ont un couvert végétatif filtrant la lumière incidente très différent[42]. Il a été observé que les populations de lézards Anolis (Anolis sp.) diffèrent dans la coloration de leur fanon gulaire (cf. Figure 8), un signal sexuel, de telle façon que la couleur arborée présente une meilleure détectabilité, spécifique de l’habitat du lézard. Ces différences de coloration des appendices de parade sexuelle a aussi mené vers une divergence des préférences sexuelles des femelles entre habitats[43]. Ainsi la variabilité environnementale peut non seulement générer de la diversité dans les signaux de communication visuelle mais aussi pousser à la spéciation par isolation reproductive. Ce mécanisme de spéciation par divergence d’attributs sexuels et de préférences apparaît même possible dans des cas d’espèces parapatriques dans un milieu contrasté avec un gradient de luminosité (cas des poissons cichlidés dans le lac Victoria[44]).
Types de signaux
Les signaux visuels peuvent différer par leur nature même mais aussi de par le type d’information qu’ils convoient.
Il y a des signaux visuels de trois natures différentes :
- les motifs et couleurs (ex : le plumage coloré des oiseaux servant à attirer leur partenaire sexuel)
- les mouvements (ex : les crabes violonistes (Uca pugilator) agitant leur pince surdimensionnée pour impressionner un compétiteur ; la danse des abeilles (cf. 4.1.2))
- la production primaire de lumière (ex : les lucioles ; les organismes bioluminescents des profondeurs (cf. Bioluminescence)
Ces signaux peuvent transmettre une information précise sur le trait, la valeur de l’émetteur : on parle alors de signaux honnêtes. À l’inverse, il arrive aussi que les signaux trompent le receveur sur la valeur de l'émetteur, au profit de l'émetteur, en transmettant une information imprécise voire totalement erronée : on parle alors de signaux malhonnêtes[45].
Les signaux honnêtes sont favorisés sous certaines conditions :
- lorsque l’émetteur et le récepteur partagent un but commun (e.g. l’aposématisme (cf. 3.4.2.2)).
- lorsque le signal est impossible à falsifier. Par exemple, la taille des mandibules chez les lucanes cerf-volant (Lucanus cervus) est un indicateur direct de leur compétitivité lors des combats pour l’accès aux femelles qui peut-être évalué par des compétiteurs potentiels sans possibilité de falsification[45].
- lorsque les signaux sont coûteux à falsifier : cf. théorie du handicap d’Amotz Zahavi[8] (cf. 1.1.2))
Les signaux malhonnêtes sont favorisés dans des conditions opposées :
- quand l’émetteur et le receveur ont des objectifs différents (ex: les fleurs qui ne produisent pas de nectar trompent leur pollinisateur en exhibant des couleurs vives[46].
- quand les signaux sont coûteux ou complexe à évaluer (ex: le mimétisme Batésien (cf. 3.4.2.3))
Pigments
La synthèse ou l’utilisation de pigments biologiques est impliquée dans de nombreux processus et constitue un outil majeur en communication visuelle. Un pigment biologique est une substance synthétisée par un organisme qui confère une couleur aux cellules qui la contiennent. Il existe une multitude de couleurs possibles appartenant à différentes familles de molécules (ex : les caroténoïdes, les mélanines, les anthocyanes…). La sensibilité spectrale de nombreux groupes taxonomiques s’est relativement conservée au cours du temps, alors qu’au contraire les couleurs émises par les pigments synthétisés ont dû s’adapter en fonction du destinataire. En effet, chez les abeilles, la sensibilité des photorécepteurs a évolué bien avant l’apparition des premiers angiospermes. Les pigments synthétisés par les fleurs ont dû être sélectionnés pour être détectables par les insectes pollinisateurs. Par ailleurs, les couleurs émises par les fleurs sont beaucoup plus stimulatrices pour les photorécepteurs des abeilles alors que celles des fruits le sont pour les primates consommateurs de fruits[47].
Les pigments synthétisés doivent aussi être détectables dans l’environnement pour constituer un signal visuel efficace, c'est-à-dire contrastés par rapport à l’arrière-plan. Le destinataire du signal visuel doit être capable de les distinguer par rapport aux éléments qui l’entourent[47].
Des facteurs abiotiques peuvent aussi agir directement sur le pigment synthétisé : chez le Sureau noir, la synthèse d’une coloration rouge peut être stimulée par une forte exposition au soleil. Les fruits ayant reçu une quantité de lumière importante étant plus sucrés, la couleur rouge envoie un signal aux consommateurs leur indiquant la qualité des fruits[46],[48].
Motifs
Les motifs colorés ont un rôle dans la communication visuelle des animaux. Les colorations des animaux peuvent évoluer pour répondre à plusieurs grandes catégories de fonction : camouflage, signaux visuels (toxicité, parade sexuelle), thermorégulation. Suivant la force de sélection, l’évolution des motifs peut être plus ou moins rapide.

Il existe de nombreux motifs colorés ayant évolué par sélection sexuelle. L’existence de tels motifs va souvent à l’encontre de la survie des individus mais présente une certaine efficacité auprès des partenaires sexuels ou des compétiteurs sexuels. Par exemple, une tache de pigment noir (cf. Figure 9) présente au bout des ailes de drosophile mâle est associée à un comportement de parade sexuelle, lorsque le mâle déploie ses ailes devant la femelle qu’il courtise. Les mâles ne présentant pas de tache n’ont pas ce comportement. L'apparition et la modification au cours du temps de ce motif peuvent être expliquées par des mécanismes génétiques : l’émergence de ce motif pigmentaire est due à des mutations qui ont rendu capables les gènes impliqués dans la production du pigment de répondre à des gènes jouant un rôle dans l’établissement des différentes parties du corps et en particulier au bout de l'aile, dans la région de la tâche[49].

Morphologie
La communication visuelle peut aussi passer par divers ornements (bois, plumes rectrices, crête, collerette). Certaines morphologies peuvent être extravagantes mais néanmoins sélectionnées positivement car elles interviennent dans la sélection sexuelle ou qu'elles affectent favorablement la survie des individus. Chez l’Euplecte à longue queue, Euplectes progne (cf. Figure 10), on observe un dimorphisme sexuel important entre le mâle et la femelle. Les mâles à longues rectrices sont choisis par les femelles et ont un plus fort succès reproducteur[50].
Influencées par la sélection sexuelle
La présence de nombreux caractères et notamment de signaux visuels peut s’expliquer par la sélection sexuelle lorsque ces caractères sont associés à un meilleur succès reproductif. Parmi les différentes études réalisées, ces caractères sont particulièrement présents chez les insectes, les oiseaux, les amphibiens et les poissons[6].

Les paradisiers ou oiseau de paradis (cf. Figure 11) sont connus pour exhiber à la fois des plumages colorés et des structures impressionnantes ayant évolué par sélection sexuelle. Ces structures ou ornements sont faits à partir de plumes modifiées au niveau de la queue, de la tête ou des ailes. Ces caractères ou signaux visuels sont utilisés par les mâles pour attirer les femelles et constituent une stratégie de communication majeure dans le cadre de la sélection sexuelle. Les paradisiers possèdent généralement une combinaison de plusieurs signaux visuels car ils subissent une sélection sexuelle particulièrement forte [51]
En plus de l’évolution de signaux visuels, des comportements peuvent venir renforcer la visibilité du signal (posture, choix du moment de la journée, modification active de l’environnement).
Le camouflage

Le camouflage est une stratégie qui vise à réduire la détection par le prédateur ou la proie. Par des signaux visuels, l’animal qui se camoufle trompe la perception du destinataire, on parle de signaux malhonnêtes. Dans le cas d’un prédateur, le but est d’augmenter ses chances de capture de la proie en se dissimulant à elle, et dans le cas d’une proie d’augmenter ses chances d’échapper à la prédation. Le camouflage implique de posséder des couleurs et/ou des motifs qui permettent de se confondre avec l’environnement[52].
Thayer(1909) distingue deux formes de camouflage :
- La coloration cryptique qui permet à l’animal de se confondre avec le fond de son environnement (background matching) ou à mimer un élément qui s’y trouve (ex. : poisson pierre cf. figure 12).

- La coloration disruptive qui permet de rompre la silhouette, l’unité visuelle du corps à l’aide de motifs très contrastés. Ces motifs sont plus susceptibles d’être localisés en périphérie du corps. Ce mécanisme fonctionne car le système visuel des vertébrés est sensible aux lignes utilisées pour décomposer l’information visuelle en différentes échelles spatiales[52]. La coloration disruptive serait une méthode de camouflage encore plus efficace que la coloration cryptique[53]. Les bandes noires et blanches du zèbre est un exemple de coloration disruptive (cf. figure 13).
L'aposématisme
_(8593173385).jpg.webp)
L’aposématime est défini comme la mise en place d’un signal d’avertissement chez un individu afin de faire part de sa non-profitabilité pour les prédateurs potentiels. Dans un cadre visuel, ce mécanisme se met en place par l‘intermédiaire de motifs tels que des tâches ou des stries généralement vivement colorées donnant une potentialité de détection supérieure dans l’environnement (cf. figure 14).
De nombreuses théories relatent l’origine de ce dispositif ainsi que son évolution :
Wallace fut un des premiers en 1867 à suggérer que l’aposématisme serait un moyen de renforcer la conscience de l’indigestabilité de la proie par association couleurs/goût. Ce processus serait davantage efficace qu’il associerait de manière innée les couleurs vives à une dangerosité[54].
Une autre hypothèse avancée expose que le caractère couleur fut initié dans la sélection sexuelle.
Une idée supporte un gène d’aposématisme récessif sur le chromosome x et s’étend chez les femelles quand le signal est compris par le prédateur[54].
L’origine de l’aposématisme n’est pas clairement définie car soutenue par de nombreuses théories. Malgré tout, on pose la relativité du mécanisme comme étant intrinsèquement liée à sa densité de fréquence [55]. La dynamique des motifs colorés est soumise à une co-évolution entre prédateurs et proies poussant l’un et l’autre à développer d’autres innovations pour se concurrencer mutuellement.
Le mimétisme
Le mimétisme est la ressemblance entre différentes espèces. Il peut être une stratégie anti prédation: une espèce imite la forme, couleur ou l’allure d’une autre espèce qui sert de signal d’avertissement envers un prédateur.
Il existe deux grandes formes de mimétisme qui favorisent la survie en améliorant les capacités de l’individu à échapper aux prédateurs:
- Le mimétisme batésien (malhonnête) avec l'implication de trois acteurs différents: une espèce modèle nocive (modèle), un imitateur de l’espèce modèle qui est inoffensif (mime) et le troisième acteur est un prédateur de ces espèces (dupe). Cela implique donc un fort mécanisme de co-évolution entre ces trois organismes. L’espèce imitatrice va prendre la forme, la couleur ou l’allure de l’organisme modèle pour survivre. Le prédateur apprend ainsi à éviter cette espèce par reconnaissance visuelle des motifs et couleurs. Ce mimétisme est dépendant de la fréquence car une augmentation de l’abondance du mime mène à la dégradation du signal d’avertissement. En effet, les prédateurs risquent de comprendre que dans de nombreux cas le signal de toxicité n’est pas honnête[56].
- Le mimétisme müllérien (honnête), proposé par Fritz Müller en 1879 est un phénomène montrant la convergence de deux proies nocives et non apparentées vers un même morphe utilisé comme signal d’avertissement envers les prédateurs. Ces espèces auraient évolué vers une apparence similaire car celle-ci est avantageuse pour les deux organismes. Ce mimétisme a un effet densité dépendance car les prédateurs apprennent d’autant plus vite qu’il faut éviter ces organismes lorsque ceux-ci sont abondants[57].
Les comportements déimatiques

Un comportement déimatique est l’ensemble des stratégies anti-prédation qui implique l’intimidation ou la surprise d’un prédateur par sa proie par le biais d’artifices visuels. La proie peut alors espérer échapper à son prédateur qui est effrayé, désorienté ou simplement distrait par l’effet de surprise.
Les mantes religieuses sont connues pour exhiber un comportement déimatique lorsqu’un prédateur avisé les a repérées malgré leur camouflage. Dans ce cas, les mantes déploient leurs ailes postérieures vivement colorées, se dressent sur leurs pattes postérieures et écartent et agitent leur pattes antérieures préhensiles en guise de menace (cf. Figure 15). Ce comportement visuel est souvent accompagné d’une stridulation forte rendant l’animal d’autant plus impressionnant pour un prédateur[58].
Chez les experts du camouflage que sont les céphalopodes, les comportements déimatiques sont très communs. La seiche commune (Sepia officinalis), lorsqu’elle se sent menacée, est capable d'aplatir son corps, faire pâlir sa peau et faire apparaître des paires d’yeux entourés par des anneaux noirs sur son manteau. Par le jeu de contractions de ces cellules pigmentaires spécialisées associés à des cellules musculaires et nerveuses dans le tégument, elle simule la dilatation des pupilles de ses faux yeux pour effrayer et surprendre son adversaire[59]. De plus, de nombreux céphalopodes sont capables d’expulser de l’encre pour désorienter leur prédateur temporairement, leur laissant le temps de s’enfuir puis de se fondre dans l’environnement en utilisant leur camouflage perfectionné.
La bioluminescence
La bioluminescence est la production et l’émission de lumière par un organisme (cf. Figure 16). Elle est apparue de nombreuses fois dans l'évolution et a été observée chez plus de 700 espèces.
Il existe différentes utilisations de la bioluminescence dans le cadre de la communication visuelle, comme :
- l’attraction des proies ; c’est le cas notamment dans de nombreuses espèces abyssales, comme les Lophiiformes ;
- la protection contre les prédateurs. Certains poissons et céphalopodes vivant en zone mésopélagique l’utilisent comme camouflage : ils simulent la lumière incidente de la surface, ce qui les cache aux yeux de leurs prédateurs qui chassent en dessous d’eux. D’autres céphalopodes abyssaux produisent, quand ils se sentent menacé, un nuage bioluminescent de la même façon que les nuages d’encre[60].
Co-évolution
De nombreux systèmes de communication visuelle consiste en des interactions entre de multiples émetteurs et receveurs dont l’abondance relative conditionne les pressions évolutives agissant sur le design de la communication visuelle[46].
Lorsque les interactions résultent en un bénéfice pour les deux parties, on parle de mutualisme. Lorsque les intérêts des deux parties s’opposent, il y a antagonisme. La répétition des interactions influence réciproquement les trajectoires évolutives de chacun des protagonistes : on parle alors de co-évolution.
Co-évolution animal-plante

Il existe de nombreux exemples de co-évolution entre plantes et animaux pollinisateurs. Chaque espèce évolue en réponse aux pressions imposées par l’autre espèce avec laquelle elle interagit. Chez certaines orchidées du genre Ophrys, le labelle ressemble au pollinisateur qui vient s’y poser pour butiner (cf. figure 17). Celui-ci est alors attiré par le cœur de la fleur et va ainsi permettre à l’orchidée d’être pollinisée[61].
La co-évolution mène à une très grande spécificité: certaines plantes ne peuvent être fécondées que par une seule espèce d’insecte.
Coopération intraspécifique
Des comportements de coopération, c’est-à-dire d’association non obligatoire apportant un bénéfice mutuel, ont permis également de sélectionner des systèmes de communication visuelle sophistiqués. Les espèces sociales en sont un bon exemple car beaucoup de comportements sociaux reposent sur des systèmes de communication, notamment visuels. Ces comportements collectifs leur permettent d’accroître leur fitness et ont donc pu être sélectionnés au cours de l’évolution.

Il a été montré que les abeilles sont capables de se communiquer l’emplacement de sources de nourritures particulièrement riches en effectuant des mouvements répétitifs en forme de huit (cf. Figure 18). Ce comportement, appelé danse des abeilles, leur permet d’indiquer à leur congénères la distance et la direction de la source de nourriture ce qui permet d’améliorer la recherche de nourriture. Ce comportement est particulièrement présent dans les habitats où la nourriture est dispersée de manière hétérogène et particulièrement dans les habitats tropicaux[62].
Chez les primates, les échanges communicatifs sont basés sur des gestes, des expressions faciales et des vocalisations. Cependant la communication gestuelle est le mode de communication qui montre la plus grande flexibilité et serait aux origines du développement du langage chez l’Homme. La communication gestuelle peut être définie comme un mode de communication impliquant des mouvements intentionnels des mains, des pieds ou des membres. Les signaux envoyés peuvent avoir des significations complexes et variées : évitement des prédateurs, défense de territoire, voyage en groupe, recherche de nourriture… Ce mode de communication a pu se mettre en place par des processus de ritualisation et a nécessité le développement d’une grande flexibilité cognitive à la fois pour la production et la réception du signal visuel[63].
Co-évolution antagoniste
La coévolution antagoniste sont les changements évolutifs entre deux ou plusieurs espèces, qui affectent mutuellement les traits de l’autre, chaque trait ayant un impact négatif sur l’autre groupe.
Modèle théorique
La course aux armements[64] est une métaphore pour parler de la co-évolution des traits entre les groupes antagonistes. Elle décrit l’émergence de nouveaux traits, dus à la pression de sélection entre les groupes. Dans le cadre de la communication visuelle, cela se traduit par la co-évolution d’un émetteur envoyant des signaux malhonnêtes et un récepteur. En effet, le receveur est avantagé s’il acquiert la capacité à différencier les signaux malhonnêtes des signaux honnêtes ; à l’inverse, l’émetteur est avantagé si son signal malhonnête n’est pas reconnaissable. On assiste alors à une course évolutive (appelée Hypothèse de la reine rouge[65]) entre l’émetteur et le receveur où l’équilibre est nécessairement dynamique pour assister à la cohabitation des deux protagonistes sur le long terme. Cette course mène vers un perfectionnement des systèmes sensoriels chez le receveur et des mécanismes de falsification du signal chez l'émetteur.
Types de conflits
Dans la co-évolution antagoniste, on distingue les conflits symétriques (les antagonistes ont le même but) et asymétriques (les antagonistes ont des buts différents).
Les conflits symétriques regroupent les interactions de compétition pour des ressources entre espèces différentes (ex : deux pollinisateurs attirés par une même fleur).
Les conflits asymétriques regroupent les cas de prédations, d’herbivories[66], et de parasitismes. Le parasitisme fait pression sur la communication visuelle : par exemple, la couleur des œufs et des poussins des coucous changent en fonction de l’hôte afin de mieux tromper les parents parsités[67].
Notes et références
- (en) Dawkins, R., & Krebs, J. R., « Animal signals: information or manipulation. », Behavioural ecology: An evolutionary approach, 2, , p. 282-309
- (en) Otte, D., « Effects and functions in the evolution of signaling systems. », Annual Review of Ecology and Systematics, , p. 385-417
- (en) Charles Darwin, On the Origin of Species by means of Natural Selection,
- (en) Hunt, J., & Hodgson, D., « What is fitness, and how do we measure it? », Evolutionary Behavioral Ecology, , p. 46-70
- (en) Arnold, S. J., & Wade, M. J., « On the measurement of natural and sexual selection: applications. », Evolution, , p. 720-734
- (en) Andersson, M., & Iwasa, Y., « Sexual selection », Trends in ecology & evolution 11(2), , p. 53-58
- (en) Schluter, D., & Price, T, « Honesty, perception and population divergence in sexually selected traits », Proceedings of the Royal Society of London B: Biological Sciences, 253(1336), , p. 117-122
- (en) Zahavi, A ., « Mate selection—a selection for a handicap », Journal of theoretical Biology, 53(1), , p. 205-214
- (en) Torres, R., & Velando, A., « Male preference for female foot colour in the socially monogamous blue-footed booby, Sula nebouxii », Animal Behaviour,69(1), , p. 59-65
- (en) Fisher, R.A., « The Genetical Theory of Natural Selection », The Genetical Theory of Natural Selection, Clarendon Press, Oxford,
- (en) Lande, R., « Models of speciation by sexual selection on polygenic traits », Proceedings of the National Academy of Sciences, 78(6), , p. 3721-3725
- Danchin, Giraldeau & Cézilly. Dunod, Ecologie Comportementale, , p. 39
- Hutchinson, G.E., « Concluding remarks », Cold Spring Harbor Symposia on Quantitative Biology, , p. 415–427 (lire en ligne)
- (en) Gause, G. F., Smaragdova, N. P., & Witt, A. A., « Further studies of interaction between predators and prey », The Journal of Animal Ecology,
- (en) Gause, G. F., « Experimental analysis of Vito Volterra’s mathematical theory of the struggle for existence », Science, , p. 79(2036), 16-17
- Campbell, J. R., Biologie, 7e édition, 2007, concept 52.2
- (en) Endler, J. A., « Natural selection on color patterns in Poecilia reticulata. », Evolution, 34(1), , p. 76-91
- Protas, M., Conrad, M., Gross, J. B., Tabin, C., & Borowsky, R., « Regressive evolution in the Mexican cave tetra, Astyanax mexicanus. », Current biology, 17(5), , p. 452-454
- (en) Wilson, E. O., Sociobiology., Harvard University Press.,
- (en) Johnsen, S., « The red and the black: bioluminescence and the color of animals in the deep sea. », Integrative and comparative biology, 45(2), , p. 234-246
- (en) Horth, L., Campbell, L., & Bray, R., « Wild bees preferentially visit Rudbeckia flower heads with exaggerated ultraviolet absorbing floral guides. », Biology open, 3(3), , p. 221-230
- (en) Gaffney, M. F., & Hodos, W., « The visual acuity and refractive state of the American kestrel (Falco sparverius) », Vision research, 43(19), , p. 2053-2059
- (en) Jones, M. P., Pierce, K. E., & Ward, D., « Avian vision: a review of form and function with special consideration to birds of prey. », Journal of Exotic Pet Medicine, 16(2), , p. 69-87
- (en) Somanathan, H., Borges, R. M., Warrant, E. J., & Kelber, A., « Visual ecology of Indian carpenter bees I: light intensities and flight activity. », Journal of Comparative Physiology A, 194(1), , p. 97-107
- (en) Marshall, J., & Oberwinkler, J., « Ultraviolet vision: The colourful world of the mantis shrimp. », Nature, 401(6756),, , p. 873-874
- (en) Lunau, K., Wacht, S., & Chittka, L., « Colour choices of naive bumble bees and their implications for colour perception. », Journal of Comparative Physiology, 178(4), , p. 477-489.
- (en) Jones, C. D., Osorio, D., & Baddeley, R. J., « Colour categorization by domestic chicks. », Proceedings of the Royal Society of London B: Biological Sciences, 268(1481),, , p. 2077-2084.
- (en) Nilsson Dan-eric and Pelger Susanne, « A pessimistic estimate of the time required and eye to evolve », Biological sciences, Vol 256,No.1345, , p. 53-58
- (en) Detlev Ardent, « Evolution of eyes and photoreceptor cell types », Dev. Biol. 47, , p. 563-571
- (en) Nilsson Dan-Eric, « The evolution of eyes and visually guided behaviour », Phil. Trans. R. Soc. B, , p. 2833–2847
- (en) Osorio D andVorobyev, M., « A review of the evolution of animal colour vision and visual communication signals », Vision research, 48(20), , p. 2042-2051
- Référence:Biologie (Campbell), concept 52.2
- (en) Milinski, M., « A predator's costs of overcoming the confusion-effect of swarming prey », Animal Behaviour,
- (en) Chittka, L., Skorupski, P., & Raine, N. E., « Speed–accuracy tradeoffs in animal decision making. », Trends in Ecology & Evolution, 357(1427), , p. 1539-1547
- (en) Burns, J.G. and Dyer, A.G., « Diversity of speed-accuracy strategies benefits social insects. », Curr. Biol. 18, R953–R954,
- (en) Smith, C. et al., « A receiver bias in the origin of three-spined stickleback mate choice. », Proc. R. Soc. B 271, , p. 949–955
- (en) ten Cate, C., & Rowe, C., « Biases in signal evolution: learning makes a difference. », Trends in ecology & evolution, 22(7),
- (en) Jimbow, K., Quevedo, W. C., Fitzpatrick, T. B., & Szabo, G., « Some aspects of melanin biology : 1950–1975 », Journal of Investigative Dermatology, 67(1),, , p. 72-89
- (en) Waal, F., « Darwin's legacy and the study of primate visual communication. », Annals of the New York Academy of Sciences, 1000(1), , p. 7-31
- (en) Shine, R., « Function and evolution of the frill of the frillneck lizard, Chlamydosaurus kingii (Sauria: Agamidae). », Biological Journal of the Linnean Society, 40(1),, , p. 11-20
- (en) Schaefer, H. M., & Schmidt, V., « Detectability and content as opposing signal characteristics in fruits. », Proceedings of the Royal Society of London B: Biological Sciences, 271(Suppl 5),, , S370-S373.
- (en) Endler, J. A., « The color of light in forests and its implications. », Ecological monographs, 63(1), , p. 1-27
- (en) Leal, M., & Fleishman, L. J., « Differences in visual signal design and detectability between allopatric populations of Anolis lizards. », The American Naturalist, 163(1), , p. 26-39.
- (en) Terai, Y., Seehausen, O., Sasaki, T., Takahashi, K., Mizoiri, S., Sugawara, T., ... & Tachida, H., « Divergent selection on opsins drives incipient speciation in Lake Victoria cichlids. », PLoS Biol, 4(12),, , e433.
- (en) Breed, M. D., & Moore, J., Animal behavior, Academic Press., , Chapter 7: Communication
- (en) Schaefer, H. M., Visual communication: evolution, ecology, and functional mechanisms. In Animal behaviour: evolution and mechanisms, Springer Berlin Heidelberg., , pp. 3-28
- (en) Osorio, D., & Vorobyev, M., « A review of the evolution of animal colour vision and visual communication signals. », Vision research, 48(20), , p. 2042-2051
- Schaefer, H. M., & Braun, J., « Reliable cues and signals of fruit quality are contingent on the habitat in black elder (Sambucus nigra) », Ecology, 90(6), , p. 1564-1573
- (en) Laurent Arnoult, Kathy F. Y. Su, Diogo Manoel, Caroline Minervino, Justine Magriña, Nicolas Gompel, Benjamin Prud'homme, « Emergence and Diversification of Fly Pigmentation Through Evolution of a Gene Regulatory Module », Science,
- (en) Andersson, « Female choice selects for extreme tail length in a widowbird », Nature,
- (en) Moller, A. P., & Pomiankowski, A., « Why have birds got multiple sexual ornaments? », Behavioral Ecology and Sociobiology, 32(3), , p. 167-176
- (en) Stevens, M., « Predator perception and the interrelation between different forms of protective coloration », Proceedings of the Royal Society of London B: Biological Sciences, 274(1617), , p. 1457-1464
- (en) Cuthill, I. C., Stevens, M., Sheppard, J., Maddocks, T., Párraga, C. A., & Troscianko, T. S., « Disruptive coloration and background pattern matching », Nature, 434(7029), , p. 72-74
- (en) Martin Stevens, Graeme D. Ruxton, « Linking the evolution and form of warning coloration in nature », The royal society,
- (en) Emma Despond and Stephen J. Simpson, « Surviving the change to warning colouration: density-dependent polyphenism suggests a route for the evolution of aposematism, », Chemoecology 15, , p. 69–75
- (en) Darst, C. R., & Cummings, M. E. ,, « Predator learning favours mimicry of a less-toxic model in poison frogs », Nature, 440(7081), , p. 208-211
- (en) Sherratt, T. N.., « .The evolution of Müllerian mimicry », Naturwissenschaften , 95(8), , p. 681-695
- (en) Maldonado, H., « The deimatic reaction in the praying mantis Stagmatoptera biocellata », Physiologie, 68(1), , p. 60-71
- (en) Hanlon, R. T., & Messenger, J. B., Cephalopod behaviour, Cambridge University Press.,
- (en) Robison, B. H., Reisenbichler, K. R., Hunt, J. C., & Haddock, S. H., « Light production by the arm tips of the deep-sea cephalopod Vampyroteuthis infernalis », The Biological Bulletin, 205(2), , p. 102-109
- (en) Kullenberg, B., & Bergström, G., « Hymenoptera Aculeata males as pollinators of Ophrys orchids. », Zoologica Scripta, 5(1‐4), , p. 13-23
- (en) Dornhaus, A., & Chittka, L., « Why do honey bees dance? », Behavioral Ecology and Sociobiology, 55(4), , p. 395-401.
- (en) Pollick, A. S., & De Waal, F. B., « Ape gestures and language evolution. », Proceedings of the National Academy of Sciences, 104(19), , p. 8184-8189
- (en) Dawkins, R., & Krebs, J. R., « Arms races between and within species », Proceedings of the Royal Society of London B: Biological Sciences, 205(1161), , p. 489-511
- (en) Liow, L. H., Van Valen, L., & Stenseth, N. C., « Red Queen: from populations to taxa and communities », Trends in ecology & evolution, 26(7), , p. 349-358
- (en) Bernays, E. A., & Chapman, R. F., « Plant secondary compounds and grasshoppers: beyond plant defenses », Journal of Chemical Ecology, 26(8), , p. 1773-1794
- (en) YANG, Canchao, LIANG, Wei, CAI, Yan, et al., « Coevolution in action: disruptive selection on egg colour in an avian brood parasite and its host », PLoS One, 5(5),
Annexes
Articles connexes
Liens externes
- http://www.conservation-nature.fr/article1.php?id=307
- http://als.univ-lorraine.fr/Bulletins/Tome44%281-4%29/ConfAMBautz.pdf
- https://www.ted.com/talks/david_gallo_shows_underwater_astonishments?language=fr
- Portail de l’écologie
- Portail de la biologie
- Portail origine et évolution du vivant