Éthanolamine
L'éthanolamine, également appelée 2-aminoéthanol ou monoéthanolamine, est un composé organique de formule chimique NH2CH2CH2OH qui est à la fois une amine primaire par son groupe amine –NH2 et un alcool primaire par son groupe hydroxyle –OH. À l'instar des autres amines, la monoéthanolamine se comporte en base faible. L'éthanolamine est un liquide toxique, inflammable, corrosif, incolore et visqueux ; son odeur est similaire à celle de l'ammoniac.
| Éthanolamine | |
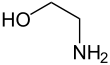 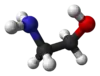 Structure de l'éthanolamine. |
|
| Identification | |
|---|---|
| Nom UICPA | 2-aminoéthanol |
| Synonymes |
2-amino-l-éthanol, |
| No CAS | |
| No ECHA | 100.004.986 |
| No CE | 205-483-3 |
| No RTECS | KJ5775000 |
| PubChem | 700 |
| ChEBI | 16000 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore et huileux à l'odeur ammoniacale |
| Propriétés chimiques | |
| Formule | C2H7NO [Isomères] |
| Masse molaire[1] | 61,083 1 ± 0,002 6 g/mol C 39,33 %, H 11,55 %, N 22,93 %, O 26,19 %, |
| pKa | 9,5[2] |
| Propriétés physiques | |
| T° fusion | 10 °C[3] |
| T° ébullition | 170 °C[3] |
| Paramètre de solubilité δ | 31,8 J1/2·cm-3/2 (30 °C)[4] ; 13,5 cal1/2·cm-3/2[5] |
| Masse volumique | 1,02 g cm−3 à 20 °C[3] |
| T° d'auto-inflammation | 410 °C[3] |
| Point d’éclair | 85 °C[3] |
| Limites d’explosivité dans l’air | 5,5 - 17 %[réf. souhaitée] |
| Pression de vapeur saturante | 50 Pa à 20 °C 163 Pa à 40 °C 343 Pa à 50 °C[3] |
| Point critique | 80,3 bar, 671,4 K[réf. souhaitée] |
| Thermochimie | |
| ΔfH0liquide | −507,5 kJ mol−1[6] |
| ΔvapH° | 59,6 kJ mol−1[7] |
| Cp | |
| Propriétés optiques | |
| Indice de réfraction | = 1,4539 à 20 °C[9] |
| Précautions | |
| SGH[3] | |
  Danger |
|
| NFPA 704 | |
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
L'éthanolamine est communément appelée monoéthanolamine afin de la distinguer de la diéthanolamine et de la triéthanolamine. Le groupe éthanolamine est le deuxième plus fréquent groupe de tête des phospholipides, des substances que l'on retrouve dans les membranes biologiques. Cette molécule a été détectée en 2020 dans le nuage moléculaire Sagittarius B2 situé non loin du centre de la Voie lactée[10].
Production
On produit la monoéthanolamine en faisant réagir l'oxyde d'éthylène avec l'ammoniaque aqueux ; cette réaction produit également de la diéthanolamine et de la triéthanolamine. Il est possible d'exercer un contrôle sur les proportions de ces produits en changeant la stœchiométrie des réactifs[11].
Applications
Cosmétiques et détergents
Les analyses scientifiques ont permis de conclure que l'usage de la monoéthanolamine (MEA) et de la triéthanolamine (TEA), est sécuritaire dans les cosmétiques conçus pour une utilisation à courte échéance, suivie d'un rinçage complet de la surface de la peau. Dans les produits destinés à être en contact prolongé avec la peau, la concentration d'éthanolamines ne doit pas dépasser 5 %[12].
L'usage de la cocamide DEA, de la cocamide DIPA et d'autres acides gras avec éthanolamine est autorisé dans les cosmétiques, car ces substances ne présentent pas les mêmes caractéristiques que la DEA. Cependant, dans les cosmétiques, on interdit leur utilisation en association avec des agents formant de la nitrosamine[12].
La présence de diéthanolamine (DEA) n'est pas autorisée dans les cosmétiques au Canada. En effet, la DEA et les composés similaires, comme la diisopropanolamine (DIPA), peuvent produire des nitrosamines dangereuses possiblement associées au cancer. La DEA et la DIPA, de même que tous les ingrédients capables d'induire la formation de nitrosamines, lorsqu'ils sont ajoutés à un cosmétique, peuvent présenter un risque pour la santé des consommateurs et ne doivent donc pas se retrouver dans les cosmétiques vendus au Canada, comme l'indique la Liste critique des ingrédients[12].
Elle sert d'ingrédient de base dans la production de détergents, émulsifiants, vernis, produits pharmaceutiques, inhibiteurs de corrosion, intermédiaires chimiques, etc.[11] Par exemple, la réaction entre l'éthanolamine et l'ammoniac donne de l'éthylènediamine, un agent chélateur courant[11] :

Traitement de gaz
La monoéthanolamine est utilisée en solution aqueuse pour neutraliser certaines molécules acides présentes dans les gaz (procédé de traitement aux amines).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ethanolamine » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Hall, H.K. (1957), Correlation of the Base Strengths of Amines, J. Am. Chem. Soc., 79 (20), 5441–4, DOI:10.1021/ja01577a030.
- Entrée « 2-Aminoethanol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 novembre 2011 (JavaScript nécessaire).
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) Șerban Moldoveanu, Sample preparation in chromatography, Amsterdam/Boston, Elsevier, , 930 p. (ISBN 0-444-50394-3), p. 258.
- https://webbook.nist.gov/cgi/cbook.cgi?ID=C141435&Units=SI
- Kapteina, Simon ; Slowik, Krzysztof ; Verevkin, Sergey P. et Heintz, Andreas, Vapor Pressures and Vaporization Enthalpies of a Series of Ethanolamines, J. Chem. Eng. Data, 2005, 50, 2, 398-402, DOI:10.1021/je049761y.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub., , 396 p. (ISBN 0-88415-857-8).
- (en) R. E. Reitmeier, V. Sivertz et H. V. Tartar, « Some Properties of Monoethanolamine and its Aqueous Solutions », Journal of the American Chemical Society, vol. 62, no 8, , p. 1943–1944 (DOI 10.1021/ja01865a009).
- (en) Víctor M. Rivilla, Izaskun Jiménez-Serra, Jesús Martín-Pintado, Carlos Briones, Lucas F. Rodríguez-Almeida, Fernando Rico-Villas, Belén Tercero, Shaoshan Zeng, Laura Colzi, Pablo de Vicente, Sergio Martín et Miguel A. Requena-Torres, « Discovery in space of ethanolamine, the simplest phospholipid head group », Proceedings of the National Academy of Sciences of the United States of America, vol. 118, no 22, , article no e2101314118 (PMID 34031247, PMCID 8179234, DOI 10.1073/pnas.2101314118, Bibcode 2021PNAS..11801314R, arXiv 2105.11141, lire en ligne).
- (en) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Stephen Hawkins (trad. de l'allemand), Industrial Organic Chemistry, Weinheim, Wiley-VCH, , 4e éd., 491 p. (ISBN 978-3-527-30578-0, LCCN 2003284086, lire en ligne), « Chap. 7. Oxidation Products of Ethylene », p. 159–161.
- Santé Canada, http://www.hc-sc.gc.ca/cps-spc/cosmet-person/cons/safety-innocuite-fra.php#a43 « Copie archivée » (version du 6 août 2018 sur l'Internet Archive).
- Portail de la chimie
- Portail des énergies fossiles


