2-Nitrobenzaldéhyde
Le 2-nitrobenzaldéhyde ou orthonitrobenzaldehyde ou o-nitrobenzaldéhyde est un composé organique aromatique. C'est un dérivé du benzène, substitué par un groupe nitro et un groupe aldéhyde en position ortho, donc l'isomère ortho du nitrobenzaldéhyde.
| 2-Nitrobenzaldéhyde | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-nitrobenzaldéhyde |
| Synonymes |
ortho-nitrobenzaldéhyde |
| No CAS | |
| No ECHA | 100.008.206 |
| No CE | 209-025-3 |
| PubChem | 11101 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline jaune à l'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | C7H5NO3 [Isomères] |
| Masse molaire[2] | 151,119 5 ± 0,007 1 g/mol C 55,63 %, H 3,33 %, N 9,27 %, O 31,76 %, |
| Susceptibilité magnétique | -68,23 × 10−6 cm3/mol[réf. nécessaire] |
| Propriétés physiques | |
| T° fusion | 39,5 °C[3] |
| T° ébullition | 153,05 °C à 0,031 bar[4] |
| Solubilité | très peu soluble dans l'eau[1] |
| T° d'auto-inflammation | 200 °C[1] |
| Point d’éclair | 113 °C[5] |
| Précautions | |
| SGH[6] | |
 Attention |
|
| Écotoxicologie | |
| DL50 | 600 mg·kg-1 (souris, oral)[7] |
| LogP | 1,74[1] |
| Composés apparentés | |
| Isomère(s) | 3-Nitrobenzaldéhyde 4-Nitrobenzaldéhyde |
| Unités du SI et CNTP, sauf indication contraire. | |
Le 2-nitrobenzaldéhyde est un intermédiaire dans la synthèse de l'indigo appelée synthèse de Baeyer-Drewsen de l'indigo.
Production et synthèse
La synthèse directe du 2-nitrobenzaldéhyde par nitration du benzaldéhyde pose problème, puisque le groupe aldéhyde est un groupe orienteur en meta. Ainsi l'isomère meta (le 3-nitrobenzaldéhyde), est produit à 72 % contre 19 % pour l'isomère ortho (2-nitrobenzaldéhyde), et 9 % pour l'isomère para (4-nitrobenzaldéhyde)[8]. Pour cette raison, cette nitration n'est pas faite directement.
- Une première solution est la mono-nitration du toluène à basse température en 2-nitrotoluène (produit 58 % d'isomère ortho, le reste en isomère meta et para)[9]. Le 2-nitrotoluène peut ensuite être oxydé en 2-nitrobenzaldéhyde[10],[11].
- Une autre solution consiste à oxyder le 2-nitrostyrène. Pour cela, on effectue une nitration du cinnamaldéhyde dans une solution d'anhydride acétique dans l'acide acétique, menant au 2-nitrocinnamaldéhyde[12]. Celui-ci est oxydé en acide 2-nitrocinnamique puis décarboxylé en 2-nitrostyrène. Le groupe éthylène peut ensuite être oxydé de diverses façons pour produire le 2-nitrobenzaldéhyde[13].
Utilisation
Le 2-nitrobenzaldéhyde est un intermédiaire utilisé dans la synthèse de l'indigo, colorant insoluble dans l'eau, utilisé couramment pour teindre les jeans et d'autres produits.
La synthèse de Baeyer-Drewsen de l'indigo est une méthode de synthèse initiée par les chimistes allemands Adolf von Baeyer et Viggo Drewsen en 1882. Elle valut le prix Nobel de chimie à Adolf von Baeyer (ainsi que pour ses nombreux autres travaux).
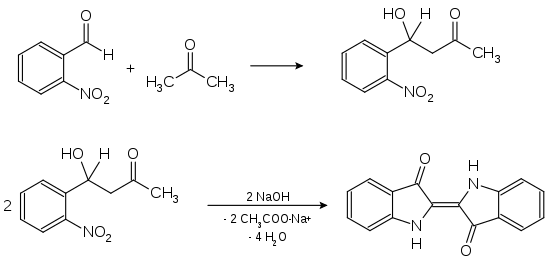
Dans cette synthèse, deux moles de 2-nitrobenzaldéhyde sont condensées sur deux moles d'acétone en milieu basique, donnant une mole d'indigotine (indigo)[14],[15],[16].
En 1883, Adolf von Baeyer breveta par ailleurs la synthèse de l'isatine (le premier réactif à partir duquel il synthétisa l'indigo) à partir du 2-nitrobenzaldéhyde, reposant sur le même type de réaction que la précédente :
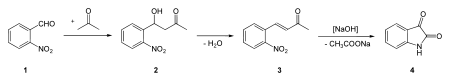 Synthèse de l'isatine.
Synthèse de l'isatine.
Le 2-nitrobenzaldéhyde peut servir de réactif à de nombreuses autres synthèses organiques, du fait de la réactivité de ses substituants.
Les dérivés de 2-nitrobenzaldéhyde peuvent aussi servir à synthétiser d'autres indigoïdes (dérivés de l'indigo), comme le carmin d'indigo ou le pourpre de Tyr.
Notes et références
- Entrée « 2-Nitrobenzaldehyde » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 06/08/09 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Hajos, A.,Experiments in the Domain of chloroamphenicols VIII. Preparation of nitroacetophenones and nitrobenzaldehydes and various derivatives through oxidative oxime cleavage,Acta Chim. Acad. Sci. Hung., 1959, 21, 131. - Incertitude attribuée par le Thermodynamics Research Center (NIST Boulder Laboratories, M. Frenkel director) de 1,5 K
- CRC Handbook of Data on Organic Compounds, 2d Edition, Weast,R.C and Grasselli, J.G., ed(s)., CRC Press, Inc., Boca Raton, FL, 1989, 1.
- https://www.jeulin.fr/media/pim/assets/DocumentsPDF/std.lang.all/9-/fr/FDS-115009-FR.pdf
- Fiche Sigma-Aldrich du composé 2-Nitrobenzaldehyde, consultée le 31/08/2020.
- Annales des Falsifications et de l'Expertise Chimique. Vol. 76(815), Pg. 65, 1983.
- Structure of Benzene, California State University Dominguez Hills
- http://www.thecatalyst.org/experiments/AndersonS/AndersonS.html Product Distribution in the Nitration of Toluene, Steven W. Anderson, January 7, 1999
- Synthesis of 2-Nitrobenzaldehyde from 2-Nitrotoluene, Alexander Popkov
- « o-Nitrobenzaldehyde » (consulté le )
- o-NITROCINNAMALDEHYDE, nitration of cinnamaldehyde, organic-synthesis
- Selective aerobic oxidation of styrene to benzaldehyde catalyzed by water-soluble palladium(II) complex in water, Bo Feng, Zhenshan Hou, Xiangrui Wang, Yu Hu, Huan Li and Yunxiang Qiao
- Synthesis of Indigo
- Indigo Synthesis
- Synthesis of Indigo and Vat Dyeing
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 2-Nitrobenzaldehyde » (voir la liste des auteurs).
- Portail de la chimie