2-Méthyltétrahydrofurane
Le 2-méthyltétrahydrofurane est un composé organique de formule CH3C4H7O. C'est un solvant inflammable notamment utilisé en remplacement du tétrahydrofurane (THF). Il peut être également utilisé comme carburant.
| 2-Méthyltétrahydrofurane | |||
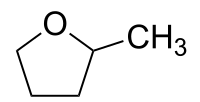
| |||
| Structure moléculaire du 2-méthyltétrahydrofurane (en haut) Énantiomère R du 2-méthyltétrahydrofurane (à gauche) et S-2-méthyltétrahydrofurane (à droite) |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2-méthyloxolane | ||
| No CAS | (RS) ((R)-(–)) ((S)-(+)) |
||
| No ECHA | 100.002.281 | ||
| No CE | 202-507-4 | ||
| No RTECS | LU2800000 | ||
| PubChem | 7301 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide[1] incolore avec une odeur d'éther[2] | ||
| Propriétés chimiques | |||
| Formule | C5H10O [Isomères] |
||
| Masse molaire[3] | 86,132 3 ± 0,005 g/mol C 69,72 %, H 11,7 %, O 18,58 %, |
||
| Moment dipolaire | D | ||
| Diamètre moléculaire | nm | ||
| Propriétés physiques | |||
| T° fusion | −136 °C[2] | ||
| T° ébullition | 78 à 80 °C[4] | ||
| Solubilité | g L−1 | ||
| Masse volumique | 0,86 g cm−3 à 25 °C[4] | ||
| T° d'auto-inflammation | 270 °C[2] | ||
| Point d’éclair | −11 °C[2],[4] | ||
| Viscosité dynamique | 4 mPa s à 25 °C[2] | ||
| Conductivité thermique | W m−1 K−1 | ||
| Vitesse du son | m/s | ||
| Thermochimie | |||
| S0gaz, 1 bar | J K−1 mol−1 | ||
| S0liquide, 1 bar | J K−1 mol−1 | ||
| S0solide | J K−1 mol−1 | ||
| ΔfH0gaz | kJ mol−1 | ||
| ΔfH0liquide | kJ mol−1 | ||
| ΔfH0solide | kJ mol−1 | ||
| Cp | J K−1 mol−1 | ||
| Propriétés optiques | |||
| Indice de réfraction | =1,406[4] | ||
| Précautions | |||
| SGH[4],[2] | |||
  |
|||
| Transport[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 4 500 mg/kg mg kg−1 (lapin, cutané)[5] 6 000 ppm /4 heures (rat, inhalation)[5] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Stéréochimie
Le 2-méthyltétrahydrofurane est chiral possédant une centre stéreogène qui porte le substituant méthyle est chiral. Le 2-méthyltétrahydrofurane existe donc sous la forme de deux énantiomères :
- le (R)-(–)-2-méthyltétrahydrofurane de numéro CAS qui est donc lévogyre ;
- le (S)-(+)-2-méthyltétrahydrofurane de numéro CAS qui est donc dextrogyre.
Préparation
Le 2-méthyltétrahydrofurane est principalement synthétisé par hydrogénation catalytique du furfural. OC4H3CHO + 4 H2 → OC4H7CH3 + H2O
Il peut être également produit à partir de l'acide lévulinique. Une première étape consiste en une cyclisation suivie d'une réduction en γ-valérolactone.
La lactone est ensuite hydrogénée en 1,4-pentandiol qui est déshydraté pour former le 2-méthyltétrahydrofurane.
Utilisations
Le 2-méthyltétrahydrofurane est principalement utilisé comme solvant pour remplacer le THF à cause de son point d'ébullition plus élevé. Néanmoins il peut, comme ce dernier, former des peroxydes dangereux ce qui peut être aussi évité par adjonction d'un inhibiteur et antioxydant puissant[1],[4], le 2,6-Di-tertiobutyl-4-méthylphénol (DTBMP) improprement dénommé hydroxytoluène butylé, appellation (provenant d'une traduction "mot-à-mot" du sigle anglo-saxon "BHT", "Butylated HydroxyToluene") pour le moins fautive puisque ne précisant ni le nombre ni le caractère tertiaire du radical butyle et oubliant que le substituant prioritaire du noyau benzénique est l'hydroxyle (-OH) et non le méthyle (-CH3) d'où la dénomination correcte de Phénol et non de Toluène et encore moins de Crésol !
Références
- PubChem CID 7301
- Entrée « 2-Methyl tetrahydrofuran anhydrous » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27/06/2015 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 2-Methyltetrahydrofuran anhydrous, ≥99%, Inhibitor-free, consultée le 27/06/29015.
- (en) « 2-Méthyltétrahydrofurane », sur ChemIDplus.
- Portail de la chimie
