Acide croconique
L'acide croconique ou la 1,2-dihydroxycyclopentènetrione est le composé organique de formule brute C5H2O5 ou (C=O)3(COH)2. Il est composé d'un squelette cyclopentène avec deux groupes hydroxyles adjacents à la double liaison et trois groupes cétones sur les atomes de carbone restants. Il est sensible à la lumière[4], soluble dans l'eau et l'éthanol[5] et forme des cristaux jaunes qui se décomposent à 212 °C[6].
| Acide croconique | |
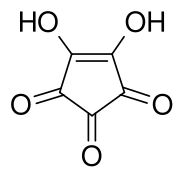
| |
| Identification | |
|---|---|
| Nom UICPA | 4,5-dihydroxycyclopent-4-ène-1,2,3-trione |
| Synonymes |
4,5-dihydroxy-4-cyclopentène-1,2,3-trione |
| No CAS | |
| No ECHA | 100.201.686 |
| PubChem | 546874 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H2O5 [Isomères] |
| Masse molaire[1] | 142,066 4 ± 0,005 6 g/mol C 42,27 %, H 1,42 %, O 56,31 %, |
| Propriétés physiques | |
| T° fusion | >300 °C[2] |
| Cristallographie | |
| Système cristallin | orthorhombique[3] |
| Classe cristalline ou groupe d’espace | Pca21[3] |
| Paramètres de maille | a = 8,710 8 Å b = 5,168 3 Å |
| Unités du SI et CNTP, sauf indication contraire. | |
Ce composé est un acide car il perd ses protons (cation H+) de ses hydroxyles à un pH bas (pKa1 = 0.80 ± 0.08 et pKa2 = 2.24 ± 0.01 à 25 °C)[7],[8]. Les anions résultants, hydrogénocroconate[4], C5HO5− et croconate, C5O52− sont aussi assez stables. En particulier, le dianion croconate est aromatique et symétrique, la double liaison et les charges négatives sont délocalisées sur le cinq sous-unités CO. Les croconates de lithium, de sodium et de potassium cristallisent de l'eau en dihydrates[3] mais le sel orange du potassium peut être déshydraté pour former un monohydrate[4],[7].
Les croconates d'ammonium, de rubidium et de césium cristallisent sous forme anhydre[3]. Les sels de baryum, de plomb, d'argent, etc. sont aussi connus[4].
L'acide croconique peut aussi former des esters comme le croconate de diméthyle.
Histoire
L'acide croconique et le croconate de potassium dihydrate ont été découverts par Leopold Gmelin en 1825 qui nomma ces composés d'après le grec τό χρόχον, « safran » ou « jaune d'œuf »[3]. La structure du croconate d'ammonium a été déterminée par Baenziger et al. en 1964 ; la structure de K2C5O5 . 2H2O a été déterminée par J. D. Dunitz en 2001[9].
Structure
À l'état solide, l'acide croconique a une structure constituée de bandes plissées, chaque bande étant un anneau planaire de quatre molécules de C5O5H2 liées par des liaisons hydrogène[3].
Dans l'état solide des sels de métal alcalin, les anions croconates et les cations alcalins forment des colonnes parallèles[3]. Dans le sel mixte K3(C5HO5)(C5O5)·2H2O qui contient formellement des dianions croconates et des anions hydrogénocroconates, l'hydrogène est partagé également entre deux unités croconates adjacentes[3].
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Croconic acid » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Croconic acid sur Sigma-Aldrich.com
- Dario Braga, Lucia Maini, Fabrizia Grepioni, Croconic Acid and Alkali Metal Croconate Salts: Some New Insights into an Old Story, Chemistry - A European Journal, 2002, vol. 8(8), pp. 1804–1812. DOI:10.1002/1521-3765(20020415)8:8<1804::AID-CHEM1804>3.0.CO;2-C
- Kiyoyuki Yamada, Nobuhisa Mizuno and Yoshimasa Hirata, Structure of Croconic Acid, Bulletin of the Chemical Society of Japan, 1958, vol. 31(5), pp. 543-549. DOI:10.1246/bcsj.31.543.
- William Allen Miller, Elements of chemistry: theoretical and practical, 1868, 4e édition, 884 pages, Longmans.
- Edward Turner, Elements of chemistry.
- Lowell M. Schwmtr Robert I. Gelb, and Janet 0. Yardley, Aqueous Dissociation of Croconic Acid, J. Phys. Chem., 1975, vol. 79(21), pp. 2246–2251. DOI:10.1021/j100588a009.
- Robert I. Gelb, Lowell M. Schwartz, Daniel A. Laufer, Janet O. Yardley, The structure of aqueous croconic acid, J. Phys. Chem., 1977, vol. 81(13), pp. 1268–1274. DOI:10.1021/j100528a010.
- J. D. Dunitz, P. Seiler, W. Czchtizky, Angew. Chem., 2001, vol. 113, p. 1829; Angew. Chem. Int. Ed. vol 40, p. 1779.
Voir aussi
- Portail de la chimie