Acide rhodizonique
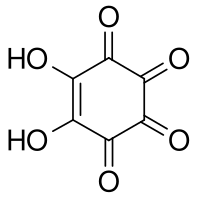
L'acide rhodizonique est un composé organique de formule brute C6H2O6 ou (CO)4(COH)2. il peut être vu comme le double énol du cyclohexène tétra cétone.
| Acide rhodizonique | |
| |
| Identification | |
|---|---|
| Nom UICPA | 5,6-dihydroxycyclohex-5-ène-1,2,3,4-tétrone |
| Synonymes |
dihydroxydiquinoyl |
| No CAS | |
| No ECHA | 100.003.888 |
| No CE | 204-276-5 |
| PubChem | 67050 |
| SMILES | |
| InChI | |
| Apparence | aiguilles cristallines orange foncé[1] |
| Propriétés chimiques | |
| Formule | C6H2O6 [Isomères] |
| Masse molaire[2] | 170,076 5 ± 0,006 7 g/mol C 42,37 %, H 1,19 %, O 56,44 %, |
| Propriétés physiques | |
| T° fusion | 248 °C (dihydrate,décomposition)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide rhodizonique est habituellement sous la forme d'un dihydrate, C6H2O6·2H2O de numéro CAS . En fait, ce dihydrate est la 2,3,5,5,6,6-hexahydroxycyclohex-2-ène-1,4-dione de masse molaire 206,107 ± 0,007 6 g·mol-1 (C 34,96 %, H 2,93 %, O 62,1 %) dans laquelle deux groupes cétone de l'acide sont remplacés par deux paires d'hydroxyles géminaux (précurseur de cétal). L'acide anhydre, orange à rouge foncé et très hygroscopique peut être obtenu par sublimation du dihydrate à basse pression[4],[5].
Comme beaucoup d'autres alcools énoliques, l'acide rhodizonique est acide et peut donc perdre des ions H+. Les constantes d'acidité de l'acide rhodizonique anhydre ne peuvent être mesurées mais sont évaluées à pKa1 < 2 et pKa2<4,72[4]. En solution dans l'eau, ces pKa sont pKa1 = 4,378 ± 0.009 et pKa2 = 4,652 ± 0.014 à 25 °C[6] formant l'anion hydrogénorhodizonate, C6HO6− et le dianion rhodizonate, C6O62−. Ce dernier est aromatique et symétrique, la double liaison et les deux charges négatives sont délocalisées sur les six unités CO.
L'acide rhodizonique a été utilisé pour des tests chimiques du baryum, du plomb et d'autres métaux[7]. En particulier, un test au rhodizonate de sodium peut être utilisé pour détecter les résidus de tir d'armes à feu (qui contiennent du plomb) sur les mains d'un sujet[8] et de distinguer des blessures de flèches de blessures par balle pour l'application la réglementation de la chasse[9].
Histoire
L'acide rhodizonique a été découvert par le chimiste autrichien Johann Heller (en) en 1837 en analysant les produits d'un mélange chauffé de carbonate de potassium, K2CO3 et de charbon, C[10]. Pendant un temps, la formule des rhodizonates a été considérée comme étant C7O7· Me3[11]. Le nom vient du grec ῥοδίζω, rhodizō, « teinter de rouge » en référence à la couleur de ses sels[12].
Sels
Les rhodizonates ont tendance à être de diverses nuances de rouge, du jaune au pourpre en lumière transmise, avec un lustre verdâtre en lumière réfléchie. En solution, les anions rhodizonate ne sont pas hydratés[6].
Le rhodizonate de potassium peut être préparé avec un bon rendement et une bonne pureté par oxydation d'inositol avec de l'acide nitrique et de traiter le résultat avec l'acétate de potassium en présence d'oxygène. Le rhodizonate cristallise de la solution en raison de sa relative insolubilité dans l'eau[13]. L'acide rhodizonique peut également être obtenu par trimérisation de glyoxal en présence de cyanures catalytiques[1].
Dans le rhodizonate de rubidium anhydre, Rb+2(C6O6)2−, les anions rhodizonates sont empilés en colonnes parallèles ainsi que les ions rubidium. Dans les plans perpendiculaires aux colonnes, Ils sont disposés en deux grilles hexagonales intercalées. Les anions sont plans[5]. Le rhodizonate de potassium anhydre, K+2(C6O6)2− a une structure distincte mais néanmoins similaire. Les anions et cations sont arrangés dans des plans alternés. Dans chaque plan, les anions sont arrangés en une grille hexagonale. Chaque ion K+ est agencé de sorte qu'il se connecte de façon symétrique à huit atomes d'oxygène de quatre anions, deux dans chaque plan adjacent. Les anions ont légèrement la forme "bateau" avec une déviation standard de 10,8 pm (0,108 Å) du plan moyen[14].
Le rhodizonate de sodium, Na+2(C6O6)2− est brun foncé et est stable quand il est sec[15], mais ses solutions aqueuses se décomposent en quelques jours même mises au réfrigérateur[7]. Ce sel a une structure identique au sel de potassium mais les anions rhodizonates sont un peu plus distordus (11,3 pm du plan moyen)[16].
le rhodizonate de lithium ainsi que ses sels de tétrahydroxybenzoquinone (THBQ) et de benzènehexol, ont été considérés comme possiblement utilisables dans des batteries électriques rechargeables[17].
Oxydation et décomposition
L'acide rhodizonique est un membre de la chaîne de produits d'oxydation : benzènehexol (COH)6, tétrahydroxybenzoquinone (THBQ) (COH)4(CO)2, acide rhodizonique (COH)2(CO)4 et cyclohexanehexone (CO)6[7].
L'anion monovalent C6O6− a été détecté dans des expériences de spectrométrie de masse[19].
L'acide rhodizonique et les anions rhodizonate peuvent perdre un groupement CO pour former de l'acide croconique, (CO)3(COH)2 ou respectivement des anions croconate, C5O52− par un mécanisme qui n'est pas encore parfaitement connu. En solution basique à pH > 10, l'acide rhodizonique se convertit rapidement en anion THBQ4−, (CO)64− en absence d'oxygène ou en croconate en sa présence. À pH 8,3 et exposition à la lumière, les solutions sont stables plusieurs jours en l'absence d'oxygène mais en sa présence, elles se décomposent en croconate et en d'autres produits (incluant possiblement la cyclohexanehexone ou le dodécahydroxycyclohexane)[20],[21].
Notes
- (de) Entrée Rhodizonsäure sur Römpp Online. Georg Thieme Verlag, consultée le 10 mars 2016.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Sigma-Aldrich catalog » (consulté le )
- Elizabeth Patton, Robert West, New aromatic anions. VIII. Acidity constants of rhodizonic acid, J. Phys. Chem., 1970, vol. 74(12), p. 2512–2518. DOI:10.1021/j100706a018.
- Dario Braga, Gianna Cojazzi, Lucia Maini and Fabrizia Grepioni, Reversible solid-state interconversion of rhodizonic acid H2C6O6 into H6C6O8 and the solid-state structure of the rhodizonate dianion C6O62 – (aromatic or non-aromatic?), New J. Chem., 2001, vol. 25, p. 1221-1223. DOI:10.1039/b107317f.
- R. I. Gelb, L. M. Schwartz, D. A. Laufer, The structure of aqueous rhodizonic acid, J. Phys. Chem., 1978, vol. 82(18), p. 1985–1988. DOI:10.1021/j100507a006.
- Robert A. Chalmers and Geoffrey M. Telling, A reassessment of rhodizonic acid as a qualitative reagent, Microchimica Acta, 1967, vol. 55(6), p. 1126-1135. DOI:10.1007/BF01225955
- Vincent J. M. Di Maio, Gunshot wounds: practical aspects of firearms, ballistics, and forensic techniques, 2nd edition. CRC, 1998, p. 341. (ISBN 978-0-8493-8163-8).
- Ronald L. Glover, Detecting Lead in "Arrow" Wounds in Deer Using Rhodizonic Acid, Wildlife Society Bulletin, 1981, vol. 9(3), p. 216-219. version en ligne.
- Johann Florian Heller, Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse, Justus Liebigs Annalen der Pharmacie, 1837, vol. 24(1), p. 1–16. version en ligne.
- Carl Löwig, Daniel Breed, Principles of organic and physiological chemistry. cersion en ligne.
- Robert Hunter and Charles Morris, Universal dictionary of the English language, 1900, Collier, NY.version en ligne.
- Paul W. Preisler and Louis Berger, Preparation of Tetrahydroxyquinone and Rhodizonic Acid Salts from the Product of the Oxidation of Inositol with Nitric Acid, Journal of the American Chemical Society, 1942, vol. 64(1), pp 67–69. DOI:10.1021/ja01253a016.
- J. A. Cowan and J. A. K. Howard, Dipotassium rhodizonate, Acta Crystallographica, 2004, vol. E60, pp. m511-m513. DOI:10.1107/S160053680400529X.
- Fritz Feigl, Ralph E. Oesper, Spot tests in organic analysis. version en ligne.
- R. E. Dinnebier, H. Nuss and M. Jansen, Disodium rhodizonate: a powder diffraction study., Acta Crystallographica, 2005, vol. E61, pp. m2148-m2150. DOI:10.1107/S1600536805030552.
- Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, and Philippe Poizot, Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery, J. Am. Chem. Soc., 2009, vol. 131(25), p. 8984–8988. DOI:10.1021/ja9024897.
- Leopold Gmelin, Henry Watts, Hand-book of chemistry. Cavendish Society, 1856.
- Richard B. Wyrwas and Caroline Chick Jarrold, Production of C6O6− from Oligomerization of CO on Molybdenum Anions, J. Am. Chem. Soc., 2006, vol. 128(42), pp? 13688–13689. DOI:10.1021/ja0643927.
- G. Iraci and M. H. Back, The photochemistry of the rhodizonate dianion in aqueous solution., Canadian Journal of Chemistry, 1988, vol. 66, p. 1293. version en ligne.
- B. Zhao and M. H. Back, The photochemistry of the rhodizonate dianion in aqueous solution., Canadian Journal of Chemistry, 1991, vol. 69, p. 528. version en ligne.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Rhodizonic acid » (voir la liste des auteurs).
Voir aussi
- Éthynediol (COH)2
- Acide deltique (CO)(COH)2
- Acide squarique (CO)2(COH)2
- Acide croconique(CO)3(COH)2
- Liste d'acides
- Portail de la chimie