Ornithine
L'ornithine (acide 2,5-diaminopentanoïque, appelé aussi acide ornithurique) est un acide aminé non codé par le code génétique, et qui n'entre donc pas dans la composition des protéines. L'ornithine est formée à partir du L-glutamate, chez les plantes, et de la L-arginine, chez les animaux, où elle apparaît dans le cycle de l'urée.
- Chez les plantes, l'ornithine est un des précurseurs des alcaloïdes tropaniques. Ces derniers sont des esters d'alcools tropaniques et d'acides carboxyliques. L'ornithine est à l'origine du cycle pyrrolidinique du noyau de l'alcool tropanique[4].
- Chez les animaux, l'ornithine est un des produits de l'action de l'arginase dihydrolase sur la L-arginine pour former l'urée.
| Ornithine | |
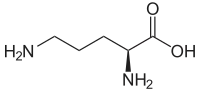
| |
| Formule topologique de l'ornithine. | |
| Identification | |
|---|---|
| Nom UICPA | L-ornithine |
| Synonymes |
acide (+)-(S)-2,5-diaminovalérique, acide (+)-(S)-2,5-diaminopentanoïque |
| No CAS | |
| No ECHA | 100.000.665 |
| No CE | 200-731-7 |
| PubChem | 6262 |
| ChEBI | 15729 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H12N2O2 [Isomères] |
| Masse molaire[1] | 132,161 ± 0,005 8 g/mol C 45,44 %, H 9,15 %, N 21,2 %, O 24,21 %, |
| pKa | 1.94 (25 °C) [2] |
| Propriétés physiques | |
| T° fusion | 140 °C [2] |
| Propriétés biochimiques | |
| Acide aminé essentiel | dans certains cas |
| Précautions | |
| SIMDUT[3] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
En outre, chez les sauropsides, l’ornithine est excrétée : il s’agit d’ailleurs d’une caractéristique propre à ce taxon.
L'ornithine a un intérêt en microbiologie et en bactériologie. Cette molécule n'étant pas un acide aminé génétiquement codé, elle n'entre pas dans la constitution d'holoprotéines (qui ne sont constituées que de résidus d'acide aminé codé). Mais c'est une molécule qui peut être dégradée par des bactéries de façon à être utilisée par ces dernières. L'enzyme nécessaire à sa dégradation est l'ornithine décarboxylase donnant la putrescine plus du CO2 (acide volatil moins acide que le groupement COOH, aussi appelé groupement carboxylique) ce qui provoque donc une alcalinisation du milieu.
Sachant que l'ornithine elle-même est synthétisée à partir de l'arginine grâce à l'enzyme arginine dihydrolase qui donnent de la putrescine plus du CO2, ce procédé est un peu complexe et emprunte deux voies possibles :
Dans tous les cas l'arginine est hydrolysée une première fois, donnant de la citrulline plus de l'ammoniac (NH3).
Ensuite :
- soit la citrulline est à son tour hydrolysée et donne de l'ornithine, du CO2 et du NH3 ;
- soit il y a action du phosphate inorganique (Pi) qui forme alors de l'ornithine et du carbamyl-phosphate, qui à son tour subit l'action de l'ADP et forme de l'ATP plus du CO2 et du NH3.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Ornithine », sur ChemIDplus, consulté le 11 février 2009
- « Ornithine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- (en) Human Metabolome Database « Showing metabocard for Ornithine (HMDB00214) »
- Portail de la biochimie
- Portail de la chimie