Acide pivalique
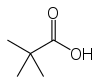
L'acide pivalique est un acide carboxylique de formule semi-développée (CH3)3CCO2H. Ce composé organique incolore et odorant est solide à température ambiante.
| Acide pivalique | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide diméthylpropanoïque | |
| Synonymes |
acide néopentanoïque, acide triméthylacétique |
|
| No CAS | ||
| No ECHA | 100.000.839 | |
| PubChem | ||
| ChEBI | 45133 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C5H10O2 [Isomères] |
|
| Masse molaire[1] | 102,131 7 ± 0,005 3 g/mol C 58,8 %, H 9,87 %, O 31,33 %, |
|
| Propriétés physiques | ||
| T° fusion | 35 °C | |
| T° ébullition | 163,7 °C | |
| Masse volumique | 0,905 g·cm-3 | |
| Écotoxicologie | ||
| DL50 | 900 mg/kg (rats, oral) | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Préparation
Méthode industrielle
L'acide pivalique est préparé par « hydrocarboxylation » de l'isobutène par la réaction de Koch (en) : (CH3)2C=CH2 + CO + H2O → (CH3)3CCO2H.

Ces réactions nécessitent un catalyseur acide tel que l'acide fluorhydrique. L'alcool tert-butylique et l'alcool isobutylique peuvent également être utilisés à la place de l'isobutène. Au niveau mondial, plusieurs milliers de tonnes sont produits annuellement[2].
Méthodes de laboratoire
À l'origine il était préparé par oxydation du pinacolone avec de l'acide chromique[3] et par l'hydrolyse du pivalonitrile (en)[4]. Les méthodes de laboratoire pratiques procèdent par du 2-chloro-2-méthylpropane (en), par carbonatation des réactifs de Grignard[5] et par oxydation de pinacalone[6].
Applications
Par rapport à la plupart des acides carboxyliques, les esters de l'acide pivalique sont particulièrement résistants à l'hydrolyse. Certaines applications résultent de cette stabilité thermique. Les polymères dérivés d'esters de l'alcool vinylique sont des vernis hautement réfléchissants. Le groupe pivaloyle (abrégé en « piv » ou « pv ») est un groupe protecteur pour les alcools en synthèse organique.
Sécurité
Comme la plupart des acides carboxyliques, l'acide pivalique est un irritant léger et est faiblement toxique (DL50 orale = 900 mg/kg pour les rats).
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Wilhelm Riemenschneider, Carboxylic Acids, Aliphati, Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a05_235.
- (en) Friedel et Silva, Ber. 6, 146, 826 (1873).
- (en) Butlerow, Ann. 165, 322 (1873).
- (en) S. V. Puntambeker, E. A. Zoellner, L. T. Sandborn et E. W. Bousquet, Trimethylacetic acid from tert.- Butyl Chloride, Org. Synth., coll. « vol. 1 », , p. 524
- (en) L. T. Sandborn et E. W. Bousquet, Trimethylacetic acid from Pinacolone, Org. Synth., coll. « vol. 1 », , p. 524
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pivalic acid » (voir la liste des auteurs).
- Portail de la chimie