Algie vasculaire de la face
L'algie vasculaire de la face (AVF) est un syndrome caractérisé par la répétition de douleurs du visage, typiquement à proximité d'un œil, accompagnées de signes locaux variables, et non évocatrices d'autres causes. Il s'agit d'une affection rare, touchant majoritairement l'homme adulte jeune. Les douleurs sont parfois rapportées par les patients comme les plus intenses qu'ils aient connues, et peuvent être accompagnées de pensées suicidaires.
Pour les articles homonymes, voir AVF.

| Causes | Inconnu (d) |
|---|---|
| Symptômes | Céphalée, larmoiement (d), yeux rouges (en), congestion nasale, rhinorrhée, irritabilité, agitation psychomotrice, Ptosis, transpiration animale et photophobie |
| Traitement | Oxygénothérapie normobare, triptan, ergotamine, antiépileptique, vérapamil, sel de lithium et corticoïde |
|---|---|
| Spécialité | Neurologie |
| CISP-2 | N90 |
|---|---|
| CIM-10 | G44.0 |
| CIM-9 | 339.00,339.01,339.02 |
| OMIM | 119915 |
| DiseasesDB | 2850 |
| Medline | rechercher dans Medline |
| MedlinePlus | 000786 |
| eMedicine | 1142459 |
| MeSH | D003027 |
| IHS | 3.1.1,3.1.2 |
| Patient UK | Cluster-headache |
![]() Mise en garde médicale
Mise en garde médicale
Certains facteurs tels que la consommation d'alcool ou un sommeil irrégulier peuvent favoriser les crises. La cause de ce syndrome n'est pas connue. Le diagnostic est en principe établi à l'examen clinique, mais une IRM cérébrale peut être réalisée pour rechercher une forme secondaire. Le traitement des crises peut faire appel à l'inhalation d'oxygène ou à l'injection de sumatriptan. Le vérapamil est le principal médicament utilisé pour prévenir les récurrences.
Synonymes
L'algie vasculaire de la face est parfois dénommée autrement : « érythroprosopalgie[1] » ; « névralgie migraineuse[1] » ; « céphalée en grappe[2] » ; « céphalée de Horton[3] » (ne pas confondre avec la maladie de Horton) ; « céphalée vasculaire de Horton[3] » ; « céphalée histaminique de Horton »[4] ; « céphalée (ou migraine) suicidaire »[5] ; « cluster headache » ; « syndrome de Bing-Horton »[réf. nécessaire].
En fonction des symptômes, elle a aussi pu être décrite sous des noms variables, tels que le syndrome de Charlin, le syndrome de Sluder (ou du ganglion sphénopalatin), l'érythromélalgie de la face, la névralgie du nerf vidien ou la névralgie des nerfs pétreux[1]. Les algies vasculaires de la face ont été appelées par différents autres noms dans le passé : « syndrome de vasodilatation hémicéphalique de Pasteur-Vallery-Radot », « migraine rouge de Mollendorf » et « hémicranie angioparalytique »[6][réf. à confirmer].
Signes et symptômes
Il existe fréquemment des signes avant-coureurs de la crise, à type de pesanteur, larmoiement ou congestion nasale[7].
| Critères de diagnostic de l'AVF, d'après l'IHS[8] | |
| A | Au moins cinq crises répondant aux critères B-D |
| B | Douleur sévère unilatérale, de topographie orbitaire, supra-orbitaire et/ou temporale, durant 15 à 180 minutes sans traitement |
| C | La céphalée est associée avec au moins un des signes suivants, du même côté que la douleur : injection conjonctivale, larmoiement, obstruction nasale, rhinorrhée, sudation du front et de la face, myosis, ptôsis, œdème de la paupière |
| D | Fréquence des crises de 1 à 8 par jour |
| E | Au moins un des trois caractères suivants : l'histoire, l'examen physique et neurologique ne suggèrent pas de désordre organique ; l'histoire, l'examen physique et neurologique suggèrent un désordre organique, mais celui-ci est écarté par la neuro-imagerie ou tout autre procédé de laboratoire ; un désordre organique existe, mais les crises d'AVF ne sont pas apparues pour la première fois en liaison temporelle avec celui-ci |
Les personnes souffrant d'AVF ont typiquement un mal de tête important près d'un œil, du nez, d'une racine de dent ou de la tempe et durant en général de 15 minutes à 3 heures. Les maux de tête sont unilatéraux, et sont toujours situés du même côté du visage, respectant la ligne médiane[9],[10].
La douleur s'accroît progressivement mais rapidement (5 à 15 minutes), est asymétrique, à type de gonflement, de broiement, de striction de la partie du visage atteinte ; un mal de tête est souvent associé quand la crise devient sévère, signant ainsi la parenté de l'AVF avec la migraine commune. Une différence notable dans l'expression de la douleur est l'agitation, le malade cherchant désespérément une position ou un endroit où la douleur serait plus supportable.
L'AVF est souvent associée à au moins un des symptômes suivants : une chute des paupières, un œil rentré, des pupilles contractées (ces trois symptômes constituant le syndrome de Claude Bernard-Horner[11]), œil rouge et larmoyant, un œdème des paupières, une congestion nasale ou un nez qui coule, ainsi qu'une transpiration accrue sur la zone de la tête où se manifeste la douleur. Le cou est souvent tendu et des douleurs aux mâchoires ainsi qu'aux dents ont été signalées. Un état d'agitation est fréquent[7] ce qui contraste avec une crise migraineuse, où le patient est plutôt calme, les mouvements pouvant exacerber les douleurs.
Dans 80 à 90 % des cas, les patients sont agités. Ils gémissent fréquemment, crient ou hurlent. D'autres restent prostrés. Ils se livrent parfois à un comportement violent envers eux-mêmes[12]. La sensibilité à la lumière et la sensibilité au son apparaissent fréquemment (environ 60 % des cas) lors d'AVF[13]. Dans certains cas moins fréquents, la sensibilité aux odeurs fortes[réf. nécessaire], des vomissements ou nausées peuvent également apparaître (environ 28 % des cas)[14]. Dans certains cas, l'affection peut même pousser au suicide afin de se libérer de la douleur dans un acte désespéré[15].
Certains facteurs favorisent le déclenchement des crises. Ainsi la prise d'alcool serait présente dans près de la moitié des cas[16]. Le sommeil pourrait être également facilitateur[16]. Un environnement anxiogène et même plus généralement une situation provoquant une mauvaise oxygénation peuvent déclencher la crise[réf. souhaitée].
Intensité de la douleur
La comparaison avec d'autres maux de tête est limitée ; toutefois les patients qui ont eu des migraines affirment que la douleur ressentie lors d'une AVF est nettement plus importante (avec une intensité perçue parfois cent fois plus grande[17]). Une analogie est celle d'un pic à glace brûlant que l'on enfoncerait de manière répétée à travers l'œil et le cerveau, d'une déchirure ou d'un broiement[18], ou d'une intervention dentaire sans anesthésie.
La médecine estime qu'il s'agit de l'une des douleurs les plus intenses et qu'elle dépasse celle d'une amputation sans anesthésie. En l'occurrence, Peter Goadsby, professeur de neurologie clinique à la University College de Londres, un éminent chercheur, a commenté : « l'algie vasculaire de la face est probablement la pire douleur que l'homme ait jamais connue. Je sais que c'est une remarque forte, mais si vous demandez à des patients souffrant d'AVF s'ils ont eu une expérience pire, ils disent tous qu'ils n'en ont pas eu. Les femmes souffrant d'AVF vous diront que l'attaque est encore pire qu'un accouchement. Vous pouvez donc imaginer que ces personnes donnent naissance, sans anesthésie, une ou deux fois par jour, pendant six, huit ou dix semaines, puis font une pause. C'est tout simplement terrible[19],[20]. » La fin de la crise se caractérise par une brusque et très rapide disparition de la douleur.
Ces symptômes étaient auparavant appelés « céphalée de Horton » après les premières théories postulées sur la pathogenèse par le Dr B.T. Horton. Son premier article décrit la sévérité de la douleur comme étant capable de prendre des hommes normaux et les forcer à se suicider. En effet, les algies vasculaires de la face sont également connues sous le surnom de « céphalées suicidaires ».
Extrait du premier article de Horton[21] (1939) sur l'algie vasculaire de la face :
Our patients were disabled by the disorder and suffered from bouts of pain from two to twenty times a week. They had found no relief from the usual methods of treatment. Their pain was so severe that several of them had to be constantly watched for fear of suicide. Most of them were willing to submit to any operation which might bring relief.
« Nos patients étaient handicapés par ce désordre et souffraient d'accès de douleur de deux à vingt fois par semaine. Ils n'avaient trouvé aucun soulagement par les méthodes de traitements habituelles. Leur douleur était si intense que plusieurs d'entre eux devaient être constamment surveillés de peur qu'ils n'attentent à leurs jours. La plupart étaient disposés à se soumettre à n'importe quelle opération avec l'espoir d'un soulagement. »
Cycle et fréquence
L'AVF peut être chronique ou épisodique (la forme chronique touche environ 20 % des patients)[22]. On considère que les AVF sont épisodiques lorsqu'elles se produisent en groupe durant une période comprise entre 7 et 365 jours avec une rémission d'au moins un mois entre chaque période. Si les douleurs se produisent sur une durée plus longue qu'une année, sans période d'accalmie d'au moins un mois, alors la pathologie est considérée comme chronique[23]. Il arrive que la nature du mal change d'épisodique à chronique et vice-versa. Il est arrivé que des personnes soient à nouveau atteintes d'AVF après des dizaines d'années exemptes d'attaques.
Les AVF périodiques sont bien calquées sur des périodes de l'année (plusieurs semaines, suivies d'une période calme, sans maux de tête) et un horaire précis de la journée. Elles surviennent ainsi plus fréquemment au printemps et en automne[7]. Les douleurs peuvent arriver une fois par semaine à six fois par jour, avec une moyenne de deux par jour. Elles frappent souvent la nuit, ou pendant une sieste[7], à la même heure ou peuvent revenir à la même heure une semaine plus tard. Ces phénomènes ont poussé les scientifiques à étudier les relations avec l'horloge biologique du cerveau et du corps (rythme circadien). Pour la forme chronique, les malades subissent ces douleurs chaque jour pendant des années.
Les AVF peuvent cependant évoluer au cours du temps. Une étude effectuée sur dix ans a révélé que, dans le cas d'AVF épisodiques, environ 81 % des patients sont restés épisodiques, environ 13 % ont évolué vers une forme chronique et environ 6 % vers une forme intermédiaire. Dans le cas d'AVF chroniques, environ 52 % sont restés chroniques, environ 33 % ont évolué vers la forme épisodique et environ 14 % vers une forme « combinée »[24]. L'évolution de la forme épisodique à chronique n'est pas encore connue, mais des facteurs comme les traumatismes crâniens, le tabagisme et la consommation d'alcool sont suspectés d'avoir une influence négative[25].
Le facteur déclenchant le plus cité est la prise de vin rouge[26].
Diagnostic
Le diagnostic positif se fait uniquement sur un interrogatoire[27],[28]. L'examen clinique est normal, sauf juste après une crise ou entre deux crises rapprochées, où l'on peut observer une rougeur de l'œil, un petit œdème palpébral et un signe de Claude Bernard-Horner. Celui-ci persiste définitivement dans environ 20 % des cas[réf. nécessaire], surtout en cas d'AVF chronique. Les examens complémentaires sont normaux.
Les difficultés diagnostiques sont attribuées à une méconnaissance de la maladie[29] et à un besoin de formation des médecins, la symptomatologie étant sans équivoque[29],[30],[31],[4],. Le délai de diagnostic moyen est de 44 mois et il est supérieur à 4 ans pour 31 % des patients, 52 % des patients avaient consultés au moins 3 médecins avant d'être diagnostiqués (Flandres, 2009)[30]. En 2014 le constat reste identique dans une autre population européenne (Italie, Europe centrale), avec des erreurs de primo-diagnostic dans 77 % des cas[31].
Des cas d'AVF secondaires ont été rapportés. Il s'agit le plus souvent de « pseudo-AVF », comportant des atypies cliniques comme la persistance d'un fond douloureux permanent[32]. En cas de crises d'installation récente et/ou de sémiologie atypique, des auteurs ont préconisé d'effectuer des examens complémentaires : explorations vasculaires (écho-Doppler cervical et transcrânien), une IRM/ARM cérébrale (cas de dissection de la carotide interne, anévrisme, tumeur, adénome hypophysaire, thrombose du sinus caverneux), un scanner des sinus (cas d'une sinusite bloquée). Dans le cas d'AVF secondaire, les causes les plus fréquemment identifiées sont vasculaires (anévrisme, fistule durale), tumorales (adénome hypophysaire, méningiomes, carcinomes des structures paranasales ou de la fosse postérieure) et enfin inflammatoires ou infectieuses (aspergillose sphénoïdale). Par ailleurs, l'âge d'apparition est plus tardif (en moyenne 42 ans) et la longueur des crises plus importante (durée fréquemment supérieure à 180 minutes)[33].
Il n'est pas impossible d'être atteint de plusieurs maux de tête différents, aussi une même personne peut par exemple souffrir de migraines, d'algie vasculaire de la face et d'hémicranie paroxystique.
Diagnostics différentiels
- Migraine sans aura[34], d'autant qu'il existe des algies vasculaires avec nausées et sensibilité à la lumière[7].
- Hémicrânie paroxystique chronique (en) (HPC)
- Syndrome SUNCT (en) (Short-lasting Unilateral Neuralgiform headache attacks with Conjunctival injection and Tearing)
- Céphalée de tension[34]
- Algies de l'appareil manducateur (S.A.D.A.M. ou syndrome de Costen)
- Névralgie essentielle du trijumeau (NET)[34]
- Sinusite[34]
- Allergie[34]
- Affection dentaire[34]
Le cluster-tic est une association rare de l'AVF et de la névralgie du trijumeau, qui peuvent apparaitre ensemble dans une même crise, ou de façon alternative[34]. Les autres diagnostics différentiels sont souvent émis à tort avant l'identification correcte de la pathologie, avec, selon un recensement fait en Italie en 2014, une moyenne relevée de 2,27 diagnostics nécessaires par patient pour identification de l'AVF[34].
Épidémiologie
La prévalence varie de 56 à 326 pour 100 000 en fonction de diverses études[35] assez limitées. La latitude semble jouer un rôle : les AVF apparaissent plus souvent chez les populations nordiques que celles qui habitent près de l'équateur. On suppose que la durée du jour, qui varie selon la latitude, pourrait avoir une influence sur ces céphalées[36]. En Italie, environ 0,3 % de la population est concernée[37].
Alors que les migraines apparaissent plus souvent chez les femmes, les AVF sont plutôt une pathologie touchant les hommes. Pour une femme diagnostiquée avec une AVF, on compte 2,5 à 3 hommes souffrant de la même affection.
Cette différence entre les deux sexes est toutefois en recul. Il est difficile de dire si elle est induite par de meilleurs diagnostics ou si l'affection apparaît désormais plus souvent chez les femmes. Néanmoins, avant le début des années 1960, on comptait 6,2 hommes pour 1 femme. Puis le rapport Homme/Femme a baissé à 5,6:1, 4,3:1, 3,0:1 et 2,1:1 respectivement pour les années 1960, 70, 80 et 90. Ce changement se trouve en étroite corrélation avec l'évolution du mode de vie des femmes (niveau scolaire, consommation de tabac, café et d'alcool)[38].
Le pic d'apparition se situe dans la tranche 20-30 ans aussi bien pour les hommes que pour les femmes ; celles-ci peuvent manifester des premières atteintes dans la forme chronique dès leur plus jeune âge (tranche des 0-9 ans) et il existe également chez elles des apparitions à un âge avancé (supérieur à 70 ans)[39].
Facteurs de risque
Le rôle du tabac est évoqué devant une forte prévalence de fumeurs et ex-fumeurs (65 % des cas)[40], mais l'arrêt du tabagisme ne semble pas entraîner l'amélioration des symptômes[16].
L'algie vasculaire est fréquemment associé avec une apnée du sommeil sans que l'on sache si un syndrome est responsable de l'autre[41].
Facteurs génétiques
Les descendants directs d'une personne souffrant d'AVF ont de plus grandes chances de développer l'affection que le reste de la population[42]. Contrairement aux autres types de céphalées, l'importance du facteur génétique semble moins significative dans le cas des AVF. Dernièrement, le risque de souffrir d'AVF a été relié au polymorphisme d'un gène codant les récepteurs de l'hypocrétine de type 2 (HCRTR2)[43]. Une enquête réalisée par l'association AFCAVF auprès de ses membres (enquête ayant donné lieu à la publication d'une thèse[44]) suggère que les cas où une personne atteinte d'AVF ait un enfant atteint lui-même d'AVF sont rares (de l'ordre de 2 %).
Physiopathologie
Les AVF sont des céphalées primaires d'origine neurovasculaire. Si la raison immédiate de la douleur est connue, les causes de l'affection restent en partie méconnues. Néanmoins, l'AVF est de mieux en mieux comprise : les différentes études qui ont été répertoriées[45] montrent que la recherche progresse.
La physiopathologie fait certainement intervenir le système trigéminovasculaire et un « générateur de l'AVF » hypothalamique[46]. L'unilatéralité de la douleur, sa localisation dans le territoire du trijumeau, la présence de signes parasympathiques (larmoiement, congestion nasale, injection conjonctivale et œdème de la paupière) et sympathiques (myosis, ptôsis et sudation du front) suggèrent l'implication du système trigéminovasculaire et du sinus caverneux, cependant par un mécanisme qui reste obscur.
Le caractère cyclique des crises suggère fortement l'implication du rythme circadien via la mélatonine et l'acide gamma-aminobutyrique (GABA). Ces deux substances sont fortement concentrées dans l'hypothalamus. De plus il existe une hyperactivité des noyaux hypothalamiques du même côté que la douleur lors des crises[47].
Hypothalamus
La théorie selon laquelle les AVF proviendraient d'une anomalie dans l'hypothalamus[48] est une des plus acceptées ; le Dr Peter James Goadsby[49], spécialiste australien a développé cette théorie. Cette thèse pourrait expliquer pourquoi les maux de tête se produisent avec une chronologie précise et régulière. L'un des rôles de l'hypothalamus est de réguler le rythme circadien. Des anomalies métaboliques ont d'ailleurs été signalées chez des patients.
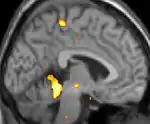 |  |  |
| La tomographie par émission de positons (TEP) montre les zones du cerveau étant activées durant la douleur | ||
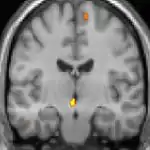
 |  |  |
| La morphométrie voxel par voxel (VBM) montre les différences structurelles des zones du cerveau | ||
Les images par tomographie à émission de positron indiquent les régions du cerveau qui sont activées lors de la douleur, par rapport aux périodes sans douleur. Elles montrent les régions du cerveau qui sont toujours actives durant la douleur en jaune/orange (appelé "matrice-douleur"). La zone au centre (dans les trois vues) est spécifiquement activée uniquement pendant la crise. Les photos sur la ligne du bas (effectuées par VBM) montrent les différences structurelles entre les patients souffrant d'AVF et des personnes saines : seulement une partie de l'hypothalamus est différente[50],[51].
Il semble exister des anomalies microstructurales hypothalamiques bilatérales (en l'occurrence l'existence d'une hypertrophie)[52] sans que l'on sache si ces anomalies sont la cause ou la conséquence de la répétition des crises.
Traitement
Une attaque d'AVF est considérée comme une urgence médicale du fait de la douleur engendrée. Toutefois beaucoup de médecins ne sont pas habitués à cette affection. C'est pourquoi les AVF sont souvent mal ou pas diagnostiquées[53].
Des recommandations ont été publiées en 2006 sur la prise en charge de l'algie vasculaire par l'European Federation of Neurogical Societies[54].
Traitement de la crise

Deux traitements donnent des résultats satisfaisants pour traiter les crises :
- l'injection en sous-cutanée de sumatriptan est une alternative radicale lorsque l'utilisation de l'oxygénothérapie est impossible[55],[56]. L'efficacité est bien supérieure à celle de l'oxygénothérapie, bien qu'il n'existe pas d'essai comparatif oxygénothérapie versus sumatriptan. Il existe par contre un certain nombre d'effets indésirables, ainsi que des risques cardio-vasculaires à prendre en compte, qui font déconseiller son utilisation chez les patients ayant des antécédents cardio-vasculaires. La forme nasale est une alternative moins efficace, que cela soit pour le sumatriptan[57] ou pour le zolmitriptan[58] ;
- l'oxygénothérapie normobare (pression partielle en O2 entre 0,213 et 1,013 bar ; au-delà, il s'agit d'une oxygénothérapie hyperbare) à haut débit (12 l/min) donne de bons résultats[59]. Cependant le conditionnement, l'encombrement et le stockage de l'oxygène en limitent l'usage. L'intérêt de ce traitement est l'absence d'effet indésirable en cas d'utilisation répétée (plus de deux crises par jour). En France et en Belgique, l'oxygénothérapie dans l'algie vasculaire de la face est remboursée par l'assurance maladie, à condition que la prescription initiale soit faite par un neurologue, un ORL ou un médecin d'une structure spécialisée dans la prise en charge de la douleur[60] ;
La stimulation vagale non invasive peut faire cesser les crises dans 50 % des algies vasculaires dans sa forme épisodique mais est inefficace dans sa forme chronique[61].
Les médicaments habituellement prescrits contre les maux de tête sont inefficaces : aspirine et paracétamol. Contrairement aux migraines et d'autres céphalées, les AVF sont insensibles aux traitements par « biofeedback ».[réf. souhaitée] Compte-tenu de l'intensité et de la durée relativement courte des crises, la médication par voie orale n'est de plus pas adaptée[4].
Certains patients répondent en partie aux antidouleurs narcotiques mais la nécessité d'en prendre souvent les rend inadéquats. Ils n'arrivent par ailleurs pas à totalement supprimer la douleur.
Traitement de fond
Le traitement de fond vise à diminuer la fréquence des crises lors des épisodes ou au long cours en cas d'AVF chronique.
- L' érénumab (commercialisé sous le nom d'Aimovig) est un anticorps monoclonal humain qui a obtenu une autorisation de mise sur le marché européenne en 2018. Il s'administre par des auto-injections mensuelles.
- Le vérapamil est largement utilisé[62]. C'est le traitement considéré actuellement comme le plus efficace[63]. La dose usuelle est de 120 mg, 3 à 4 fois par jour, en cas d'échec des doses beaucoup plus élevées sont parfois utilisées (de 600 à 1 200 mg par jour), mais imposent une surveillance cardiovasculaire rapprochée.
- Les corticoïdes (La prednisone, la prednisolone ou la méthylprednisolone) ont une forte efficacité[64] en quelques jours dans 70 % des cas, mais nécessite de fortes doses (1 à 2 mg/kg/jour en prise unique matinale) pour une prescription maximum de 30 jours.
- Le carbonate de lithium est utilisé hors AMM à la dose moyenne de 750 mg/j[65]. Son efficacité a été démontrée dans une étude randomisée, dont la méthodologie est cependant controversée. Les fonctions rénales et thyroïdiennes doivent être vérifiées avant le début du traitement, et surveillées ensuite régulièrement.
- Le méthysergide était un traitement classique[64] qui n'est plus guère utilisé puisqu'il s'agit d'un vasoconstricteur contre-indiquant l'administration de sumatriptan en traitement de crise. La posologie efficace varie de 6 à 12 mg par jour, et le traitement doit être instauré très progressivement. Les principales contre-indications sont les coronaropathies, l'HTA sévère, l'artérite des membres inférieurs et l'insuffisance hépatique ou rénale sévère.
- Le tartrate d'ergotamine. Comme le méthysergide, ce traitement n'est pratiquement plus utilisé car il contre-indique formellement la prise de sumatriptan.
- L'indométacine a parfois un effet remarquable[réf. nécessaire] se rapprochant de celui obtenu dans l'hémicrânie paroxystique chronique. En l'absence de contre-indication digestive, le traitement doit être débuté à fortes doses (150 à 200 mg par jour) puis diminué progressivement jusqu'à atteindre la dose minimale efficace.
- Le galcanézumab'''' permet une réduction des crises dans les formes sporadiques[66].
Des traitements tels que le baclofène, la toxine botulique, la capsaïcine, la chlorpromazine, la civamide, la clonidine, l'ergotamine ou dihydroergotamine, la gabapentine, la leuprolide, la mélatonine, le méthysergide, le pizotifène, le valproate de sodium, le sumatriptan oral, le topiramate, ou les antidépresseurs tricycliques ont pu être testés sans preuve d'efficacité suffisante[67].
Il existe des preuves anecdotiques que les sérotoninergiques hallucinogènes comme la psilocybine contenue dans certains champignons hallucinogènes, le LSD et le LSA (d-acide lysergique amide, contenues dans les graines de Turbina corymbosa) stoppent les périodes de crises et prolongent les périodes de rémission[68]. En outre, ces substances sont illicites, ce qui rend leur usage problématique.
Traitements non médicamenteux
Il existe des traitements non médicamenteux, plus ou moins invasifs, à réserver aux formes chroniques (unilatérales) sévères et pharmacorésistantes[69].
- L'alcoolisation du ganglion sphéno-palatin. La neurolyse est réalisée par injection de 0,5 à 1 mL de lidocaïne à 1 % suivie d'un volume équivalent d'alcool absolu. L'amélioration apportée est souvent transitoire (quelques semaines à quelques mois) mais le geste peut alors être renouvelé.
- Thermocoagulation sélective du ganglion de Gasser[70].
- L'injection de glycérol dans la citerne rétro-gassérienne. Les échecs à court terme sont fréquents.
- La lésion sélective du trijumeau par « gamma knife »[71]. Elle consiste à léser par rayonnement gamma (de 70 Gy) la racine sensitive du trijumeau au niveau la TROZ (trigeminal root entry zone).
- Décompression microvasculaire du trijumeau, sans hypoesthésie dans le territoire trigéminal. L'efficacité est peu durable[72].
- Stimulation profonde de l'hypothalamus (par implantation d'électrodes intracérébrales)[73],[74]. Cette technique semble très prometteuse, mais le recul est encore insuffisant.
- Stimulation du nerf occipital[75], la technique consiste en l'implantation d'un stimulateur interne dont les électrodes de stimulation sont posées sur les deux nerfs occipitaux. Cette technique, moins invasive que la stimulation hypothalamique, permettrait une amélioration en moyenne de 60 % des patients présentant une AVF chronique pharmaco-résistante[76].
- Neurostimulation transcutanée de type TENS sur les régions temporales et zygomatiques pour le traitement des douleurs unilatérales, et sur le nasion et l'union pour les douleurs bilatérales[77]. Cette technique de stimulation emploie des électrodes autocollantes de surface et est totalement non invasive. Elle est facile à tester et sans effet secondaire.
- L'infiltration du grand nerf occipital d'Arnold[78]. L'injection est fait avec 160 mg de méthylprednisolone.
- Le port d'une gouttière occlusale pendant la nuit, l'algie vasculaire pouvant être un des symptômes d'un syndrome appelé S.A.D.A.M. : syndrome algo-dysfonctionnel de la mandibule.
Histoire
La littérature grecque et romaine antique met en évidence divers maux de tête, mais aucune indication sur l'existence d'algie vasculaire de la face[79]. Le médecin néerlandais Nicolaes Tulp, célèbre pour The Anatomy Lecture peint en 1632 par Rembrandt, a décrit en 1641 (dans Observationes Medica) deux types de maux de tête récurrents : la migraine, et probablement l'algie vasculaire de la face[80] :

« Au début de l'été, [il] fut affligé d'un mal de tête extrêmement sévère, qui survenait et disparaissait quotidiennement à heures fixes, avec une telle intensité qu'il m'assurait souvent qu'il ne pouvait plus supporter cette douleur ou qu'il mourrait bientôt. Ce mal durait rarement plus de deux heures. Et il n'y avait le reste du jour ni fièvre, ni variation de l'urine, ni atteinte du pouls. Mais cette douleur récurrente dura jusqu'au quatorzième jour… Il demanda de la nature une aide, … et perdit une grande quantité de liquide par le nez … [et] fut soulagé pour une brève durée »
— Nicolaes Tulp , Observationes Medicæ
Thomas Willis a également probablement décrit en 1672 l'algie vasculaire de la face[81].
Gerard van Swieten, le médecin de Marie Thérèse d'Autriche et fondateur de l'école de Vienne en 1745, a documenté un cas d'algie vasculaire de la face épisodique. Cette description correspond aux critères de diagnostic actuels de la International Headache Society (IHS-II-ICHD classification 3.1)[82] :
« Un homme sain et robuste d'âge moyen [était sujet à] une douleur importune qui chaque jour lui venait à la même heure et au même endroit, juste au-dessus de l'orbite de l'œil gauche, où le nerf émerge de l'ouverture de l'os frontal ; après peu de temps l'œil gauche commençait à rougir et se baigner de larmes ; il sentait alors comme si son œil était lentement extrait de son orbite avec tant de souffrance qu'il en devenait presque fou. Après quelques heures, tous ces malheurs s'estompaient, et absolument rien dans l'œil ne paraissait changé »
— Gerard van Swieten
La première description complète des algies vasculaires de la face a été donnée par le neurologue londonien Wilfred Harris (it) en 1926. Il nomma la maladie « névralgie migraineuse »[83],[84],[85].
L'Algie vasculaire de la face est le sujet du roman Anomalie des zones profondes du cerveau, publié par Laure Limongi aux éditions Grasset, en .
 Nicolaes Tulp (1593-1674)
Nicolaes Tulp (1593-1674) Thomas Willis (1621-1675)
Thomas Willis (1621-1675) Gerard van Swieten (1700-1772)
Gerard van Swieten (1700-1772)
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cluster headache » (voir la liste des auteurs).
- « Dictionnaire de l'Académie de Médecine - Bienvenue », sur academie-medecine.fr (consulté le ).
- L'expression « céphalée en grappe » est rencontrée en Suisse, par exemple dans :
- « Les céphalées » [PDF], sur hug.ch, Hôpitaux Universitaires de Genève (consulté le ), p. 3, 5, 17, 20.
- « Céphalées en grappe », sur headache.ch, Société suisse pour l’étude des céphalées (consulté le ).
- Cahiers médicaux, SIMEP Éditions, vol. 6, no 17-23, 1981, p. 1252 :
- « Algie vasculaire de la face », sur granddictionnaire.com (consulté le ).
- H. Massiou, « Algie vasculaire de la face » (consulté le )
- (Surnom donné dans le grand-public, cf. Nathan Moreau, « Douleurs chroniques oro-faciales : classifications et principales étiologies », sur researchgate.net (consulté le )).
- (en) Stephen D. Silberstein, Richard B. Lipton. Peter J. Goadsgy. Headache in Clinical Practice, Second edition. Taylor & Francis. 2002.
- Schindler EA, Burish MJ, Recent advances in the diagnosis and management of cluster headache, BMJ, 2022;376:e059577
- (en) The International Headache Society - Classification (2nd Edition - 1st Revision)
- (en) Cluster headache
- « Symptoms of a cluster headache », sur nhs.com
- (en) A Horner-like syndrome and cluster headache. What comes first?
- (en) Behavior during cluster headache.
- (en) Unilateral photophobia or phonophobia in migraine compared with trigeminal autonomic cephalalgias.
- (en) Cluster headache: clinical presentation, lifestyle features, and medical treatment.
- (en) « No, you're not crazy - you're having a cluster headache » Headache, the Newsletter of ACHE 2001-2002, volume 12 No 4.
- Nesbitt AD, Goadsby PJ, Cluster headache, BMJ, 2012;344:e2407
- (en) « Cluster Headaches » - WebMD
- « Algie vasculaire de la face »
- (en) abc.net.au
- (en) Matharu M, Goadsby P, « Cluster Headache -- Update on a Common Neurological Problem », Practical Neurology, vol. 1, , p. 42–9 (DOI 10.1046/j.1474-7766.2001.00505.x, lire en ligne [PDF])
- (en) B.T. Horton « A new syndrome of vascular headache: report of treatment with histamine: preliminary report » Proceedings of the Staff Meetings of the Mayo Clinic, Rochester, MN, 1939, 14:257-26
- Lanteri-Minet M. L'algie vasculaire de la face : « une urgence pour le patient « une douleur fulgurante extrêmement violente et envahissante » ; Société Française d'Étude des Migraines et Céphalées ; conférence du 25 mars 2006.
- (en) « The International Headache Society - Classification (2nd Edition - 1st Revision) p64 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) Manzoni GC, Micieli G, Granella F, Tassorelli C, Zanferrari C, Cavallini A, « Cluster headache--course over ten years in 189 patients », Cephalalgia, vol. 11, no 4, , p. 169-74. (PMID 1742772)
- (en) Torelli P, Manzoni GC, « What predicts evolution from episodic to chronic cluster headache? », Curr Pain Headache Rep, vol. 6, no 1, , p. 65-70. (PMID 11749880)
- Schürks M, Kurth T, de Jesus J, Jonjic M, Rosskopf D, Diener HC, Cluster headache: clinical presentation, lifestyle features, and medical treatment, Headache, 2006;46:1246-54
- (en) Grosberg BM, Solomon S, « Recognition and treatment of cluster headache in the emergency department », Curr Pain Headache Rep, vol. 8, no 2, , p. 140-6. (PMID 14980149)
- (en), Brochet B. et al. Validation of a brief self-administered questionnaire for cluster headache screening in a tertiary center., janvier 2009.
- (en) Ridderikhoff J. et Koudstaal PJ.Cluster headache: misjudged because unknown, février 2009
- (en) Paemeleire K. et al. Diagnostic and therapeutic trajectory of cluster headache patients in Flanders., mars 2009.
- Fabio Antonaci et al., « Diagnostic and therapeutic errors in cluster headache: a hospital-based study », Journal of Headache Pain, (DOI 10.1186/1129-2377-15-56, lire en ligne).
- (en) Cluster headache variant. Spectrum of a new headache syndrome., 1981.
- (en)Federico Mainardi et al. Cluster-like headache. A comprehensive reappraisal. ncbi.nlm.nih.gov, 2010.
- Thibault Giovando, Algie Vasculaire de la Face : Généralités, physiopathologie, traitements et rôle du pharmacien d’officine dans la prise en charge (Thèse de doctorat en pharmacie), Université de Bordeaux, (lire en ligne)
- (en) Cluster headache prevalence: methodological considerations. A review of the literature.
- (en) Willemijn C. Naber, Rolf Fronczek, Joost Haan et Patty Doesborg, « The biological clock in cluster headache: A review and hypothesis. », Cephalalgia : an international journal of headache, vol. 39, no 14, , p. 1855–1866 (ISSN 0333-1024, DOI 10.1177/0333102419851815, lire en ligne, consulté le )
- Prévalence de l'AVF dans la population générale en Italie lire en ligne
- (en) Gender ratio of cluster headache over the years: a possible role of changes in lifestyle.
- (en) P. Torelli et al., « Age of onset of episodic and chronic cluster headache - a review of a large case series from a single headache centre. », Journal of Headache Pain, (DOI 10.1186/s10194-016-0626-9, lire en ligne).
- (en) Schurks M, Kurth T, de Jesus J, Jonjic M, Rosskopf D, Diener HC, Cluster headache: clinical presentation, lifestyle features, and medical treatment, Headache, 2006;46:1246-54.
- Graff-Radford SB, Newman A, Obstructive sleep apnea and cluster headache, Headache, 2004;44:607-10.
- (en) Russell MB, « Epidemiology and genetics of cluster headache » Lancet Neurol. 2004;3:279-83.
- (en) Rainero I, Gallone S, Valfrè W, Ferrero M, Angilella G, Rivoiro C, Rubino E, De Martino P, Savi L, Ferrone M, Pinessi L, « A polymorphism of the hypocretin receptor 2 gene is associated with cluster headache », Neurology, vol. 63, no 7, , p. 1286-8. (PMID 15477554)
- Thèse du Dr Lancial
- (en) Cluster Headaches Worldwide Support Group
- (en) Cluster headache. Cephalalgia 2000 (20) : 787-803
- (en) Hypothalamic activation in cluster headache attacks.
- (en) A review of hormonal findings in cluster headache. Evidence for hypothalamic involvement
- (en) Hypothalamic activation in cluster headache attacks
- (en) PET and MRA findings in cluster headache and MRA in experimental pain
- (en) Cluster headache: a review of neuroimaging findings
- (en) « Hypothalamic Changes in Patients with Cluster Headache: A Diffusion Tensor Imaging Study »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- « Information »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) May A, Leone M, Afra J, Linde M et al. « EFNS guidelines on the treatment of cluster headache and other trigeminal-autonomic cephalalgias » Eur J Neurol. 2006;13:1066-77
- Revue prescrire, no 281 mars 2007, Algie vasculaire de la face
- (en) Ekbom K; the Sumatriptan Cluster Headache Study Group, Treatment of acute cluster headache with sumatriptan, N Engl J Med, 1991;325:322-6
- (en) Van Vliet JA, Bahra A, Martin V et al. Intranasal sumatriptan in cluster headache—randomized placebo-controlled double-blind study, Neurology, 2003;60:630-3
- (en) Cittadini E, May A, Straube A, Evers S, Bussone G, Goadsby PJ, Effectiveness of intranasal zolmitriptan in acute cluster headache. A randomized, placebo-controlled, double-blind crossover study, Arch Neurol, 2006;63:1537-42
- (en) Cohen AS, Burns B, Goadsby PJ, « High flow oxygen for treatment of cluster headache. A randomized trial » JAMA 2009;302:2451-7.
- JO 18 janvier 2007
- Goadsby PJ, de Coo IF, Silver N et al. Non-invasive vagus nerve stimulation for the acute treatment of episodic and chronic cluster headache: A randomized, double-blind, sham-controlled ACT2 study, Cephalalgia, 2018;38:959-69
- (en) Leone M, D’Amico D, Frediani F et al. « Verapamil in the prophylaxis of episodic cluster headache: a double-blind study versus placebo » Neurology 2000;54:1382-5
- (en) « Clinical Effectiveness of Calcium Entry Blockers in Prophylactic Treatment of Migraine and Cluster Headaches »
- Pradalier A, Baudesson G, Vincent D, Imberty-Campinos C, « Le traitement de l’algie vasculaire de la face [Treatment of cluster headache] », Rev Med Interne, vol. 22, no 2, , p. 151-62. (PMID 11234673, DOI 10.1016/S0248-8663(00)00305-2).
- (en) Double-blind placebo-controlled trial of lithium in episodic cluster headache.
- Goadsby PJ, Dodick DW, Leone M et al. Trial of Galcanezumab in Prevention of Episodic Cluster Headache, N Engl J Med, 2019;381:132-41
- Matharu M, "Cluster headache", Clinical evidence (Review), 2010 PMC
- (en) Sewell R, Halpern J, Pope H, « Response of cluster headache to psilocybin and LSD », Neurology, vol. 66, no 12, , p. 1920–2 (PMID 16801660, DOI 10.1212/01.wnl.0000219761.05466.43) - a Brief Communications, also presented as:
Sewell, R. Andrew, M.D.; Halpern, John M., M.D. "The Effects Of Psilocybin And LSD On Cluster Headache: A Series Of 53 Cases." Abstract. Presented to the National Headache Foundation’s Annual Headache Research Summit. February, 2006 - (en) « Interventional treatment for cluster headache: a review of the options »
- (en) « Diagnosis and treatment of cluster headache »
- (en) « Gamma knife treatment for refractory cluster headache: prospective open trial »
- (en) « The surgical management of chronic cluster headache »
- (en) « Stereotactic stimulation of posterior hypothalamic gray matter in a patient with intractable cluster headache »
- (en) Leone M, « Deep brain stimulation in headache » Lancet Neurol. 2006;5:873-7
- (en) Burns B, Watkins L, Goadsby PJ, « Successful treatment of medically intractable cluster headache using occipital nerve stimulation (ONS) » Lancet 2007;369:1099-106
- (en) Schoenen J « Central modulation in intractable chronic cluster headache patients treated with occipital neurostimulation: an FDG-PET study » Late–breaking abstract LB0R8 IHC 2009, Philadelphie, 10-13 septembre 2009
- (en) Mokrusch T., « Influence of Stimulus Variation in TENS-Treatment of Patients With Vascular Headache », International Functional Electrical Stimulation Society, (lire en ligne)
- (en) Leroux E, Valade D, Taifas I et al. « Suboccipital steroid injections for transitional treatment of patients with more than two cluster headache attacks per day: a randomised, double-blind, placebo-controlled trial » Lancet Neurol. 2011;10:891-7.
- (en) Isler H. « A hidden dimension work in headache: applied history of medicine » Headache 1986;26(1):27-9.
- (en) Koehler PJ. « Prevalence of headache dans tulp's Observationes Medica (1641) with a description of cluster headache » Cephalalgia 1993;13(5):318-20.
- (en) Isler HR. « Thomas Willis', on Two Chapters of Headache 1672: A First Attempt to Apply the “New Science” to this topic » Headache 1986;26(2):95-98. (Abstract)
- (en) Isler HR. « Episodic cluster headache from a textbook of 1745: van Swieten's classic description » Cephalalgia 1993;13(3):172-4.
- (en) Harris W. Neuritis and Neuralgia. Oxford: Oxford Univ.Press; 1926
- (en) Bickerstaff ER, « The periodic migrainous neuralgia of Wilfred Harris », Lancet, vol. 1, no 7082, , p. 1069–71 (PMID 13655672)
- (en) Boes CJ, Capobianco DJ, Matharu MS, Goadsby PJ, « Wilfred Harris' early description of cluster headache », Cephalalgia, vol. 22, no 4, , p. 320–6 (PMID 12100097)
Liens externes
- Orphanet : Algie vasculaire de la face
- Cismef
- AFCAVF Association française contre l'algie vasculaire de la face
- Portail de la médecine