Mélatonine
La mélatonine ou N-acétyl-5-méthoxytryptamine, souvent dénommée hormone du sommeil, est une molécule surtout connue comme étant l'hormone centrale de régulation des rythmes chronobiologiques en étant synthétisée surtout la nuit[2]. Elle régule de nombreuses sécrétions hormonales, chez l'humain et les autres mammifères. Cette neurohormone est synthétisée à partir d'un neurotransmetteur, la sérotonine, qui dérive elle-même du tryptophane. Elle est sécrétée par la glande pinéale (dans le cerveau) en réponse à l'absence de lumière.
Pour les articles homonymes, voir Melatonine.
Ne pas confondre avec la mélanine, désignant les pigments responsables de la couleur de la peau, du plumage ou du pelage.
| Mélatonine | ||
| ||
 | ||
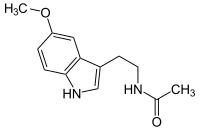
| Structure de la mélatonine. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | N-[2-(5-méthoxy-1H-indol-3-yl)éthyl] éthanamide |
|
| Synonymes |
N-acétyl-5-méthoxytryptamine ou hormone du sommeil |
|
| No CAS | ||
| No ECHA | 100.000.725 | |
| No CE | 200-797-7 | |
| Code ATC | N05 | |
| DrugBank | APRD00742 | |
| PubChem | ||
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C13H16N2O2 [Isomères] |
|
| Masse molaire[1] | 232,278 3 ± 0,012 5 g/mol C 67,22 %, H 6,94 %, N 12,06 %, O 13,78 %, |
|
| Propriétés biochimiques | ||
| Codons | UGG | |
| Données pharmacocinétiques | ||
| Biodisponibilité | 30 – 50 % | |
| Métabolisme | hépatique via CYP1A2 mediated 6-hydroxylation | |
| Demi-vie d’élim. | 35 à 50 minutes | |
| Excrétion | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
La mélatonine semble avoir de multiples fonctions autres qu'hormonales, en particulier comme antioxydant[3]. Elle jouerait un rôle particulier dans la protection de l'ADN nucléaire et dans l'ADN mitochondrial[4]. Elle semble aussi jouer un rôle dans le système immunitaire. En novembre 2020, deux études préliminaires révèlent une corrélation entre la prise de mélatonine et un risque réduit de la Covid-19[5],[6]. Toutefois, l'ANSES recommande aux personnes en bonne santé de limiter sa consommation sous forme de complément alimentaire et d'en informer son médecin.
Des microorganismes et diverses plantes produisent aussi de la mélatonine (dite phytomélatonine dans le cas des plantes)[7],[8],[9],[10],[11].
Synthèse
Synthèse diurne constitutive de la sérotonine
La sérotonine est synthétisée de façon constitutive le jour et même la nuit pour certains individus[Qui ?]. Elle provient de la transformation du tryptophane faisant intervenir deux enzymes. Tout d'abord, le tryptophane est transformé en 5-hydroxytryptophane par l'enzyme tryptophane hydroxylase (TH). Le 5-hydroxytryptophane subit ensuite une autre modification par l'enzyme aminoacide aromatique décarboxylase (AA-DC) pour donner la sérotonine. La sérotonine est stockée dans la glande pinéale au fur et à mesure de sa synthèse. La tryptophane hydroxylase est une enzyme mitochondriale. C'est l'enzyme limitante de la production de sérotonine.
Synthèse nocturne régulée
La nuit, la sérotonine est sécrétée et l'enzyme appelée sérotonine N-acétyltransférase (AA-NAT) catalyse une réaction de N-acétylation et permet la production de N-acétylsérotonine (ou N-acétyl-5 hydroxytryptamine). Ce composé est ensuite transformé en mélatonine (ou N-acétyl-5 méthoxytryptamine) grâce à l'enzyme acétylsérotonine O-méthyltransférase (ASMT).
On obtient donc le bilan suivant :
Première étape (passage de l'AANAT) :
Sérotonine (C10H12N2O) + acétyl-CoA (C23H38N7O17P3S) → N-acétylsérotonine (C12H14N2O2) + coenzyme A (C21H36N7O16P3S)
Seconde étape (passage de l'ASMT) :
N-acétylsérotonine (C12H14N2O2) + S-adénosylméthionine (C15H22N6O5S) → mélatonine (C13H16N2O2)+ S-adénosylhomocystéine (C14H20N6O5S)
L'AA-NAT est une enzyme photosensible et son activité est dépendante de la quantité de sérotonine. Elle est donc l'enzyme limitante de la production de mélatonine.
Régulation par l'AA-NAT
Chez les rongeurs, l'adrénaline nocturne, par augmentation d'AMPc, active la transcription de l'AA-NAT puis l'inhibe par accumulation graduelle d'ICER (Induced cAMP Element Response), maximum en fin de nuit.
Chez les ongulés et les primates, l'adrénaline nocturne, par augmentation d'AMPc, inhibe la protéolyse de l'AA-NAT synthétisée de façon constitutive.
Lieux de synthèse
La mélatonine est synthétisée dans la glande pinéale, par la rétine mais aussi par les cellules de la moelle osseuse, les lymphocytes et les cellules épithéliales. Normalement, la concentration de mélatonine dans ces cellules est plus grande que celle trouvée dans le sang, mais elle ne semble pas être régulée par la photopériode.
Apports alimentaires
Les noix et les noisettes sont des sources importantes de mélatonine biodisponible, c'est-à-dire facilement absorbable par l'organisme[12]. La mélatonine est également présente chez une grande variété d'autres végétaux comestibles (maïs, tomates, pommes de terre, oignon, ail, ananas, banane, riz, avoine, orge, gingembre, taro, etc.) mais généralement en quantités nettement inférieures. Par ailleurs, la teneur en mélatonine de certains aliments serait encore très mal connue[13],[14].
La consommation de noix entraîne une multiplication par trois des taux sanguins de mélatonine chez les rats[12].
Physiologie
Elle régule la sécrétion de la plupart des hormones humaines (paracrines et endocrines). La mélatonine agit différemment selon son origine :
- celle produite dans la glande pinéale et dans le tractus gastro-intestinal[15],[16] agit comme une hormone endocrine car elle se diffuse dans le sang ;
- celle produite par la rétine agit comme une hormone paracrine.
Horloge biologique
Julius Axelrod, à partir de nombreuses expériences, découvre le rôle de la mélatonine et de la glande pinéale sur le cycle du sommeil et les autres rythmes circadiens. En temps normal, la mélatonine est sécrétée la nuit uniquement (avec un pic de sécrétion à 5 heures du matin chez l'humain, et en moyenne, car sa production est inhibée par la lumière). Elle gère (en partie) les rythmes circadiens. Les variations quotidiennes du taux de mélatonine de l'organisme ne sont pas qu'une réponse passive aux variations de luminosité du monde environnant : il est également couplé à un ou plusieurs stimulateurs endogènes (horloge circadienne). Chez les mammifères le principal stimulateur circadien est situé dans les noyaux suprachiasmatiques (NSC) du cerveau, un ensemble bilatéral de neurones situé dans l'hypothalamus antérieur[17].
De nombreux animaux utilisent la variation de la durée de la production de la mélatonine comme repère biologique de la saison. Chez des animaux comme l'homme, le profil de la mélatonine est affecté par la différence de la longueur de la nuit de l'été par rapport à l'hiver. Ce changement de durée de sécrétion sert ainsi de signal biologique pour l'organisation des fonctions saisonnales dépendantes de la durée du jour (photopériodiques) comme la reproduction, certains comportements, la croissance du pelage, le camouflage par la couleur du pelage chez les animaux dépendant des saisons. Cette hormone est sécrétée à la fois par les animaux diurnes et nocturnes.
Liens avec la glycémie
La glycémie dépendrait aussi de l'expression de quelques gènes dont celui codant un récepteur (MT2) de la mélatonine[18]. Ce récepteur MT2 est trouvé dans la rétine, dans le nerf optique, dans la région du diencéphale mais aussi dans les cellules du pancréas sécrétant l'insuline. La mélatonine régule la sécrétion de leptine la nuit et diminue ses concentrations.
Appétit
La mélatonine interviendrait aussi dans l'appétit (et peut-être dans certains cas d'obésité). Injectée à des rats, elle augmente leur prise de nourriture et leur poids[19]. Inversement, une nourriture grasse perturbe le sommeil de souris de laboratoire via une hormone adiponectine, et une perturbation du rythme circadien les fait grossir. Par ailleurs, une mutation du gène codant le récepteur 2 (MT2) de la mélatonine est associée à une augmentation du risque d'obésité et au diabète de type 2, mais aussi aux troubles du sommeil.
Antioxydant
Dans les cellules non tumorales, la mélatonine agit comme un antioxydant impliqué dans les systèmes de protection cellulaire des organismes[20],[21],[22] qui traverse facilement les parois cellulaires ou la barrière hémato-encéphalique. Elle détruit ou inhibe l'action de certains radicaux libres et éléments facteurs de stress oxydatif tels que le radical hydroxyle (HO•), le peroxyde d'hydrogène, le monoxyde d'azote, l'anion peroxynitrite, l'acide peroxynitreux (nitration d'un cycle aromatique très activé vis-à-vis de la substitution électrophile) et l'acide chlorhydrique[23]. Les produits de chacune de ces réactions ont été identifiés dans les systèmes chimiques purs et dans un cas au moins in vivo. Les produits secondaires issus de l'interaction de la mélatonine avec le radical hydroxyle HO• (la 3-hydroxymélatonine) sont par exemple retrouvés dans l'urine des humains et des rats.
Paradoxalement, dans les cellules tumorales (in vitro sur des cellules humaines leucémiques), ce capteur de radicaux libres stimule au contraire, par des mécanismes encore mal compris (en 2011)[24], la production d'espèces réactives de l'oxygène (ERO, en anglais ROS) capables de leur faire subir l'apoptose alors que la mélatonine empêche l'apoptose dans les cellules saines[24]. De manière générale, elle semble jouer un rôle régulateur de l'apoptose[25]. Des observations de ce type ont aussi été faites pour le cancer du sein. (in vitro et in vivo)[26],[27].
La fonction antioxydante de la mélatonine pourrait être apparue très tôt dans l'évolution[28]. Comme le composé bicyclique indole, qui représente le noyau de la molécule de mélatonine, est très riche en électrons[29], et qu'il est également substitué dans cette molécule par deux substituants (méthoxy- et une chaîne alkyle) fortement donneurs d'électrons qui renforcent encore cette richesse électronique, cette molécule possède de manière intrinsèque et perpétuelle la capacité d'attirer les structures pauvres en électrons (électrophiles ou oxydants, car ce qui les caractérise tous deux est leur déficience électronique) et de réagir avec elles selon le mécanisme de substitution électrophile aromatique. La mélatonine possède donc des propriétés antioxydantes de manière permanente.
En outre, la mélatonine augmente l'activité de plusieurs enzymes antioxydantes, ce qui améliore sa capacité de protection des macromolécules contre le stress oxydatif. In vitro, dans des cellules de rats, elle diminue des dégâts induits par le peroxyde d'hydrogène, quand elle est en présence de ce dernier (même à faible dose), mais ne répare pas les cellules déjà endommagées[30].
L'expérimentation animale a montré que la mélatonine acquise via des aliments végétaux comestibles élève le taux d'indole dans le sang. Le taux sanguin de mélatonine est corrélé avec l'activité antioxydante totale du sérum. Contrairement aux autres antioxydants (comme la vitamine C), la mélatonine, une fois oxydée, ne peut pas être directement réduite pour retrouver son état initial, car la nitration d'un aromatique est une réaction irréversible.
Ces propriétés antioxydantes la font contribuer à certains processus de détoxification de l'organisme[31] ainsi qu'à certains processus de résistances aux stress oxydatifs, même chez des microorganismes[32].
Lors d'expériences faites par l'Institut de médecine militaire du ministère russe de la Défense sur des souris irradiées, la mélatonine s'est montrée moins protectrice que l'indraline[33] et la phényléphrine pour la peau, en usage topique, mais elle avait néanmoins des propriétés radioprotectrices (contre les effets d'une source radioactive externe ; en l'occurrence une source de Cobalt 60 émettant 38,3 Gy)[34].
L'administration de mélatonine chez le rat produirait un effet aussi anxiolytique qu'un médicament de référence, le diazépam, administré à la même dose (1 mg·kg-1)[35].
Système immunitaire
La mélatonine endogène produite par le système pinéal influe positivement sur le système immunitaire[36]. Associée au calcium, la mélatonine peut également aider à la réponse immunitaire des lymphocytes T. Son utilisation médicale pour augmenter la réponse est cependant soumise à controverse puisqu'elle favoriserait également les maladies auto-immunes. La mélatonine peut supprimer la libido en inhibant la sécrétion de la LH (luteinizing hormone) et de FSH (follicle stimulating hormone) à partir de la glande antéhypophyse, notamment chez les mammifères qui ont une période d'allaitement quand la durée des jours est longue. La reproduction des espèces qui allaitent quand le jour est long est diminuée par la mélatonine et stimulée quand le jour est court. La mélatonine augmenterait la libido (chez les rats mâles) par un antagonisme des récepteurs de la sérotonine de type 5-HT(2A)[37].
Bêta-bloquants
Les bêta-bloquants abolissent la sécrétion nocturne de mélatonine. Ils causent également des insomnies. Une étude de 3 semaines sur des patients hypertensifs recevant ce traitement a montré que la mélatonine améliorait la qualité du sommeil et la durée de la phase 2 du sommeil (non-REM), sans affecter les autres phases. La durée de latence avant l'endormissement a également décru[38].
Autres
La mélatonine joue aussi un rôle dans la régulation de la pression artérielle, la protection des os[réf. nécessaire].
Rôles proposés en pathologie
Maladie d'Alzheimer
Une étude clinique randomisée (189 sujets, 90 % de femmes) publiée en 2008 montre que pour la maladie d'Alzheimer la prise de mélatonine (de même que l'exposition à la lumière naturelle) améliore les symptômes de troubles des cycles du sommeil, en agissant comme inducteur de sommeil mais aussi comme facteur d'allongement de la durée de celui-ci[39].
L'exposition à la lumière naturelle diminuerait aussi chez ces malades :
- les symptômes de dépression (-19 %) ;
- les limitations fonctionnelles au quotidien (-53 %) ;
- la détérioration cognitive (-5 %).
La prise de mélatonine facilite l'endormissement (endormissement 8 minutes plus tôt en moyenne) et allonge le sommeil de 27 minutes en moyenne. L'association lumière + mélatonine a aussi diminué les comportements agressifs (-9 %), les phases d'agitation et de réveils nocturnes.
Le Dr Albert Lachman (spécialiste des troubles du sommeil) estime[40] qu'en améliorant le sommeil du malade on améliore aussi les fonctions cognitives et l'humeur. Il conseille « de bien éclairer les pièces en journée, de laisser les rideaux ouverts et, à l'inverse, de diminuer les sources de lumière en soirée pour que l'organisme reçoive le signal que la nuit est là ». « Malheureusement, dans certaines maisons de repos, pour des questions d'organisation, on fait plutôt l'inverse » ajoute-t-il[40].
Dépression saisonnière
Dans les régions à hiver très gris comme l'Europe du Nord et le Canada, c'est la baisse de luminosité hivernale (jours courts et gris) qui déclencherait une surproduction de mélatonine engendrant chez un grand nombre de personnes une asthénie, voire une dépression saisonnière, qui disparaissent au printemps[réf. souhaitée].
Un nouvel antidépresseur (agomélatine[41]) cible les récepteurs à la mélatonine. La mélatonine peut avoir des effets positifs sur certaines maladies psychiatriques[42].
Des séances de luminothérapie permettent généralement de réguler la production de mélatonine[réf. nécessaire].
Syndrome prémenstruel
Une étude sur un petit groupe de femmes ayant un diagnostic de syndrome prémenstruel a montré que, lors de cette phase, les concentrations de mélatonine étaient significativement diminuées, ce qui pourrait expliquer les troubles du sommeil et la fatigue physique et psychique qui accompagne ce syndrome[43].
Sclérose latérale amyotrophique
Une étude chez la souris atteinte de sclérose latérale amyotrophique semble indiquer que la physiopathologie est associée avec un déficit en mélatonine ou son récepteur au niveau de la moelle épinière[44].
COVID-19
Sous réserve de confirmation par des essais contrôlés randomisés, des travaux américains récents (novembre 2020)[45],[46] font de la mélatonine un traitement théoriquement intéressant, complémentaire, contre le COVID-19 : après l'intubation elle améliorer les chances de survie des patients Covid-19 (+ 13,1 %) et non Covid-19 (+ 27,8 %). Idem chez les malades du Covid-19 sous ventilation mécanique (+ 12,7 %) mais pas chez ceux qui sont ventilés mécaniquement pour d'autres raisons que la Covid-19. Son mécanisme d'action est mal compris.
C'est peut-être en réduisant le syndrome inflammatoire induit par le virus SARS-CoV-2 qu'elle agirait. Ce résultat est issu d'analyses de données faites par une plate-forme d'intelligence artificielle du Lerner Research Institute lié à la Cleveland Clinic (États-Unis) visant à identifier de possibles médicaments (existants) contre le coronavirus. En outre selon le registre Covid-19 de la Cleveland Clinic les patients qui avaient un traitement comprenant de la mélatonine avaient 30 % de risques en moins d'avoir un tests positifs au SARS-CoV-2 (après ajustement de certaines variables tels que l'âge, l'origine ethnique, le tabagisme et diverses comorbidités). Et chez les afro-américains, le risque diminuait de 52 % (après ajustement pour les mêmes variables)[47].
Usage médical
La sécrétion nocturne de mélatonine est impliquée dans le déclenchement du sommeil. Elle est donc utilisée depuis quelques années, dans certains pays, pour soigner les troubles du sommeil (insomnies). La mélatonine est ainsi employée dans les insomnies en rapport avec le syndrome du décalage horaire lors des voyages transcontinentaux[48]. Dans les autres types d'insomnie (comme l'insomnie chez les personnes âgées), son efficacité n'est que modeste[49].
Aux États-Unis, au Canada et au Mexique, par exemple, la mélatonine est en vente libre.
En Europe, la mélatonine a obtenu une autorisation de mise sur le marché (AMM) via la procédure centralisée[50] dosée à 2 mg.
En France, la mélatonine est en vente libre depuis février 2014 dans les pharmacies et dans les grandes surfaces, mais elle n'est pas remboursée par l'Assurance-maladie. Cette molécule est toutefois inscrite sur la liste I des substances vénéneuses depuis le [51], jusqu'en où son inscription passe à la liste II[52]. Malgré ces mesures législatives, elle se trouverait encore commercialisée hors officine en 2014[53]. Elle dispose, en France, d'une AMM depuis 2008 et est commercialisée sous le nom de Circadin, mélatonine à libération prolongée[54],[55],[56]. Elle est indiquée, en monothérapie, pour le traitement à court terme de l'insomnie primaire caractérisée par un sommeil de mauvaise qualité chez des patients de 55 ans ou plus. Elle n'est pas remboursable dans les indications de l'AMM mais le médicament peut être pris en charge à titre dérogatoire par l'Assurance maladie dans la limite de 500 € par année civile et par patient dans l'indication : « traitement du trouble du rythme veille-sommeil, chez l'enfant de plus de 6 ans, associé à un syndrome de Rett ou à l'une des maladies neurogénétiques suivantes : syndrome de Smith-Magenis, syndrome d'Angelman, sclérose tubéreuse de Bourneville[54]. »
Les doses suggérées sont cependant très élevées. Les compléments alimentaires à base de mélatonine en vente libre contiennent de 3 à 10 fois plus de cette hormone qu'il n'est nécessaire pour augmenter la qualité du sommeil[57]. Ces hautes doses peuvent même être contre-productives. Des doses élevées de mélatonine peuvent exercer une action qui se propage à des phases qui ne sont pas des phases de réponse à la mélatonine (« too much melatonin may spill over onto the wrong zone of the melatonin phase-response curve »)[58]. Dans cette étude, 0,5 mg de mélatonine a été efficace, mais pas 20 mg (40 fois plus).
Sur un plan pratique, 0,3 mg (300 μg[59]) représente une dose quotidienne suffisante pour recaler un rythme circadien déphasé[réf. nécessaire]. Contrairement aux benzodiazépines, la mélatonine ne provoque pas de dépendance. Néanmoins, contrairement à ce qui peut être dit par les fabricants de compléments alimentaires, les doses de mélatonine sécrétées par l'organisme varient énormément entre individus (certaines personnes n'en sécrètent que très peu). À cela s'ajoute en plus une grande variabilité au cours de la vie en fonction de l'âge. Une administration de mélatonine nécessite donc un dosage individualisé basé sur un bilan sanguin à différentes heures de la journée comme cela est pratiqué en chrono-chimiothérapie pour réguler les cycles de sommeil des patients (voir travaux de l'unité de chronobiologie du l'hôpital Paul Brousse de Villejuif)[réf. nécessaire].
Analogues pharmaceutiques de la mélatonine
Alors que la mélatonine n'est pas largement recommandée par les autorités médicales[60], le ramelteon[61] ((S)-N-(2-(1,6,7,8-tétrahydro-2H-indéno-(5,4)furan-8-yl)éthyl)propionamide), vendu sous le nom de Rozerem (propriété de Takeda Pharmaceuticals), ainsi que le tasimelteon (en) qui est conçu pour activer les récepteurs de la mélatonine MT1 et MT2, a été approuvé pour le traitement de l'insomnie aux États-Unis.
Divers analogues sont étudiés visant les récepteurs de la mélatonine, par exemple testés contre les effets de la tension intraoculaire (chez le lapin au début des années 2000)[62],[63],[64].
Depuis 2011, il est prouvé que les récepteurs MT1 et MT2 agissent de manières opposées, le MT1 agissant sur le sommeil paradoxal (REM) et le MT2 sur le sommeil non-paradoxal (non-REM). Le développement d'un ligand sélectif du récepteur MT2 permet d’isoler les effets réparateurs spécifiques de son activation[65].
Traitement des douleurs chroniques liées à l'endométriose
La mélatonine réduit les scores de douleur quotidiens avec une amélioration de la qualité du sommeil des femmes souffrant d'endométriose[66].
Usages en médecine vétérinaire
La plupart des animaux semblent produire de la mélatonine et/ou y être sensibles. La mélatonine est aussi un produit vétérinaire qui permet des gestations à toute période de l'année chez des mammifères d'élevage (chèvre…). Les poules exposées à la lumière pondent toute l'année, phénomène induit par l'éclairage forcé.
Rôles de la lumière et de l'obscurité
L'impact de l'éclairage artificiel sur l'humain est encore mal mesuré, mais les aveugles souffrent souvent de troubles du sommeil. La prise quotidienne de mélatonine une heure avant le coucher recalerait leur rythme circadien sur le cycle de vingt-quatre heures et donc améliorerait, voire préviendrait, les troubles du sommeil[réf. nécessaire].
Effets indésirables
On a longtemps considéré que les effets indésirables de la mélatonine utilisée comme médicament ou en complément alimentaire (autorisée en France s'ils apportent moins de 2 mg/jour de mélatonine) étaient rares (excepté la somnolence, si prise à haute dose), car la mélatonine exogène n'était pas supposée affecter sa sécrétion endogène, à court ou moyen terme. Toutefois :
- la prise de mélatonine associée à un inhibiteur des monoamine oxydases (IMAO) peut provoquer un surdosage car les IMAO inhibent la métabolisation de la mélatonine par l'organisme ;
- une étude du département de nutrition de l'université Andrews indique que certains comprimés de mélatonine contiendraient jusqu'à 10 fois la dose nécessaire pour provoquer l'effet physiologique sur le niveau de mélatonine dans le sang pour améliorer le repos nocturne. Selon cette étude, à ces fortes doses, la mélatonine pourrait provoquer des migraines et des sautes d'humeur et déstabiliser l'équilibre hormonal de l'organisme (voir Usage médical, supra) ;[réf. souhaitée]
- en 2018, l'ANSES a recommandé à certaines populations de ne pas utiliser de compléments alimentaires contenant de la mélatonine ou de le faire après un avis médical[67]. Ceci fait suite à des effets indésirables signalés (en lien avec le programme français de nutrivigilance qui a reçu 90 cas d'effets indésirables avant 2018), qui évoquent des risques « en particulier des femmes enceintes et allaitantes, des enfants et des adolescents, des personnes souffrant de maladies inflammatoires, auto-immunes, d’épilepsie, d’asthme, de troubles de l’humeur, du comportement ou de la personnalité, ainsi que des personnes suivant un traitement médicamenteux[67]. La consommation est également déconseillée pour les personnes devant réaliser une activité nécessitant une vigilance soutenue chez lesquelles une somnolence pourrait poser un problème de sécurité »[67]. La mélatonine affecte l’horloge biologique mais aussi l'humeur, l'immunité, la température corporelle et la motricité intestinale et agit parfois comme vasodilatateur, vasoconstricteur et/ou comme pro-inflammatoire pouvant dans certains contextes ou en interagissant avec d’autres substances induire des effets indésirables généraux (« céphalées, vertiges, somnolence, cauchemars, irritabilité ») voire des troubles neurologiques (« tremblements, migraines ») et gastro-entérologiques (« nausées, vomissements, douleurs abdominales »)[67].
L'Agence recommande aux personnes en bonne santé de limiter ces compléments alimentaires et de les signaler à leur médecin[67].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Altun A, Ugur-Altun B, « Melatonin: therapeutic and clinical utilization », Int J Clin Pract, vol. 61, no 5, , p. 835–45 (PMID 17298593, DOI 10.1111/j.1742-1241.2006.01191.x).
- (en) Hardeland R, « Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance », Endocrine, vol. 27, no 2, , p. 119–30. (PMID 16217125, DOI 10.1385/ENDO:27:2:119)
- Reiter RJ, Acuña-Castroviejo D, Tan DX, Burkhardt S, « Free radical-mediated molecular damage. Mechanisms for the protective actions of melatonin in the central nervous system », Ann NY Acad Sci, vol. 939, , p. 200–15. (PMID 11462772, DOI 10.1111/j.1749-6632.2001.tb03627.x, Bibcode 2001NYASA.939..200R)
- https://www.topsante.com/medecine/votre-sante-vous/intox-detox/la-melatonine-a-t-elle-un-interet-dans-la-prevention-de-la-covid-19-641988
- https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3000970
- (en) Paredes SD, Korkmaz A, Manchester LC, Tan DX et RJ. Reiter, « Phytomelatonin: a review » Journal of Experimental Botany 2009;60(1):57–69.
- (en) REITER Russel J. ; DUN XIAN TAN ; BURKHARDT Susanne ; MANCHESTER Lucien C. ; Melatonin in plants, in Nutrition reviews ; 2001, Ed : International Life Sciences Institute ; vol. 59, no 9, p. 286-290 (47 ref.) ; ISSN 0029-6643 Fiche INIST CNRS.
- (en) Caniato R, Filippini R, Piovan A, Puricelli L, Borsarini A, Cappelletti E. « Melatonin in plants » Adv Exp Med Biol. 2003;527:593–7.
- (en) Caniato R, Filippini R, Piovan A, Puricelli L, Borsarini A, Cappelletti EM, « Melatonin in plants », Adv Exp Med. Biol., vol. 527, , p. 593–7. (ISBN 978-0-306-47755-3, PMID 15206778, DOI 10.1007/978-1-4615-0135-0_68)
- (en) Paredes SD, Korkmaz A, Manchester LC, Tan DX, Reiter RJ, « Phytomelatonin: a review », J Exp Bot, vol. 60, no 1, , p. 57–69 (PMID 19033551, DOI 10.1093/jxb/ern284)
- (en) Reiter RJ, Manchester LC, Tan DX. Melatonin in walnuts : Influence on levels of melatonin and total antioxidant capacity of blood. Nutrition. 2005 Sep;21(9):920-4.
- Tableau.
- (en) Paredes SD, Korkmaz A, Manchester LC, Tan DX, Reiter RJ, « Phytomelatonin : a review », J. Exp. Bot., vol. 60, no 1, , p. 57–69 (PMID 19033551, DOI 10.1093/jxb/ern284, lire en ligne).
- Garth R. Swanson, Annika Gorenz, Maliha Shaikh et Vishal Desai, « Decreased melatonin secretion is associated with increased intestinal permeability and marker of endotoxemia in alcoholics », American Journal of Physiology - Gastrointestinal and Liver Physiology, vol. 308, no 12, , G1004–G1011 (ISSN 0193-1857, PMID 25907689, PMCID 4469868, DOI 10.1152/ajpgi.00002.2015, lire en ligne, consulté le )
- Young Sook Park, Soo Hyung Kim, Jong Won Park et Younglim Kho, « Melatonin in the colon modulates intestinal microbiota in response to stress and sleep deprivation », Intestinal Research, vol. 18, no 3, , p. 325–336 (ISSN 1598-9100, PMID 32564539, PMCID 7385569, DOI 10.5217/ir.2019.00093, lire en ligne, consulté le )
- (en) Andries Kalsbeek et al. (2000), « Melatonin sees the light: blocking GABA-ergic transmission in the paraventricular nucleus induces daytime secretion of melatonin » European Journal of Neuroscience vol. 12, no 9, pages 3146–3154, septembre 2000 ; DOI:10.1046/j.1460-9568.2000.00202.x (résumé)
- Étude conduite par Philippe Froguel (laboratoire Génomique et physiologie moléculaire des maladies métaboliques ; CNRS/ Université Lille 2 Droit et Santé/ Institut Pasteur de Lille) et l'Imperial College London, en collaboration avec des équipes françaises, finlandaises et danoises, sur la base de l'analyse du génome de 23 000 personnes, publiée dans Nature Genetics en décembre 2008 (A variant near MTNR1B is associated with increased fasting plasma glucose levels and type 2 diabetes risks. N. Bouatia-Naji et al. ; Nature Genetics, numéro 41, pages 89–94, 2009, https://doi.org/10.1038/ng.277 ). Les résultats de cette étude ont été confirmés par deux autres études internationales publiées au même moment (CNRS).
- Article « Les clés du sommeil », Pour la Science, janvier 2004.
- (en) Tan D. X., Manchester L. C., Reiter R. J., Qui W. B. Karbownik M., Calvo J. R. (2000) Significance of melatonin in antioxidative defense system: reaction and products. Biol. Signal. Recept. 9: 137-159
- (en) Korkmaz A, Reiter RJ, Topal T, Manchester LC, Oter S, Tan DX, « Melatonin : an established antioxidant worthy of use in clinical trials », Mol. Med., vol. 15, nos 1-2, , p. 43–50 (PMID 19011689, PMCID 2582546, DOI 10.2119/molmed.2008.00117, lire en ligne).
- (en) Akcay YD, Yalcin A, Sozmen EY, « The effect of melatonin on lipid peroxidation and nitrite/nitrate levels, and on superoxide dismutase and catalase activities in kainic acid-induced injury », Cell. Mol. Biol. Lett., vol. 10, no 2, , p. 321–9 (PMID 16010296, lire en ligne [PDF]).
- (en) Poeggeler B, Saarela S and RJ. Reiter, 1994. Melatonin—a highly potent endogenous radical scavenger and electron donor: new aspects of the oxidation chemistry of this indole accessed in vitro. Ann. N. Y. Acad. Sci. 738: 419–20
- (en) Bejarano I, Espino J, Marchena AM, Barriga C, Paredes SD, Rodríguez AB, Pariente JA, Melatonin enhances hydrogen peroxide-induced apoptosis in human promyelocytic leukaemia HL-60 cells ; Mol Cell Biochem. 2011 Jul;353(1-2):167-76. Epub 2011 Mar 23 (Résumé).
- (en) Ferreira Cda S, Maganhin CC, Simões Rdos S, Girão MJ, Baracat EC, Soares-Jr JM.Melatonin: cell death modulator ; Rev Assoc Med Bras. 2010 Nov-Dec; 56(6):715-8. (Résumé)
- (en) Cucina A, Proietti S, D'Anselmi F, Coluccia P, Dinicola S, Frati L, Bizzarri M., Evidence for a biphasic apoptotic pathway induced by melatonin in MCF-7 breast cancer cells ; J Pineal Res. 2009 Mar; 46(2):172-80. Epub 2008 Oct 29 (Résumé)
- (en) Sánchez-Barceló EJ, Cos S, Fernández R, Mediavilla MD. , Melatonin and mammary cancer: a short review, Endocr Relat Cancer, juin 2003, 10(2):153-9. (Résumé)
- (en) Manchester L. C., Poeggeler B., Alvares F. L., Ogden G. B., ReiterR. J., Melatonin immunoreactivity in the photosynthetic prokaryote Rhodospirillum rubrum : implications for an ancientantioxydant system, Cell Molec. Biol. Res., 41, 1995, p.391-395.
- Rodolphe Beaud, Hydroarylation régiosélective d’indoles pour l’accès aux motifs 3 - arylindolines : études et applications d’une nouvelle réactivité de l’indole, Institut de Chimie Moléculaire et des Matériaux d'Orsay, Université Paris-Sud, (HAL tel-01127058, présentation en ligne, lire en ligne [PDF]), p. 28.
- Basile M, Romeo C, Gitto E, Spitz L, Pierro A, Eaton S, Melatonin protects from, but does not reverse, the effects of mediators of sepsis on liver bioenergetics ; Journal : Pediatric Surgery International ; 2004, p. 263-266 (Résumé)
- (en) Rüdiger Hardeland, « Antioxidative protection by melatonin », Endocrine, vol. 27, no 2, , p. 119–130 (résumé).
- (en) Isaac Antolín, Barbara Obst, Susanne Burkhardt et Rüdiger Hardeland, « Antioxidative protection in a high-melatonin organism: the dinoflagellate Gonyaulax polyedra is rescued from lethal oxydative stress by strongly elevated, but physiologically possible concentrations of melatonin », Journal of Pineal Research, vol. 23, no 4, , p. 182–190 (résumé).
- (en) Vasin MV, Ushakov IB, Suvorov NN. « Radioprotective effectiveness of indralin in local gamma irradiation of the skin » Radiats Biol Radioecol. 1998 Jan-Feb; 38(1):42-54. (Résumé)
- (en) Vasin MV, Ushakov IB, Kovtun VIu, Komarova SN, Semenova LA, Galkin AA. « Comparative effectiveness of antioxidant melatonin and radioprotectors indralin and phenylephrine in local radiation injuries » Radiats Biol Radioecol. 2004;44(1):68-71. Article en Russe, Résumé en anglais, Source Institute of Military Medicine, Ministry of Deferense of Russian Federation, 126083 Russia
- (en) E.B. Arushanian, E.V. Beĭer, A.S. Bulgakova, « Pineal melatonin exhibits more pronounced antistressor properties than anxiolytic diazepam », Eksperimental'naia i Klinicheskaia Farmakologiia, vol. 70, no 6, , p. 9-12 (résumé).
- (en) E.B. Arushanian, E.V. Beĭer, « Immunotropic properties of pineal melatonin », Eksperimental'naia i Klinicheskaia Farmakologiia, vol. 65, no 5, , p. 73-80 (résumé).
- (en) L.A. Brotto et B.B. Gorzalka, « Melatonin enhances sexual behavior in the male rat », Physiology & Behavior, vol. 68, no 4, , p. 483–486 (résumé).
- FA. Scheer, CJ. Morris, JI. Garcia, C. Smales, EE. Kelly, J. Marks, A. Malhotra et SA. Shea, « Repeated melatonin supplementation improves sleep in hypertensive patients treated with beta-blockers: a randomized controlled trial. », Sleep, vol. 35, no 10, , p. 1395-402 (PMID 23024438, DOI 10.5665/sleep.2122)
- (en) Rixt F. Riemersma-van der Lek, Dick F. Swaab, Jos Twisk, Elly M. Hol, Witte J. G. Hoogendijk, Eus J. W. Van Someren, « 'Effect of bright light and melatonin on cognitive and non cognitive function of elderly residents of group care facilities. A randomized controlled trial », Journal of the American Medical Association (JAMA), vol. 229, no 22, , p. 2642-2655 (résumé).
- Cité dans un « Article de Julie Luong intitulé Lumière et mélatonine contre la maladie d'Alzheimer »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (15 octobre 2008).
- Médicament développé par les laboratoires Servier et Novartis qui est vendu sous le nom de Valdoxan.
- (en) Maria D. Maldonado, Russel J. Reiter et Maria A. Pérez-San-Gregorio, « Melatonin as a potential therapeutic agent in psychiatric illness », Human Psychopharmacology: Clinical and Experimental, vol. 24, no 5, , p. 391–400 (ISSN 1099-1077, DOI 10.1002/hup.1032, lire en ligne, consulté le )
- A. Shechter, P. Lespérance, NM. Ng Ying Kin et DB. Boivin, « Pilot Investigation of the Circadian Plasma Melatonin Rhythm across the Menstrual Cycle in a Small Group of Women with Premenstrual Dysphoric Disorder. », PLoS One, vol. 7, no 12, , e51929 (PMID 23284821, DOI 10.1371/journal.pone.0051929, lire en ligne)
- (en)Yi Zhanga, « Melatonin inhibits the caspase-1/cytochrome c/caspase-3 cell death pathway, inhibits MT1 receptor loss and delays disease progression in a mouse model of amyotrophic lateral sclerosis », Neurobiology of Disease, vol. 55, 2013, Pages 26–35 résumé en ligne
- (en) Vijendra Ramlall, Jason Zucker et Nicholas Tatonetti, « Melatonin is significantly associated with survival of intubated COVID-19 patients », MedRxiv (prépublication), Health Informatics, (PMID 33083812, PMCID PMC7574268, DOI 10.1101/2020.10.15.20213546, lire en ligne, consulté le )
- (en) Yadi Zhou, Yuan Hou, Jiayu Shen et Reena Mehra, « A network medicine approach to investigation and population-based validation of disease manifestations and drug repurposing for COVID-19 », PLOS Biology, vol. 18, no 11, , e3000970 (ISSN 1545-7885, DOI 10.1371/journal.pbio.3000970, lire en ligne, consulté le )
- Luc Ruidant, « Covid-19 : la piste prometteuse de la mélatonine », sur Site-UpdateSpecialiste-FR, (consulté le )
- (en) Sack RL, Auckley D, Auger RR. et al. « Circadian rhythm sleep disorders: part I, basic principles, shift work and jet lag disorders. An American Academy of Sleep Medicine review » Sleep. 2007;30:1460–1483
- (en) Buscemi N, Vandermeer B, Hooton N. et al. « The efficacy and safety of exogenous melatonin for primary sleep disorders. A meta-analysis » J Gen Intern Med. 2005;20:1151–1158
- , Agence européenne des médicaments.
- Journal officiel de la République française no 0082 du 7 avril 2009 page 6068, Arrêté du 26 mars 2009 portant classement sur les listes des substances vénéneuses, NOR:SASP0907274A.
- Journal officiel de la République française no 0231 du 5 octobre 2011 page 16842, texte no 21, Arrêté du 23 septembre 2011 portant classement sur les listes des substances vénéneuses, NOR: ETSP1125961A.
- Damien Mascret, « La mélatonine encore en vente libre malgré l'interdiction », Le Figaro - Santé, (lire en ligne)
- « Avis HAS Circadin », sur HAS, (consulté le )
- , Agence française de sécurité sanitaire des produits de santé.
- , Agence française de sécurité sanitaire des produits de santé.
- (en) Zhdanova I, Wurtman R, Regan M, Taylor J, Shi J, Leclair O. « Melatonin treatment for age-related insomnia » J Clin Endocrinol Metab. 2001;86(10) p. 4727-30
- (en) Lewy AJ, Emens JS, Sack RL, Hasler BP, Bernert RA. « Low, but not high, doses of melatonin entrained a free-running blind person with a long circadian period » Chronobiol Int. 2002;19, 3, p. 649-58,
- µg : microgrammes.
- (en) Wolkove N, Elkholy O, Baltzan M, Palayew M, « Sleep and aging : 2. Management of sleep disorders in older people » CMAJ : Canadian Medical Association Journal - Journal de l'Association médicale canadienne 2007, volume 176, no 10, p. 1449-54
- (en) McGechan A, Wellington K. « Ramelteon » CNS Drugs 2005;19:1057-65; discussion 1066-7.
- (en) Pilar Alarma-Estrany, Ana Guzman-Aranguez, Fernando Huete, Assumpta Peral, Robert Plourde Jr, Teresa Pelaez, Benjamin Yerxa et Jesús Pintor, « Design of novel melatonin analogs for the reduction of intraocular pressure in normotensive rabbits », The Journal of Pharmacology and Experimental Therapeutics, vol. 337, no 3, , p. 703-709 (résumé).
- Pintor J, Peláez T, Hoyle CH, Peral A. « Ocular hypotensive effects of melatonin receptor agonists in the rabbit: further evidence for an MT3 receptor » Br J Pharmacol. 2003 Mar;138(5):831-6. (Résumé)
- (en) Andrés-Guerrero V, Alarma-Estrany P, Molina-Martínez IT, Peral A, Herrero-Vanrell R, Pintor « Ophthalmic formulations of the intraocular hypotensive melatonin agent 5-MCA-NAT » J Exp Eye Res. 2009 Mar; 88(3):504-11. Epub 2008 Nov 14. (Résumé)
- « Les secrets de l'« hormone du sommeil » révélés par des chercheurs. Une découverte conduit au développement d’un nouveau traitement prometteur pour l’insomnie » communiqué de presse, centre Universitaire de santé McGill, 14 décembre 2011
- (en) Schwertner A, Conceição dos Santos CC, Dalferth Costa G et al. « Efficacy of melatonin in the treatment of endometriosis: A phase II, randomized, double-blind, placebo-controlled trial » Pain 2013;154:874-81.
- ANSES (2018) L’Anses recommande à certaines populations d’éviter la consommation de compléments alimentaires contenant de la mélatonine Actualité du 11/04/2018
Bibliographie
- (en) Eva Berger, Jan-Dirk Fauteck, Erwin-Josef Speckmann, « Melatonin receptors in rat hippocampus: molecular and functional investigations », Hippocampus, New York, Wiley-Liss, vol. 12, no 2, , p. 165-173 (ISSN 1050-9631, OCLC 5154408590)
- (en) Jan-Dirk Fauteck et Andrea Eder (trad. de l'allemand), The Magic of Melatonin : how this amazing hormone will help you sleep, reduce pain, relieve anxiety, slow aging, and much more [« Melatonin : das Geheimnis eines wunderbaren Hormons »], New York, Skyhorse Publishing, , xvii, 180 (ISBN 9781510747920, OCLC 1130689722)
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) International Union of Pharmacology
- (en) Medical Subject Headings
- (en) National Drug File
- (en) PatientLikeMe
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- La mélatonine
- Portail de la médecine
- Portail des neurosciences
- Portail de la pharmacie
- Portail de l’autisme