Alopecosa
Alopecosa est un genre d'araignées aranéomorphes de la famille des Lycosidae[1].

| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Sous-embr. | Chelicerata |
| Classe | Arachnida |
| Ordre | Araneae |
| Sous-ordre | Araneomorphae |
| Famille | Lycosidae |
- Jollecosa Roewer, 1960
- Solicosa Roewer, 1960
Distribution
Les espèces de ce genre se rencontrent pour la plupart en écozone holarctique et quelques-unes en zones néotropicale, afrotropicale, océanienne, indomalaise et australasienne[1].
Description
Pattes antérieures du mâle
Au sein du genre, alors que la femelle d' Alopecosa cuneata (Clerk) a des pattes antérieures d'aspect "normal" (Fig.1), le mâle se singularise toujours par un renflement tibial fusiforme qui apparaît juste avant la dernière mue (Fig. 2,3). Ce renflement présente deux dépressions obliques pro et rétrolatérales tranchant, par leur teinte claire, sur la couleur noir intense de l’article. Il s’agit là d’un caractère sexuel secondaire propre au mâle, découvert par Sundevall (1832 : " tibias anticas crassissimas ovatas "), paraissant unique chez les Lycosidae et jouant un rôle dans l’accouplement car la femelle l’étreint au cours des préludes (Kronestedt, 1979). Sa surface présente au Microscope électronique à balayage (M.E.B) de nombreux pores cuticulaires censés émettre un sémiochimique (Fig.4)[2], retrouvés ensuite par Dahlem, Gack et Martens en 1987[3] et en relation avec un organe glandulaire sous-jacent que ces derniers n'auraient qu'entrevu dans des coupes sommaires.
Il a donc été réalisé sur le tibia un examen histologique plus complet, d'autres photos au M.E.B et une étude ultrastructurale[4]. Il s'agissait de la toute première recherche portant sur un caractère sexuel glandulaire d’appendice prosomatique mâle autre que le bulbe copulateur du pédipalpe. Le matériel provenait de mâles d’Alopecosa cuneata, adultes et subadultes, tous récoltés dans les monts de Lacaune (nord-ouest de l’Hérault, France). Outre l'application de techniques histologiques banales, il a été préparé pour le M.E.B. et surtout, la microscopie électronique à transmission. (M.E.T.).
Microscopie électronique à balayage
Chaque zone claire latérotibiale se présente comme une dépression en cuvette peu profonde et presque glabre qu'entourent des poils banaux. Chez les mâles adultes, elle renferme généralement un matériel amorphe, granulo-filamenteux, plus ou moins craquelé et d'aspect sécrétoire. Les pores découverts par Kronestedt en 1986[2] chez d’autres spécimens (Fig.), sont bien visibles sur les bords de cette même dépression (Fig.). Ils s’y disposent sans ordre apparent, s’isolent parfois entre les bases de poils voisins et se présentent comme des orifices arrondis, réguliers(diamètre : 1,5 µm). Situés au ras du tégument (Fig.) ou, beaucoup plus souvent, sur une saillie oblongue les surélevant en position oblique (Fig), ces orifices présentent en gros la même orientation. Certains d’entre eux émettent une substance qui s’étire en filaments et se fond parfois dans le contenu de la dépression.
Structure histologique
Au niveau de chaque dépression, l’épiderme est modifié en regard des pores. Il est haut de 40 à 50 µm, recouvert par une cuticule de même épaisseur et séparé d’un vaste sinus hémolymphatique sous-jacent par une basale peu visible (Fig. ).
Epithélium
L’épithélium tégumentaire comporte 3 catégories de cellules.
Les plus grandes ont un aspect d’adénocytes globuleux (diamètre : 30 µm environ), à noyau arrondi (6 à 7 µm) nettement nucléolé, à cytoplasme basophile dans sa partie basale, spongieux et très éosinophile dans sa partie apicale où l’on discerne un « réservoir » à pourtour vaguement strié ainsi qu’un grêle canalicule.
Une deuxième catégorie de cellules s’interpose entre les adénocytes et la cuticule sus-jacente ; satellites des canalicules, elles ont des limites peu distinctes, contiennent des granulations pigmentaires et ont un petit noyau anguleux (3-4 µm), très chromatique, plus ou moins parallèle au revêtement chitineux.
La troisième catégorie se compose de cellules interposées entre les adénocytes qu’elles paraissent soutenir ; renfermant aussi du pigment dans leur cytoplasme étiré, elles sont plus ou moins perpendiculaires à la cuticule et montrent un noyau également très colorable mais plus régulier et allongé (jusqu’à 10 µm)(Fig.) .
Chez les mâles subadultes, l’épithélium glandulaire, bien que déjà épais et stratifié, ne montre pas de différenciation évidente en plusieurs catégories de cellules, notamment en adénocytes.
Au voisinage immédiat de l’épiderme ainsi différencié en organe glandulaire, le revêtement épithélial montre encore une zone épaissie, d’aspect réticulé et lacunaire, avec quelques adénocytes inclus parmi les cellules très vacuolisées quii le constituent. Au delà, l’épiderme ne présente plus qu’un aspect banal : épithélium prismatique simple, à petites cellules régulières monomorphes, ne dépassant pas 10 µm de hauteur.
Cuticule
Le revêtement cuticulaire est traversé par des canalicules peu visibles, issus des adénocytes sous-jacents, très grêles, plus ou moins arqués et aboutissant juste au-dessous de la surface à une « vésicule » claire que surmonte un pore (Fig.). Chez les mâles subadultes, il ne semble pas renfermer encore de canalicules.
Sinus sanguin
Le sinus hémolymphatique a une ampleur inhabituelle et paraît plus responsable du renflement tibial que l’épiderme modifié. Il ne ménage qu’une place étroite pour les nerfs et les muscles, occupe presque tout le centre de l’article, renferme de petits vaisseaux qui s’y ouvrent et surtout, une quantité considérable d’hémocytes à disposition compacte. Ces cellules sont souvent granuleuses et paraissent se rattacher à 4 catégories distinctes que met surtout en évidence le bleu de toluidine.Chez les mâles subadultes, le sinus est également très développé et riche en hémocytes.
Ultrastructure
Son étude est la première réalisée sur une glande prosomatique appendiculaire mâle autre que le pédipalpe. Les recherches de A.Lopez (1990) au M.E.T. ont montré que l’épiderme modifié est formé par un ensemble d’unités fonctionnelles bien individualisées, autonomes, présentant toutes la même organisation ultrastructurale, et par des cellules de soutien.
Une lame basale très mince (30 nanomètres), continue et finement granuleuse les sépare bien du sinus et ses hémocytes.
Chaque unité fonctionnelle ou glandulaire se compose d’un adénocyte et d’un appareil cuticulaire s’étendant de cette cellule sécrétrice à l’un des pores de surface. Les différentes unités sont entourées par des cellules épithéliales de soutien.
Adénocyte
L’adénocyte est volumineux (30 µm), grossièrement pyramidal et repose sur la lame basale l’isolant du sinus hémolymphatique adjacent. Sa membrane plasmique présente des replis en augmentant la surface, au niveau des faces latérales, qui s’engrènent avec les adénocytes voisins, et surtout au niveau du pôle basal où ils s’enfoncent profondément. De plus, elle pénètre dans le pôle apical qui présente ainsi une invagination de l’espace extracellulaire vaste, profonde et sinueuse, en “ cul-de-sac ” ou “ doigt de gant ”. Ce “réservoir” est garni sur son pourtour par des microvillosités (Fig.) ; il renferme, en position axiale, un canalicule récepteur (partie initiale de l’appareil cuticulaire) et un matériel granulo-filamenteux, séparant comme un « manchon », le conduit des microvillosités (Fig.). Ces dernières sont très nombreuses, irrégulières, flexueuses contiennent des microfilaments, présentent des densifications apicales très osmiophiles et se détachent parfois de lames saillantes entre lesquelles la membrane cellulaire pénètre profondément dans le hyaloplasme. Les « cryptes » ainsi formées sont surtout visibles dans le compartiment basolatéral.
Le noyau est volumineux, clair plus ou moins arrondi, parfois irrégulier. Il renferme un gros nucléole réticulé excentrique, et une chromatine peu abondante, dispersée ou réunie en petites mottes périphériques. Son enveloppe est pourvue de pores très apparents et délimite un espace périnucléaire souvent élargi, en relation avec les cavités du réticulum
Les organites subcellulaires les plus remarquables sont de petites mitochondries remarquablement nombreuses, allongées, cylindriques, plus ou moins flexueuses, à crêtes parallèles, siégeant dans les replis du pôle basal et surtout, près de la cavité extracellulaire où elles peuvent s’engager dans les lames apicales. L’appareil de Golgi est constitué par des empilements de saccules membranaires (“dictyosomes”) siégeant surtout en périphérie dans la moitié basale de l’adénocyte et bourgeonnant de petites vésicules à contenu dense (Fig.12). Le réticulum endoplasmique, de type rugueux ou granulaire, siège aussi en périphérie, au voisinage du noyau mais paraît peu développé. On note aussi une grande quantité de ribosomes libres, des lysosomes hétérogènes dispersés et des microfilaments.
Une activité sécrétoire est représentée par les vésicules denses golgiennes et, semble-t-il, d’autres vésicules siégeant au voisinage des empilements mais qui sont claires, avec un contour très net, bien dessiné par une fine membrane lisse ; elles vont s’ouvrir entre les pieds des microvillosités et au fond des « cryptes » entre les bases des lames. Leur contenu pénètre ainsi entre les microvilli et le matériel granulo-filamenteux dans l’espace extracellulaire, dont il semble gagner la partie profonde ou basale, formant à ce niveau un « lac » de sécrétion, homogène et modérément osmiophile.
Appareil cuticulaire

Il comporte une portion initiale réceptrice, une portion conductrice et des cellules canalaires ou canaliculaires.
Portion réceptrice
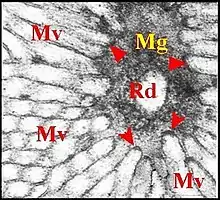
Elle est représentée par le canalicule récepteur et se loge dans la cavité extracellulaire où, d’abord excentrique, elle devient ensuite axiale et décrit des sinuosités marquées de sorte que plusieurs de ses sections peuvent apparaître dans une même coupe (Fig.). La paroi de ce canalicule, de nature épicuticulaire probable, est formée par une couche unique entourant la lumière, assez dense, lisse et régulière sur sa face interne, un peu mamelonnée sur sa face externe(Fig), non fenestrée mais vraisemblablement interrompue à l’origine du canalicule où elle semble s'ouvrir directement dans la partie basale de la cavité extracellulaire (Fig.). La sécrétion du «lac» se retrouve fréquemment dans la lumière du canalicule qu’elle emplit. Le canalicule récepteur constitue un “ appareil terminal ”(“end apparatus”) typique avec les microvillosités qui l’entourent et s’ancrent par leurs densifications apicales sur le manchon granulo-filamenteux (Fig.).Il s’abouche à la portion conductrice qui est dans son prolongement direct (Fig.).
Portion conductrice
Elle est formée par un canalicule conducteur ou excréteur, simple, isolé des autres conduits depuis l’adénocyte jusqu’à sa terminaison poraire, lui aussi très long et sinueux. Ce canalicule présente une lumière ovale ou arrondie, d’un calibre plus gros que celui de la portion réceptrice, allant d’ailleurs en croissant, et une paroi formée par une seule couche d’épicuticule, dense, opaque et homogène, compacte, ininterrompue, très osmiophile, lisse intérieurement et irrégulière sur sa face externe. Lors de sa traversée de la cuticule, et juste avant d’en atteindre la surface, il se dilate en une chambre ampullaire ovoïde (D = 2,8 µm)(fig.) correspondant à la « vésicule » claire des coupes histologiques et s’ouvrant à l’extérieur par le pore, surélevé ou non. Le canalicule conducteur ou excréteur est presque entièrement logé dans une cellule canaliculaire. Haut située dans l’épiderme modifié, elle est entourée par d’autres éléments du même type ou par des cellules épithéliales de soutien, a des contours très irréguliers, des prolongements lui donnant un aspect « stellaire » et s’enroule autour du canalicule conducteur ; l’accolement de ses faces affrontées donne naissance à un très long méso sinueux que ferme un desmosome (Fig.). Le noyau est irrégulier et contient une chromatine abondante, en mottes marginales denses. Le cytoplasme, étroit et clair, renferme du réticulum, des grains sphériques denses de pigment mélanique et ne montre pas d’activité sécrétoire.
Cellule canaliculaire
Elle pénètre, par une expansion, dans la partie supérieure de la cavité extracellulaire de l’adénocyte auquel elle est unie par une jonction, l’obture comme un bouchon et y englobe le canalicule conducteur dès son origine. Un autre prolongement accompagne le canal dans la partie profonde de sa traversée cuticulaire où il l’isole de l’endocuticule voisine. D’autres enfin s’insinuent entre les cellules épidermiques adjacentes.
Cellules de soutien
Etendues de la lame basale à la cuticule, ces cellules épithéliales épidermiques sont volumineuses, grossièrement prismatiques et réunies par des jonctions (desmosomes) lorsqu’elles se juxtaposent. Le pôle apical ne présente pas d’invagination de l’espace extracellulaire, est hérissé de microvilli courtes, très serrées, avec des densifications appliquées sur la cuticule (Fig.) et émet aussi quelques prolongements s’engageant dans les canaux poraires. Les faces latérales sont nettes, presque rectilignes et non engrenées.
Le pôle basal présente des hémidesmosomes nombreux, petits et rapprochés qui l’ancrent sur la lame sous-jacente.
Le noyau rappelle celui des cellules canaliculaires, est assez irrégulier, pourvu d’une chromatine marginale abondante et d’un nucléole dense. Le cytoplasme renferme des ribosomes libres, un réticulum endoplasmique granulaire formé par de très nombreuses petites vésicules, des mitochondries plus grosses que celles de l’adénocyte, à crêtes serrées, un appareil de Golgi réduit, semble-t-il, à quelques dictyosomes, et des inclusions pigmentaires sphériques (Fig.). On note aussi en périphérie des faisceaux de microtubules et de microfilaments qui ont une disposition longitudinale (Fig.).
Anatomie
Sur le plan anatomique, le renflement tibial des pattes I d’Alopecosa cuneata mâle se présente comme un organe assez complexe, associant une glande épidermique exocrine et un vaste sinus sanguin qui n’a pas donné lieu à des recherches plus poussées.
La glande et la cuticule sus-jacente peuvent être rattachées au cadre restreint des équipements sécréteurs connus dans les pattes de certaines Araignées : également dans le tarse des mâles d’Arkys (Araneidae), Ablemma et Brignoliella (Tetrablemmidae) ; dans les fémurs et tibias des deux sexes chez les Zodariinae, Telemidae, Leptonetidae, Agelenidae (Cybaeota)
La structure fine des unités constituant la glande tibiale permet de les rattacher à la classe 3 des cellules glandulaires épidermiques telles que Noirot et Quennedey en 1974[5] les ont décrites chez les Insectes.
L’adénocyte se singularise par des microvillosités souvent groupées sur des lames cytpoplasmiques non observées dans les autres glandes d’Araignées et par la richesse de son chondriome. Responsable de l’éosinophilie cytoplasmique observée en histologie, un nombre aussi élevé de mitochondries n’a guère été observé ailleurs que dans les glandes épidermiques sous-oculaires (appelées à tort « clypéales ») des Mynoglenes, mâles et femelles ( Blest & Taylor, 1977). Il suggère dans l’adénocyte tibial des transferts et un métabolisme intenses pouvant être en rapport avec l’un des stades de l’activité sécrétoire.
Le canalicule récepteur est remarquable par ses sinuosités, par l ’absence de fenestrations pariétales et par son ouverture dans l'espace extracellulaire, vraisemblablement terminale comme dans la glande labiosternale et la glande rétrogonoporale de Lepthyphantes. Le canalicule conducteur se singularise lui aussi par des sinuosités et surtout, la dilatation ampullaire sub-terminale non rencontrée dans d’autres organes glandulaires.
Fonction
Sur le plan fonctionnel, l’ultrastructure particulière de la glande tibiale qui comporte un appareil terminal dans chacune de ses unités, plaide en faveur d’une sécrétion de phéromone sexuelle par analogie avec celles d’autres organes Araneidiens (glande acronale ou clypéale) ou de nombreuses glandes d’ Insectes.
Ici plus qu’ailleurs, le rejet des sécrétats doit être lié à la pression que l’hémolymphe exerce sur les adénocytes en s’accumulant dans le vaste sinus. Les cellules sanguines pourraient leur avoir préalablement transmis des métabolites particuliers.
Le matériel élaboré sort ensuite par les pores et emplit les dépressions latérales du tibia. Il renferme probablement un sémiochimique volatile exerçant sur la femelle, un effet d’abord attractif, lorsqu’elle s’approche du mâle, saisit ses tibias avec les chélicères lors de premiers contacts très fugaces, et ensuite « aphrodisiaque », lorsqu’elle l’étreint plus longuement, rapprochant ses parties buccales de la sécrétion (Kronestedt, 1979).
Il semblerait d’ailleurs que les premiers tibias d’une autre Lycoside, Xerolycosa miniata, présentent également de nombreux pores chez le mâle et soient saisis par la femelle lors de la cour[6].
Liste des espèces
Selon World Spider Catalog (version 23.5, 09/08/2022)[7] :
- Alopecosa aculeata (Clerck, 1757)
- Alopecosa akkolka Marusik, 1995
- Alopecosa albofasciata (Brullé, 1832)
- Alopecosa albonotata (Schmidt, 1895)
- Alopecosa albostriata (Grube, 1861)
- Alopecosa albovittata (Schmidt, 1895)
- Alopecosa alpicola (Simon, 1876)
- Alopecosa andesiana (Berland, 1913)
- Alopecosa artenarensis Wunderlich, 1992
- Alopecosa atis Caporiacco, 1949
- Alopecosa auripilosa (Schenkel, 1953)
- Alopecosa aurita Chen, Song & Kim, 2001
- Alopecosa ayubaevorum Fomichev & Logunov, 2015
- Alopecosa azsheganovae Esyunin, 1996
- Alopecosa balinensis (Giltay, 1935)
- Alopecosa barbipes (Sundevall, 1833)
- Alopecosa beckeri (Thorell, 1875)
- Alopecosa camerunensis Roewer, 1960
- Alopecosa canaricola Schmidt, 1982
- Alopecosa cedroensis Wunderlich, 1992
- Alopecosa chagyabensis Hu & Li, 1987
- Alopecosa cinnameopilosa (Schenkel, 1963)
- Alopecosa cronebergi (Thorell, 1875)
- Alopecosa cuneata (Clerck, 1757)
- Alopecosa cursor (Hahn, 1831)
- Alopecosa cursorioides Charitonov, 1969
- Alopecosa curtohirta Tang, Urita & Song, 1993
- Alopecosa deserta Ponomarev, 2007
- Alopecosa disca Tang, Yin & Yang, 1997
- Alopecosa dryada Cordes, 1996
- Alopecosa edax (Thorell, 1875)
- Alopecosa ermolaevi Savelyeva, 1972
- Alopecosa etrusca Lugetti & Tongiorgi, 1969
- Alopecosa exasperans (O. Pickard-Cambridge, 1877)
- Alopecosa fabrilis (Clerck, 1757)
- Alopecosa farinosa (Herman, 1879)
- Alopecosa fedotovi (Charitonov, 1946)
- Alopecosa fuerteventurensis Wunderlich, 1992
- Alopecosa fulvastra Caporiacco, 1955
- Alopecosa gachangensis Seo, 2017
- Alopecosa garamantica (Caporiacco, 1936)
- Alopecosa gomerae (Strand, 1911)
- Alopecosa gracilis (Bösenberg, 1895)
- Alopecosa grancanariensis Wunderlich, 1992
- Alopecosa hamata (Schenkel, 1963)
- Alopecosa hermiguensis Wunderlich, 1992
- Alopecosa himalayaensis Hu, 2001
- Alopecosa hingganica Tang, Urita & Song, 1993
- Alopecosa hirta (Kulczyński, 1908)
- Alopecosa hirtipes (Kulczyński, 1907)
- Alopecosa hoevelsi Schmidt & Barensteiner, 2000
- Alopecosa hokkaidensis Tanaka, 1985
- Alopecosa huabanna Chen, Song & Gao, 2000
- Alopecosa hui Chen, Song & Kim, 2001
- Alopecosa inderensis Ponomarev, 2007
- Alopecosa inimica (O. Pickard-Cambridge, 1885)
- Alopecosa inquilina (Clerck, 1757)
- Alopecosa irinae Lobanova, 1978
- Alopecosa kalahariana Roewer, 1960
- Alopecosa kalavrita Buchar, 2001
- Alopecosa kaplanovi Oliger, 1983
- Alopecosa kasakhstanica Savelyeva, 1972
- Alopecosa kochi (Keyserling, 1877)
- Alopecosa koponeni Blagoev & Dondale, 2014
- Alopecosa kovblyuki Nadolny & Ponomarev, 2012
- Alopecosa kratochvili (Schenkel, 1963)
- Alopecosa krynickii (Thorell, 1875)
- Alopecosa kulczynski Sternbergs, 1979
- Alopecosa kulczynskii (Bösenberg, 1895)
- Alopecosa kulsaryensis Ponomarev, 2012
- Alopecosa kungurica Esyunin, 1996
- Alopecosa kuntzi Denis, 1953
- Alopecosa laciniosa (Simon, 1876)
- Alopecosa lallemandi (Berland, 1913)
- Alopecosa latifasciata (Kroneberg, 1875)
- Alopecosa leonhardii (Strand, 1913)
- Alopecosa lessertiana Brignoli, 1983
- Alopecosa licenti (Schenkel, 1953)
- Alopecosa lindbergi Roewer, 1960
- Alopecosa linzhan Chen & Song, 2003
- Alopecosa litvinovi Izmailova, 1989
- Alopecosa longicymbia Savelyeva, 1972
- Alopecosa madigani (Hickman, 1944)
- Alopecosa mariae (Dahl, 1908)
- Alopecosa marikovskyi Logunov, 2013
- Alopecosa medvedevi Ponomarev, 2009
- Alopecosa michaelseni (Simon, 1902)
- Alopecosa mikhailovi Omelko, Marusik & Koponen, 2013
- Alopecosa moesta (Holmberg, 1876)
- Alopecosa mojonia (Mello-Leitão, 1941)
- Alopecosa moriutii Tanaka, 1985
- Alopecosa murphyorum Zamani, Nadolny, Esyunin & Marusik, 2022
- Alopecosa mutabilis (Kulczyński, 1908)
- Alopecosa nagpag Chen, Song & Kim, 2001
- Alopecosa nemurensis (Strand, 1907)
- Alopecosa nigricans (Simon, 1886)
- Alopecosa nitidus Hu, 2001
- Alopecosa notabilis (Schmidt, 1895)
- Alopecosa nybelini Roewer, 1960
- Alopecosa oahuensis (Keyserling, 1890)
- Alopecosa obscura Schmidt, 1980
- Alopecosa obsoleta (C. L. Koch, 1847)
- Alopecosa ogorodica Trilikauskas & Azarkina, 2014
- Alopecosa orbisaca Peng, Yin, Zhang & Kim, 1997
- Alopecosa orophila (Thorell, 1887)
- Alopecosa orotavensis (Strand, 1916)
- Alopecosa osa Marusik, Hippa & Koponen, 1996
- Alopecosa osellai Lugetti & Tongiorgi, 1969
- Alopecosa ovalis Chen, Song & Gao, 2000
- Alopecosa palmae Schmidt, 1982
- Alopecosa passibilis (O. Pickard-Cambridge, 1885)
- Alopecosa pekari Shafaie, Koponen, Nadolny, Kunt & Mirshamsi, 2022
- Alopecosa pelusiaca (Audouin, 1826)
- Alopecosa pentheri (Nosek, 1905)
- Alopecosa pictilis (Emerton, 1885)
- Alopecosa pinetorum (Thorell, 1856)
- Alopecosa psammophila Buchar, 2001
- Alopecosa pseudocuneata (Schenkel, 1953)
- Alopecosa pulverulenta (Clerck, 1757)
- Alopecosa raddei (Simon, 1889)
- Alopecosa rapa (Karsch, 1881)
- Alopecosa restricta Mello-Leitão, 1940
- Alopecosa robertsi Zamani, Nadolny, Esyunin & Marusik, 2022
- Alopecosa saurica Marusik, 1995
- Alopecosa schmidti (Hahn, 1835)
- Alopecosa sciophila Ponomarev, 2008
- Alopecosa sibirica (Kulczyński, 1908)
- Alopecosa simoni (Thorell, 1872)
- Alopecosa sokhondoensis Logunov & Marusik, 1995
- Alopecosa solitaria (Herman, 1879)
- Alopecosa solivaga (Kulczyński, 1901)
- Alopecosa spasskyi Ponomarev, 2008
- Alopecosa spinata Yu & Song, 1988
- Alopecosa steppica Ponomarev, 2007
- Alopecosa striatipes (C. L. Koch, 1839)
- Alopecosa sublimbata Roewer, 1960
- Alopecosa subrufa (Schenkel, 1963)
- Alopecosa subsolitaria Savelyeva, 1972
- Alopecosa subvalida Guy, 1966
- Alopecosa sulzeri (Pavesi, 1873)
- Alopecosa taeniata (C. L. Koch, 1835)
- Alopecosa taeniopus (Kulczyński, 1895)
- Alopecosa tanakai Omelko & Marusik, 2008
- Alopecosa thaleri Hepner & Paulus, 2007
- Alopecosa trabalis (Clerck, 1757)
- Alopecosa tunetana Roewer, 1960
- Alopecosa upembania Roewer, 1960
- Alopecosa valida (Lucas, 1846)
- Alopecosa virgata (Kishida, 1910)
- Alopecosa volubilis Yoo, Kim & Tanaka, 2004
- Alopecosa wenxianensis Tang, Yin & Yang, 1997
- Alopecosa werneri (Roewer, 1960)
- Alopecosa xiningensis Hu, 2001
- Alopecosa xinjiangensis Hu & Wu, 1989
- Alopecosa xuelin Tang & Zhang, 2004
- Alopecosa yamalensis Esyunin, 1996
- Alopecosa zyuzini Logunov & Marusik, 1995
Systématique et taxinomie
Ce genre a été décrit par Simon en 1885 dans les Lycosidae.
Solicosa[8] a été placé en synonymie par Lugetti et Tongiorgi en 1969[9].
Jollecosa[10] a été placé en synonymie par Dondale et Redner en 1979[11].
Publication originale
- Simon, 1885 : « Études sur les Arachnides recueillis en Tunisie en 1883 et 1884 par MM. A. Letourneux, M. Sédillot et Valéry Mayet, membres de la mission de l'Exploration scientifique de la Tunisie. » Exploration scientifique de la Tunisie, Paris, p. 1-55.
Liens externes
- (en) Référence Animal Diversity Web : Alopecosa (consulté le )
- (en) Référence BioLib : Alopecosa Simon, 1885 (consulté le )
- (en) Référence Catalogue of Life : Alopecosa (consulté le )
- (fr+en) Référence EOL : Alopecosa (consulté le )
- (fr+en) Référence GBIF : Alopecosa Simon, 1885 (consulté le )
- (fr) Référence INPN : Alopecosa Simon, 1885 (consulté le )
- (fr+en) Référence ITIS : Alopecosa Simon, 1885 (consulté le )
- (en) Référence NCBI : Alopecosa (taxons inclus) (consulté le )
- (en) Référence Tree of Life Web Project : Alopecosa (consulté le )
- (en) Référence World Spider Catalog : Alopecosa Simon, 1885 dans la famille Lycosidae +base de données (consulté le )
Notes et références
- WSC, consulté lors d'une mise à jour du lien externe
- Kronestedt, 1986 : « A presumptive pheromone-emitting structure in wolf spiders (Araneae, Lycosidae). » Psyche, Cambridge, vol. 93, p. 127-131.
- Dahlem, Gack & Martens, 1987 : « Balzverhalten von Wolfsspinnen der Gattung Alopecosa (Arachnida: Lycosidae). » Zoologische Beiträge, N. F. vol. 31, p. 151–164.
- Lopez, Juberthie-Jupeau & Kronestedt, 1990 : « Structure et ultrastructure de la glande tibiale chez le mâle d' Alopecosa cuneata (Clerck)( Araneae, Lycosidae). » Revue Arachnologique, vol. 9, no 6, p. 63-77.
- Noirot & Quennedey, 1974 : « Fine structure of Insect epidermal glands. » Annual Review of Entomology, vol. 19, p. 61-80.
- Bristowe, 1929 : « The mating habits of spiders, with special reference to the problems surrounding sex dimorphism. » Proceedings of the Zoological Society of London, vol. 1929, p. 309-358.
- WSC, consulté le version 23.5, 09/08/2022
- Roewer, 1960 : « Araneae Lycosaeformia II (Lycosidae). » Exploration du Parc National de l'Upemba Mission G.F. de Witte, vol. 55, p. 519-1040.
- Lugetti & Tongiorgi, 1969 : « Ricerche sul genere Alopecosa Simon (Araneae-Lycosidae). » Atti della Società Toscana di Scienze Naturali, sér. B, vol. 76, p. 1-100.
- Roewer, 1960 : « Solifugen und Opilioniden - Araneae Orthognathae, Haplogynae und Entelegynae (Contribution à l'étude de la faune d'Afghanistan 23). » Göteborgs Kungliga Vetenskaps och Vitterhets Samhälles Handlingar, sér. 6, vol. B8, no 6, p. 1-53.
- Dondale & Redner, 1979 : « Revision of the wolf spider genus Alopecosa Simon in North America (Araneae: Lycosidae). » The Canadian Entomologist, vol. 111, no 9, p. 1033-1055.
- Portail de l’arachnologie