Alun de potassium
L'alun ordinaire (du grec als, alos, « le sel »), alun de potassium ou encore disulfate d'aluminium et de potassium, est un sel double de formule chimique KAl(SO4)2•12 H2O. C'est un minéral présent naturellement dans diverses régions du monde, telles la Syrie et le Maroc autrefois. Il peut également être synthétisé.
| Alun de potassium | |

| |
 |
|
| Identification | |
|---|---|
| Nom UICPA | sulfate d'aluminium et de potassium dodécahydrate |
| Synonymes |
alun de potassium, alun de potasse, alun |
| No CAS | (anhydre) (dodécahydrate) |
| No ECHA | 100.112.464 |
| PubChem | 24856 |
| SMILES | |
| InChI | |
| Apparence | cristaux blanc |
| Propriétés chimiques | |
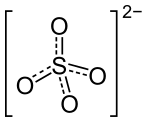
| Formule | KAl(SO4)2·12H2O |
| Masse molaire[1] | 474,388 ± 0,018 g/mol H 5,1 %, Al 5,69 %, K 8,24 %, O 67,45 %, S 13,52 %, |
| Propriétés physiques | |
| T° fusion | 92,5 °C (anhydre)[2] |
| Solubilité | 139 g·L-1 (eau, 20 °C, anhydre)[2]) |
| Masse volumique | 1,75 g·cm-3 (20 °C, anhydre)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Histoire
Au IVe siècle av. J.-C., le philosophe Théophraste, élève d’Aristote, a écrit un ouvrage intitulé Sur le Sel, le Nitre et l’Alun[3]. Strabon rapporte quelques propriétés de l’alun[4]. De même au Ier siècle, le pharmacologue Dioscoride (M.M. V, 106) et l'encyclopédiste Pline (H.N. XXXV, 183-185).
L’alun (στυπτηρια styptêria) était abondamment utilisé par les artisans orfèvres et les alchimistes du IIIe siècle en Égypte gréco-romaine. C’est une des matières premières les plus fréquemment citées dans les papyrus de Leyde et de Stockholm[5]. Pour Robert Halleux, les styptêria, traduit par « alun », sont des sulfates doubles d’aluminium et de métaux alcalins, mais aussi toute espèce de substances dotées de propriétés astringentes. L’Égypte exploitait des gisements d’alun dans la Petite Oasis et ceux-ci ont même fait l’objet d’un monopole d’État à l’époque romaine. Le principal usage de l’alun est de fixer les couleurs. En solution, il peut donner un acide faible.
On attribue à Geber la découverte de l'acide nitrique, obtenu en chauffant du nitrate de potassium (salpêtre[6]) en présence d’alun, de sulfate de cuivre[7] et d'acide sulfurique (le vitriol).
À la fin du XVe siècle, d'importants gisements d'alun sont découverts dans les monts de la Tolfa, une région d'Italie appartenant aux États pontificaux. Compte tenu du rôle joué à cette époque par l'alun dans l'industrie textile, l'exploitation de ces gisements sera une source de revenus pour les États pontificaux.
L'utilisation de l’alun était connue des Romains, Pline en parle dans ses écrits. Buffon, dans ses œuvres complètes, détaille son utilisation dans la teinture des matériaux :
« Ce sel a, en effet, des propriétés utiles, tant pour la médecine que pour les arts et surtout pour la teinture et la peinture. La plupart des pastels ne sont que des terres d’alun, teintes de différentes couleurs. Il sert à la teinture en ce qu’il a la propriété d'ouvrir les pores et d’entamer la surface des laines et des soies qu’on veut teindre et de fixer les couleurs dans leurs substances. Il sert aussi à la préparation des cuirs, à lisser le papier… On frotte d’alun calciné les formes qui servent à imprimer les toiles et papiers pour y faire adhérer les couleurs… »
Propriétés
L'alun est astringent, émétique et hémostatique[8]. Sa température de fusion est de 92,5 °C[9].
Sa solubilité est de l'ordre de 114 g/l à 20 °C[10].
Utilisations
.jpg.webp)
Cuir et textile
L'alun favorisant la coagulation des protéines (propriété hémostatique), il fut utilisé pour traiter le cuir[11] par les hongroyeurs, qui l'utilisaient mélangé au chlorure de sodium[12].
Cosmétique
La pierre d'alun (potassium alum) régule la sudation sans boucher les pores de la peau (propriété astringente)[11]. Elle combat les bactéries qui causent les mauvaises odeurs (propriété bactéricide[réf. nécessaire]). Elle peut être utilisée comme après-rasage afin de stopper les saignements dus aux micro-coupures (propriété hémostatique). La pierre d'alun s'utilise humidifiée à l'eau froide en la passant lentement sur la peau. Ce type de pierre se trouve en pharmacies et parapharmacies. Le côté « naturel » du produit contribue à un regain d'intérêt[11]. Ceci est fortement remis en cause depuis quelques années (voir ci dessous : "alimentation" et "conséquences sur la santé", Alzheimer et autres problèmes), et a conduit les fabricants à communiquer sur les termes "Kalunite", "pure", et "sans hydroxides d'aluminium", sans que ne soient apportés d'éléments scientifiques ou fiches techniques.
Alimentation
Dans les années 1800, en France, en Allemagne et en Angleterre certains boulangers introduisaient de l'alun de potassium dans la farine comme substitut du bitartrate de potassium dans la levure de boulanger[13]. Des morts par accident ou par empoisonnement volontaire liées à l'alun ont été rapportées à cette époque. Seule une partie de l'alun utilisé dans la manufacture du pain est décomposée par les phosphates présents dans la farine, son utilisation dans les produits alimentaires fut interdite et punie d'une peine d'emprisonnement à la fin des années 1870. Des expériences menées par Devergie et Orfila sur des animaux vivants fournirent la preuve qu'il s'agit d'un poison dont l'action corrosive attaque les membranes muqueuses. Les symptômes observés sont le vomissement, la constipation, une asthénie extrême et une perte d'appétit[13]. D'autres expériences menées sur des chiens en bonne santé par Henry A. Mott conduisirent au même constat, l'autopsie de ces derniers décela la présence d'une grande quantité d'aluminium dans le cœur, le foie, les reins et le sang[13].
Utilisé de manière traditionnelle dans la fabrication du « sirop de miel au sucre »[14],[15] (sirop de glucose, appelé localement « faux miel ») notamment au Maghreb pour recouvrir ou enrober les gâteaux secs (makrout, baklava, kalb el-louz, zalabia, etc.). Son innocuité ne semble pas remise en cause, et son usage se poursuit de nos jours, au moins dans les familles.
Autres
Il est d'autre part utilisé comme coagulant dans le traitement de l'eau potable[16].
Il a aussi été utilisé comme adjuvant immunologique[17].
Il est aussi utilisé dans la fabrication de la plasticine. Il fait partie des ingrédients de certaines recettes de pâte à modeler maison non toxiques. Le paragraphe "alimentation" et les études qu'il cite devrait amener à se poser des questions sur cette non toxicité.
Sous forme de solution, il est utilisé pour faire rougir les hortensias, comme tout autre acide.
Une solution d'alun peut aussi être utilisée pour dissoudre une vis ou un taraud en acier cassé dans de l'aluminium. L'alun n'attaque pas l'aluminium, mais réagit avec le fer, bien que la réaction soit lente. Dissoudre une vis cassée peut prendre plusieurs jours voire semaines, mais la réaction peut être accélérée par la chaleur.
Synthèse
Il est possible de l'obtenir en mélangeant des solutions concentrées de sulfates de potassium K2SO4 et de sulfate d'aluminium Al2(SO4)3 que l'on laisse s'évaporer :
Conséquences sur la santé
Au contact de l'eau, la pierre d'alun libère notamment de l'hydroxyde d'aluminium censé être inerte mais dont l'innocuité n'a pas été formellement démontrée[18]. Aucun renseignement toxicologique officiel ni restriction d'utilisation ne concernent actuellement l'alun naturel. L'hydroxyde d'aluminium est pourtant autorisé en cosmétologie naturelle et biologique à la différence du chlorhydrate d'aluminium[19] ou du chlorure d'aluminium fabriqués industriellement et dont l'innocuité a été remise en cause fin 2011 par l'Agence française de sécurité sanitaire des produits de santé[20],[21] en tant que composants de déodorants ou d’anti-transpirants. Certains sites revendeurs de pierres d'alun (taper Kalunite sur un moteur de recherche) mettent toutefois l'absence d'hydroxyde d'aluminium (?) en avant, des études danoises mais aussi anglaises [22] ayant mis en cause l'aluminium dans la maladie d'Alzheimer entre autres problèmes de santé. La majorité des fabricants industriels de déodorant communiquent sur l'absence de sels d'aluminium dans leurs formulations[19].
L'argument d'innocuité à cause de la très forte solidité des liaisons est remise en cause par certaines études citées ci-dessus (paragraphe alimentation). L'étude du début du paragraphe[18] indique clairement la possibilité de libération d'hydroxyde d'aluminium dans l'eau, qui lui est réputé inerte. Le manque de définition des produits ainsi que des mécanismes en jeu lors de l'application sur la peau ou lors de l'ingestion ne permettent pas de se faire une idée juste, dans l'attente d'études plus poussées. Ce problème est similaire à l'utilisation de l'argile en soins externes et interne. Dans ce cas, des études sur des animaux n'ont pas montré de concentration de l'aluminium dans les organes (voir l'article argile). (voir aussi Controverse sur l'innocuité des déodorants).
Fabrication artisanale
Il existe dans le monde de moins en moins de fabricants[réf. nécessaire] travaillant la pierre d'alun de façon artisanale selon une méthode de taille et de polissage à la main.
La méthode artisanale nécessite un travail à partir du vrai cristal d'alun non reconstitué. Les pierres d'alun fabriquées selon cette méthode sont de plus en plus rares.[réf. nécessaire]
On retrouve aujourd'hui de nombreuses pierres moulées reconnaissables à leur aspect opaque et poudreux. Le véritable cristal d'alun est, quant à lui, reconnaissable à sa légère transparence (absence d'hydroxyde d'aluminium selon les sites de vente de cosmétique) et la non homogénéité du produit.
Produit de synthèse industrielle
Un produit de synthèse industrielle, l’Ammonium alun ou Ammonium alum, fabriqué à partir de sulfate d'ammonium, sous-produit de l'industrie du caprolactame, d'acide sulfurique et d'alumine est vendu comme déodorant naturel. Pourtant de nombreux marchands de produits naturels affirment que les produits de synthèse seraient intrinsèquement nocifs, n'étant pas d'origine naturelle, notamment par la présumée migration des molécules d'aluminium sous la peau (voir Controverse sur l'innocuité des déodorants).
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Aluminium potassium sulfate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 septembre 2019 (JavaScript nécessaire)
- Diogène Laërce, Vies, doctrines et sentences des philosophes illustres [détail des éditions] (lire en ligne) (Livre V, 42 - 50)
- Strabon, Géographie [détail des éditions] [lire en ligne] (Livre XXXIII, 30)
- Les alchimistes grecs. Papyrus de Leyde, Papyrus de Stockholm, Recettes, texte établi et traduit par Robert Halleux, sous la direction de Henri-Dominique Saffrey, Les Belles Lettres, coll. « Universités de France », 1981 (réed. 2002) (ISBN 9782251000039).
- KNO3
- CuSO4⋅5H2O
- « Alun de potassium - Identification de la substance », sur biam2.org (consulté le ).
- Mathey Jérome, « Synthèse des cristaux d’Alun de Potassium », .
- « Alun de potassium », sur cristallographie.free.fr (consulté le ).
- Marie-Claude Martini, BTS esthétique-cosmétique, vol. 2, Cosmétologie, 2008, p. 49
- Frédéric Georges Cuvier, Dictionnaire des sciences naturelles, vol. 51, éd. F. G. Levrault, 1827, p. 293
- The effects of alumina salts on the gastric juice in the process of digestion by Henry A. MOTT, Jr, Ph.D. (Journal of American Chemical Society 1897, vol 2, p13-23)
- « Sirop de Miel au sucre pour gâteaux orientaux | La cuisine de Djouza », La cuisine de Djouza, (lire en ligne, consulté le )
- Bernard LAURANCE, « Zlabias », La Cuisine de Bernard, 2010-2016 (lire en ligne, consulté le )
- Fiche de l'alun liquide
- [PDF] « Exemple d'utilisation de l'alun pour dé-sensibiliser l'allergie aux graminée. », sur cytos.com (consulté le )
- Pierre d'alun: la fausse bonne idée en matière de déodorant naturel?
- [PDF] « Les sels d'aluminium des déodorants sont-ils dangereux ? », 25 avril 2009.
- [PDF] « Évaluation du risque lié à l’utilisation de l’aluminium dans les produits cosmétiques (oct 2011) ».
- [PDF] « CR de la Commission de cosmétologie (28/01/2011), portant en p. 13 sur l'évaluation du risque lié à l'aluminium dans le domaine ».
- « Trop d’aluminium favoriserait la maladie d’Alzheimer », Medisite, (lire en ligne, consulté le ).
Bibliographie
- Paul Pascal, « Nouveau traité de chimie minérale », Masson Éditeurs, 1961.
- Jean Delumeau, L'Alun de Rome, Paris, SEVPEN, 1962.
- Jean Perrotey, « aluns », Encyclopædia Universalis , 2004
Voir aussi
Article connexe
Lien externe
- Aluminium, notre poison quotidien de Valérie Rouvière, 2011 [présentation en ligne]
- Portail de la chimie
- Portail des minéraux et roches