Anémie infectieuse équine
L'anémie infectieuse des équidés (AIE) est une maladie infectieuse et contagieuse des équidés, due à un virus de la famille des Retroviridae. L'infection demeure souvent latente, mais peut s'exprimer cliniquement chez certains sujets. La maladie se traduit par une évolution le plus souvent chronique, semée d'épisodes aigus au cours desquels on constate de la fièvre, de l'abattement, de l'anémie, des œdèmes et de l'amaigrissement. Elle constitue une maladie virale majeure pour les Equidés, en raison de la pérennité de l'infection chez les sujets atteints et des pertes économiques qu'elle peut occasionner sur des sujets et des effectifs de grande valeur (chevaux de course).
Pour les articles homonymes, voir AIE.

Il n’existe pas de traitement spécifique de l’AIE.
Chez les chevaux infectés, le virus subit une dérive de ses antigènes externes au cours du temps, ce qui rend très difficile l'obtention de vaccins capables de protéger contre toutes les souches de ce virus. Étant donné l'existence d'un phénomène semblable chez le virus de l'immunodéficience humaine, le virus de l'AIE peut servir de modèle animal pour la mise au point de vaccins contre la maladie humaine.
L'anémie infectieuse des équidés est présente actuellement dans la plupart des pays, avec une fréquence très variable. En Europe, elle est rare dans toute la partie occidentale. En revanche, elle est fréquente en Roumanie. Des mouvements d’équidés en provenance de ce pays ont été à l’origine de l’émergence de foyers dans divers pays européens, dont la France. La prévalence de l'infection en France est actuellement très faible, mais des foyers sont sporadiquement détectés.
En France, antérieurement inscrite dans la liste des maladies réputées contagieuses, elle est actuellement classée comme un danger sanitaire de 1re catégorie.
Le diagnostic est essentiellement sérologique : le test de Coggins (immunodiffusion en gélose) est la seule méthode de laboratoire reconnue officiellement au niveau international.
Historique
L’AIE a été observée et décrite pour la première fois en France, dans la Haute-Marne, par Ligné en 1843[1]. Les travaux de Carré et Vallée au Laboratoire de recherches de l’’École vétérinaire d’Alfort ont conduit au début du XXe siècle (1906-1907) à deux publications démontrant notamment la transmissibilité de la maladie et la nature ultra filtrable de son agent[2],[3]. Il a fallu attendre plusieurs décennies pour que Coggins et Norcross (1970) mettent au point le premier test sérologique fiable de diagnostic et dépistage de l’AIE par immunodiffusion en gélose, outil qui a permis à la fois des études épidémiologiques sur cette maladie et la mise en œuvre de mesures de lutte efficaces[4].
Quelques années plus tard, plusieurs réunions internationales ont permis l’échange d’informations sur les résultats d’enquêtes épidémiologiques et de programmes de lutte contre l’AIE entre les personnes travaillant dans ce domaine : Lyon (1977), Moscou (1979)), Caracas (1980), Sao Paulo (1982)), Harbin (1983).

 Sao Paulo, 1982 ; de gauche à droite : B. Toma, C. Lora, O. M. de Carvalho Jr, L. Coggins et H. Nakajima.
Sao Paulo, 1982 ; de gauche à droite : B. Toma, C. Lora, O. M. de Carvalho Jr, L. Coggins et H. Nakajima.
Au cours des dernières décennies, les recherches ont porté surtout sur la biologie moléculaire du virus de l’AIE.
Espèces affectées
Seuls les équidés sont sensibles : cheval, âne, mulet et bardot. L’AIE n’est pas transmissible à l'homme ou à d'autres espèces animales que les équidés. Des essais récents ont montré la réceptivité au virus AIE de souris transgéniques pour le récepteur 1 du lentivirus équin et la cycline équine T1[5].
Répartition géographique et importance
Répartition géographique
L'anémie infectieuse des équidés existe actuellement dans la plupart des pays, avec une fréquence très variable. En Europe, elle est rare dans toute la partie occidentale. En revanche, elle est fréquente en Roumanie : entre les années 2000 et 2004, ce pays a connu 9 953 foyers d’AIE et déclaré 30 132 équidés séropositifs ; plus de 2 800 cas y étaient encore recensés en 2010 et plus de 400 cas en 2014. Au cours de ces dernières années, des mouvements d’équidés en provenance de ce pays ont été à l’origine de l’émergence de foyers dans divers pays européens, dont la France.
La prévalence de l'infection en France est actuellement très faible, mais des foyers sont sporadiquement détectés[6] : 2001 (2 cas), 2005 (4 cas), 2007 (10 cas), 2009 (une quinzaine de cas dans le Var sur des chevaux de selle, 1 cas en Dordogne), 2010 (10 chevaux reconnus infectés dans 7 foyers localisés en Dordogne, Lot-et-Garonne, Gironde, Ille-et-Vilaine, Nord et Sarthe, 2012 (8 cas répartis dans 2 foyers localisés dans le Gard et le Vaucluse) et en 2014 (2 cas isolés dans le Gard).
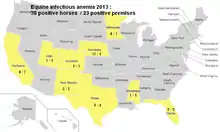
Elle sévit également en Amérique, du nord, centrale et du sud ainsi qu’en Chine. Sa présence en Afrique, au Moyen-Orient et en Extrême-Orient est peu fréquemment déclarée, mais le virus y circule[7]. Aux États-Unis, sa prévalence autrefois importante (534 tests positifs en 2001) a considérablement diminué du fait des contrôles systématiques réalisés[8].
Importance économique
L’importance économique de l’AIE est liée à sa gravité médicale et à la valeur éventuellement très élevée de certains chevaux affectés (chevaux de sport et de course). En France, antérieurement inscrite dans la liste des maladies réputées contagieuses, elle est actuellement classée comme un danger sanitaire de 1re catégorie.
Elle figure aussi parmi les maladies animales à déclarer à l’Organisation mondiale de la santé animale (OIE). Dans le Code sanitaire de l’OIE pour les animaux terrestres, l’AIE est traitée au chapitre 12.5[9].
L’OIE a désigné trois laboratoires de référence pour l’AIE ; actuellement, un à Harbin (Chine) (Dr X. Wang), où s’est tenu en 1983 un Symposium international sur l’AIE, un à Ibaraki (Japon) (Dr M. Yamakawa) et un à Ames (États-Unis) (Dr E. Ostlund[10]).
Étiologie
Le virus de l'AIE est un ribovirus enveloppé, codant une transcriptase réverse, classé au sein de la famille des Retroviridae, dans la sous-famille des Lentivirinae (qui rassemble également les virus du Visna-maëdi du mouton, de l'arthrite-encéphalite caprine, et les virus responsables de l'immunodéficience humaine, simienne, féline et bovine). La transcriptase réverse permet la synthèse d’ADN à partir de l’ARN viral puis son intégration dans le noyau de cellules, entrainant ainsi une infection persistante.
La multiplication du virus de l’AIE est possible en culture de macrophages de chevaux infectés ou en infectant des macrophages de chevaux sains. Certaines lignées (par exemple la lignée Equine Dermis ou E.D.) peuvent être chroniquement infectées et utilisables pour la production d'antigène viral, notamment en vue de la préparation de réactifs de diagnostic.
Le pouvoir pathogène du virus de l’AIE est variable selon la souche : certaines souches sont très virulentes (incubation courte, maladie mortelle) comme la souche Wyoming ; d’autres sont peu virulentes (incubation longue, maladie bénigne). In vivo, le virus se multiplie dans les macrophages.
Le pouvoir antigène du virus de l’AIE est caractérisé par l'existence d'antigènes internes (p15, p26) et d’antigènes externes (gp90 et gp45).
Les antigènes internes sont communs à toutes les souches virales et révélables par le test de fixation du complément, immunofluorescence et surtout par immunodiffusion en gélose, technique utilisée pour le diagnostic sérologique (test de Coggins).
Les antigènes externes, spécifiques de souche, sont présents sur l'enveloppe virale et induisent la formation d’anticorps neutralisants. In vivo, ces glycoprotéines subissent, sous la pression des anticorps neutralisants produits par l’hôte, une dérive antigénique entraînant l'apparition et la sélection de variants antigéniques auxquels l'organisme s'adapte en produisant, avec un certain décalage, des anticorps neutralisant la nouvelle spécificité. Cette dérive antigénique semble rendre très difficile l’obtention de vaccins capables d’entrainer une immunité humorale permettant de protéger contre les variants successifs.
L'immunité constatée in vivo, dans les conditions naturelles, est très variable selon les circonstances, depuis l’instauration d’une infection inapparente, témoignant d’une bonne résistance de l’hôte, jusqu’à une évolution fatale en quelques semaines, révélatrice d’une absence de résistance.
Clinique
Incubation
Elle dure de quelques jours à plusieurs semaines (10 à 15 jours en moyenne).
Symptômes
L’AIE peut se présenter sous plusieurs formes cliniques[11] : suraiguë, aiguë, subaiguë, chronique, latente
Forme suraiguë
Elle est rare et atteint surtout les jeunes. Le début est brutal avec de la fièvre (41 °C), un abattement intense, une anorexie et une atteinte intestinale. La mort survient en 1 à 3 jours.
Forme aiguë

- La phase de début est marquée par des symptômes généraux (fièvre à 40-41 °C, accélération du rythme cardiaque et respiratoire, anorexie) et des symptômes locaux oculaires (larmoiement, muqueuse conjonctivale jaunâtre sur fond rouge, avec parfois des pétéchies).
- La phase d'état comporte une aggravation des symptômes généraux (abattement plus marqué, etc.) et oculaires (pétéchies plus nombreuses), et la formation de pétéchies sur la muqueuse buccale et la face inférieure de la langue. Certains chevaux présentent en outre, isolés ou associés, des symptômes d'atteinte hépato-rénale (polyurie, albuminurie), une diarrhée fétide, striée de sang, avec de légères coliques, des symptômes de myocardite et des œdèmes déclives (photo).
- La phase terminale est associée à une aggravation des symptômes précédents (œdèmes déclives nets, etc.), une émaciation musculaire importante et la mort survient après une évolution de 8 à 12 jours.

Forme subaiguë
On constate les mêmes symptômes que dans la phase aiguë, mais atténués et étalés dans le temps, survenant sous forme de crises durant quelques jours, entrecoupées de phases de rémission (plus ou moins longues) simulant une guérison. Au cours des crises, la température oscille entre 38 et 39 °C, les œdèmes déclives sont nets et l'anémie marquée. L'animal s'amaigrit. Un avortement peut survenir.
L'évolution est longue, pouvant aboutir à la mort (accès aigu) ou à la forme chronique.
Forme chronique
Elle succède aux formes précédentes ou peut survenir d'emblée. Elle se traduit par une évolution longue et des symptômes frustes : amaigrissement, baisse de forme, légère hyperthermie, tachycardie d'effort. Les muqueuses sont subictériques et l'anémie est plus ou moins accusée.
Des épisodes aigus peuvent apparaitre. La mort survient au bout de plusieurs mois ou années.
Forme latente
Après une ou plusieurs crises, l’animal semble être guéri ; mais il demeure porteur du virus.
Lésions
Modifications hématologiques
Différentes modifications hématologiques peuvent être notées : de l’anémie, la présence de sidéroleucocytes (macrophages contenant de l’hémosidérine, catabolite de l’hémoglobine) avec un nombre supérieur à 14 pour 100 000 leucocytes, parfois une leucopénie, une diminution du rapport albumine/globuline, une augmentation de la vitesse de sédimentation (pendant les crises).
Macroscopiques
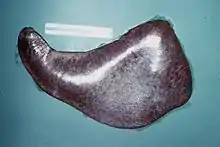
Elles sont variables selon la forme évolutive.
- Lésions de septicémie (congestion généralisée, hémorragies, hypertrophie ganglionnaire et une congestion des nœuds lymphatiques) dans les formes suraiguës.
- Dans les formes aiguës, outre l'émaciation musculaire, les œdèmes sous-cutanés en partie déclive, l'hypertrophie des nœuds lymphatiques, des lésions de néphrite (reins pâles et hypertrophiés), on note trois lésions essentielles, mais inconstantes : une myocardite (myocarde couleur feuille morte, tigré à la coupe et friable, avec pétéchies), une hépatomégalie (foie couleur feuille morte, friable, pesant parfois 10 à 20 kg) et une splénomégalie (rate ferme, bosselée, pesant parfois 4 à 8 kg) (photo). Présence d'hémorragies intestinales.
- Dans les formes subaiguës et chroniques : idem mais la cachexie, l’anémie, et les œdèmes sont plus marqués.
Microscopiques
Elles consistent en une infiltration lymphocytaire et histiocytaire du foie, de la rate et des ganglions, une hémosidérose dans le foie, la rate, les ganglions et les poumons.
Épidémiologie
Épidémiologie analytique
- Les sources de virus sont représentées par les équidés malades (qui constituent le risque maximal de transmission) et les porteurs (qui jouent le rôle de réservoir).
La virémie commence 2 à 7 jours avant les premiers symptômes, atteint son maximum pendant la crise, puis diminue pour remonter à la crise suivante, entraînant la virulence de tous les organes (en particulier le foie, la rate, le rein, les poumons et les ganglions) et des sécrétions et excrétions (colostrum et lait en particulier). Chez les équidés infectés mais ne présentant pas de symptôme (entre les crises, ou chez les porteurs sains), la virémie est d'intensité variable, ainsi que le degré de risque de transmission.
- La résistance du virus est assez élevée dans le milieu extérieur (plusieurs semaines à plusieurs mois) ou dans les produits biologiques (le virus semble néanmoins inactivé par les techniques de purification des sérums thérapeutiques ou d'extraction des gammaglobulines).
- La transmission est essentiellement indirecte, à partir du sang, par piqûre, soit par des arthropodes piqueurs (des genres Tabanus, Stomoxys, Chrysops, etc.) intervenant comme vecteurs mécaniques, soit par des injections ou des prises de sang en série (transmission iatrogène) effectuées avec le même matériel. La transmission indirecte peut également se faire par les instruments de chirurgie, les objets de pansage, les mors, les harnais...
La transmission congénitale (infection du poulain in utero) est possible (de l’ordre de 10 p.100 chez les femelles infectées de façon latente). Les autres modes de transmission (lait, coït, alimentation) semblent exceptionnels.
- Différents facteurs, intrinsèques ou extrinsèques, peuvent moduler la sensibilité des sujets réceptifs : l'espèce (le cheval est plus sensible que l'âne et le mulet), l'âge (les jeunes ont une sensibilité plus importante), l'individu (pour une même souche de virus, la gravité est variable selon l'animal) ; certains facteurs favorisants (la fatigue, des corticoïdes) peuvent provoquer une crise chez les chevaux infectés latents.
Épidémiologie synthétique
L'AIE est entretenue à l'état enzootique et disséminée par les chevaux infectés de façon inapparente (danger permanent). Sa transmission est facilitée dans les régions et à la période où les arthropodes sont abondants (zones humides, été, etc.) et dans les effectifs où sont pratiquées des injections nombreuses sans précaution.
L'absence de transmission directe, la longueur de l'incubation, l'évolution variable d'un sujet à l'autre (fréquence des infectés de façon inapparente) font que la maladie prend souvent une forme sporadique dans les effectifs atteints.
Diagnostic
Diagnostic clinique
Il est difficile en raison du polymorphisme clinique de la maladie. L’AIE est à évoquer dans les situations suivantes (éléments de suspicion) :
- Cheval atteint d'une maladie aiguë avec fièvre, abattement, tachycardie, anorexie, dyspnée d'effort, œdèmes ;
- Cheval atteint d'une maladie chronique associant à une baisse de forme, amaigrissement, œdèmes, hyperthermie modérée, anémie, et évoluant par crises ;
- Cheval avec syndrome anémique ;
- A l'autopsie, association d'une splénomégalie, d'une hépatomégalie et d'une myocardite.
Le diagnostic différentiel est à faire avec des maladies septicémiques, l'artérite à virus, la leptospirose, la peste équine... dans les formes aiguës ; avec la tuberculose, la brucellose, la piroplasmose chronique, la dourine, une néphrite, une affection tumorale... dans les formes chroniques.
Recours au laboratoire
Le recours au laboratoire est indispensable en cas de suspicion clinique et pour détecter les porteurs sains.
Le diagnostic virologique est possible mais non réalisé en routine. Le diagnostic hématologique (numération globulaire, recherche des sidéroleucocytes (macrophages contenant de l’hémosidérine, catabolite de l’hémoglobine : nombre supérieur à 14 pour 100 000 leucocytes)... n'est pas spécifique et ne peut être qu'un élément de présomption. Il en est de même pour le diagnostic histopathologique.
Diagnostic expérimental et dépistage
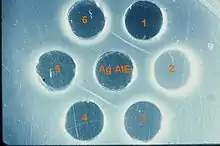
Ils sont essentiellement sérologiques : le test de Coggins (immunodiffusion en gélose) est la seule méthode reconnue officiellement au niveau international (Manuel de l’OIE[12]) et en France. Un sérum étalon international, contenant la quantité minimale d’anticorps devant être détectée par les laboratoires, a été produit par le laboratoire de référence OIE situé à l'Alfort en 1977 (Pr Toma) et est disponible auprès de laboratoires de référence actuels de l’OIE. Des tests ELISA (détection des antigènes de surface, gp90 et gp45) sont utilisés dans certains pays ; toutefois, il est recommandé par l’OIE de soumettre au test de Coggins les sérums ayant fourni une réponse positive en ELISA, en raison de l’existence de rares réponses non spécifiques fournies par ce test[12].
Le prélèvement est habituellement constitué par du sang en tube sec (sans anticoagulant).
Des commémoratifs comme l’âge de l'animal, la date d'apparition des premiers symptômes et la date de l’éventuelle dernière occasion de contamination sont indispensables pour l’interprétation du résultat du test.
En France, seuls certains laboratoires sont habilités à réaliser le test de Coggins. Le laboratoire national de référence est actuellement le laboratoire de pathologie équine de l'ANSES à Dozulé. Plusieurs laboratoires départementaux d’analyses agréés peuvent également réaliser le test de Coggins : ce sont ceux des départements suivants : Manche, Loire-Atlantique, Mayenne, Orne, Pyrénées-Atlantiques, Sarthe et Seine-Maritime.
Technique utilisée : le test de Coggins utilise un antigène (p26) préparé à partir d'une culture cellulaire (ED) et un sérum positif. Ce test est parfaitement spécifique et sensible. Les résultats sont disponibles après 24 à 48 heures.
L'interprétation du résultat doit tenir compte de la cinétique des anticorps précipitants détectés par le test. Ils apparaissent :
- en moyenne, entre 15 et 30 jours après l'infection et, au plus tard, 60 jours après l’infection ;
- au plus tard, 10 jours après le début de la fièvre chez l'animal malade.
- Chez un animal adulte infecté, ils persistent toute la vie.
- Chez un poulain sain, né de mère infectée, les anticorps d’origine colostrale sont présents pendant les premiers mois et disparaissent au plus tard vers le 6e mois.
Un résultat positif au test de Coggins obtenu avec le sérum d’un équidé adulte permet de conclure à l’infection de cet animal par le virus de l’AIE. Un résultat négatif sur un animal adulte ou un résultat quel qu’il soit sur un poulain né de mère infectée est à interpréter en fonction de la situation et des commémoratifs disponibles.
Traitement
Il n’existe pas de traitement spécifique de l’AIE.
Prophylaxie
La prophylaxie est essentiellement sanitaire. En effet, différents essais de création de vaccins contre l’AIE ont été réalisés ou sont en cours mais, à part en Chine, aucun vaccin n’a été utilisé en pratique. Les résultats de l’emploi du vaccin chinois de 1975 à 1990 sont difficiles à connaitre. Depuis cette date, la vaccination y a été arrêtée afin d’éviter l’interférence des anticorps post-vaccinaux avec le dépistage sérologique de l’AIE.
En prenant le virus AIE comme modèle du HIV, des essais de vaccination avec des immunogènes « consensuels » d’enveloppe (gp90) se sont révélés prometteurs[13].
- Milieu indemne d’AIE :
La règle de base de la prophylaxie sanitaire défensive est de n’introduire dans un effectif indemne que des équidés ayant fourni un résultat négatif à un test de Coggins et provenant d'un effectif régulièrement contrôlé (dans le cas contraire, il conviendrait de refaire un nouveau contrôle à l'issue d'une période de quarantaine de 45 à 60 jours).
Par ailleurs, il convient d’appliquer en outre des mesures permanentes d'hygiène (matériel à injection unique, lutte contre les arthropodes...).
- Milieu infecté d’AIE :
L'assainissement d'un effectif infecté d’AIE exige l'isolement strict des malades jusqu'à leur élimination (abattage ou conduite dans un lazaret), le dépistage des infectés latents parmi les autres sujets de l'effectif et leur isolement strict jusqu'à leur élimination, la désinfection des locaux et matériels, la lutte contre les arthropodes, l'utilisation de seringues à usage unique...
Des contrôles sérologiques doivent être réalisés tous les 30 à 45 jours (avec isolement et élimination des animaux à résultat positif) jusqu'à l'assainissement total confirmé par deux contrôles négatifs sur l'ensemble de l'effectif à un intervalle de 45 à 60 jours.
Réglementation sanitaire
En France, l’AIE était inscrite dans la nomenclature des maladies réputées contagieuses ; elle est actuellement classée comme un danger sanitaire de 1re catégorie[14],[15].
Mesures de police sanitaire
Elles sont précisées par les arrêtés du [16],[17] :
- Lorsque l'existence de l'AIE est confirmée (test de Coggins), l'établissement hébergeant l'animal est mis en interdit par arrêté préfectoral portant déclaration d'infection (APDI). Les chevaux atteints sont isolés, marqués (marque AI au feu à l'épaule gauche) et abattus dans les quinze jours. Tous les chevaux de l'établissement subissent un contrôle sérologique et les animaux à résultat positif sont traités comme précédemment. Les locaux sont désinfectés et désinsectisés. Des contrôles sérologiques ont lieu tous les mois jusqu'à obtention de résultats négatifs.
- L'arrêté préfectoral est levé lorsque deux contrôles pratiqués à 3 mois d'intervalle s'avèrent négatifs sur tous les équidés, tous les équidés infectés ayant été éliminés et les locaux désinfectés.
- L'Etat participe financièrement à ces mesures (visites, examens de laboratoire, indemnités d'abattage limitées à 3 000 € maximum par équidé...).
Vice rédhibitoire
L'AIE révélée par un test de Coggins positif est un vice rédhibitoire depuis 1990 (Décret du et arrêté du ). Le délai de rédhibition est fixé à 30 jours.
Monte publique et monte artificielle
- Il n’existe plus d’exigence sanitaire réglementaire nationale pour la monte naturelle des équidés, mais chaque association nationale de race a la capacité d’imposer des mesures spécifiques (définies, pour chaque race, par le règlement de Stud-book), dont certaines peuvent concerner l’AIE.
- La réglementation pour la monte artificielle prévoit des conditions sanitaires d’admission des étalons dans les centres de collecte agréés pour le marché national ou communautaire, dont certaines concernent l’AIE (AM du ).
Échanges internationaux
- Échanges d’équidés intra Union européenne : il n’y a pas de dépistage obligatoire dans le cadre des échanges intra-communautaires, à l’exception des équidés en provenance de Roumanie[18].
- Importation d’équidés extra Union européenne : exclusivement équidés à résultat négatif au test de Coggins.
Notes et références
- Ligné. Mémoire et observations sur une maladie de sang, connue sous le nom d’anhémie, hydrohémie, cachexie aqueuse du cheval. Rec. Méd. Vét., 1843, 20, 30-44
- Carré H. et Vallée H. Recherches cliniques et expérimentales sur l’anémie pernicieuse du cheval (typho-anémie infectieuse). Rev. Gén. Méd. Vét., 1906, 8, 593-608
- Carré H. et Vallée H. Recherches cliniques et expérimentales sur l’anémie pernicieuse du cheval (typho-anémie infectieuse) (suite et fin). Rev. Gén. Méd. Vét., 1907, 9, 113-124
- Coggins L. et Norcross N. L. Immunodiffusion reaction in equine infectious anemia. Cornell Vet., 1970, 60, 330-335
- Du C., Ma J., Liu Q. et al. Mice transgenic for equine cyclin T1 and ELR1 are susceptible to equine infectious anemia virus infection. Retrovirology, 2015, 12:36. DOI 10.1186/s12977-015-0163-7
- Hans A., Ponçon N. et Zientara S. Situation épidémiologique de l’anémie infectieuse des équidés en France et en Europe de 1994 à 2011. Bull. Acad. Vét. France, 2012, 165 (1), 27-34
- Toma B. et Pearson J. E. Equine infectious anaemia in Infectious and Parasitic Diseases of Livestock, Lefèvre P.-C. et al., 2010, Lavoisier éd. Paris, 1, 780 p
- USDA : 2013 Equine Infectious Anemia Cases in the United States
- OIE : Anémie infectieuse des équidés
- OIE : Experts et laboratoires de référence
- Goret P., Michel C. et Toma B. L’anémie infectieuse des Equidés. L’Expansion Ed., Paris, 1968, 144 p
- World Assembly of Delegates of the OIE in May 2013 : Equine infectious anemia
- Craigo J. K., Ezzelarab C., Cook S. J. et al. Protective Efficacy of Centralized and Polyvalent Envelope Immunogens in an Attenuated Equine Lentivirus Vaccine. PLoS Pathog 11(1): e1004610.doi:10.1371/journal.ppat.1004610
- Légifrance : Arrêté du 29 juillet 2013 relatif à la définition des dangers sanitaires de première et deuxième catégorie pour les espèces animales
- Légifrance : Décret n° 2012-845 du 30 juin 2012 relatif aux dispositions générales organisant la prévention, la surveillance et la lutte contre les dangers sanitaires de première et deuxième catégorie
- Légifrance : Arrêté du 23 septembre 1992 fixant les mesures de police sanitaire relatives à l'anémie infectieuse des équidés
- Légifrance : Arrêté du 23 septembre 1992 fixant les mesures financières relatives à la police sanitaire de l'anémie infectieuse des équidés
- Ministère de l'Agriculture, note de service DGAL/SDSPA/SDSSA/MCSI/N2007-8142 12 juin 2007
Voir aussi
Bibliographie
- Goret P., Michel C. et Toma B. L’anémie infectieuse des Equidés. L’Expansion Ed., Paris, 1968, 144 p.
- Toma B. et Pearson J. E. Equine infectious anaemia in Infectious and Parasitic Diseases of Livestock, Lefèvre P.-C. et al., 2010, Lavoisier éd. Paris, 1, 780 p.
Liens externes
- World Assembly of Delegates of the OIE in May 2013 : Equine infectious anemia
- Légifrance : Décret n° 2012-845 du 30 juin 2012 relatif aux dispositions générales organisant la prévention, la surveillance et la lutte contre les dangers sanitaires de première et deuxième catégorie
- Truffert M. : Bilan épidémiologique et réglementaire de l'anémie infectieuse des équidés en France, perspectives d'évolution, thèse doctorat vétérinaire, École nationale vétérinaire d'Alfort, 2011.
- Portail équestre
- Portail de la virologie
- Portail des maladies infectieuses
- Portail de la médecine vétérinaire

