Anti-aromaticité
Un composé anti-aromatique est un composé cyclique contenant une alternance de liaisons doubles et simples, où l'énergie des électrons pi du composé anti-aromatique est supérieure à celle du composé équivalent en chaine ouverte. Ainsi, les composés anti-aromatiques sont en général instables et particulièrement réactifs ; souvent, les composés anti-aromatiques se distordent même en dehors du plan, afin de résoudre cette instabilité. Les composés anti-aromatiques ne respectent donc pas en général la règle de Hückel sur l'aromaticité.
Définition théorique
Les critères IUPAC pour l'anti-aromaticité sont les suivants[1]:
- la molécules doit avoir 4n électrons π, où n est un entier naturel non nul;
- la molécule doit être cyclique;
- la molécule doit avoir un système d'électrons π conjugué;
- la molécule doit être plane ou quasiment plane.
Composés anti-aromatiques
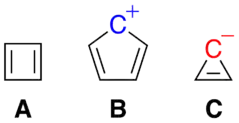
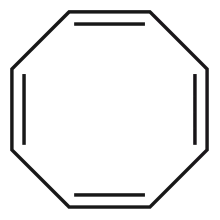
On compte par exemple parmi les composés anti-aromatiques le cyclobutadiène (A), le cation cyclopentadiényle (B) et l'anion cyclopropényle (C). Le cyclooctatétraène est un système à 4n électrons π mais n'est ni aromatique, ni anti-aromatique, car la molécule n'est pas plane.
En donnant ou retirant une paire d'électron par des réactions rédox, un système π peut devenir aromatique et donc devenir plus stable que le composé non- ou anti-aromatique original. Par exemple l'anion cyclooctatétraénure, qui a gagné une paire d'électron π par rapport au cyclooctatétraène, est aromatique.
Propriétés
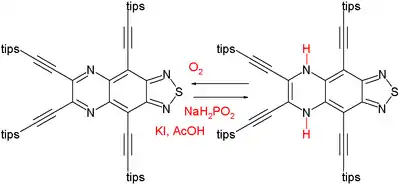
Il a été observé que la différence d'énergie entre les composés aromatiques et anti-aromatiques diminuait avec l'augmentation de leur taille[2]. Par exemple, le système à 12 électrons π du diphénylène (en) est anti-aromatique, mais le composé est stable, et est d'ailleurs commercialisé. On peut voir aussi que la faible déstabilisation induite par l'anti-aromaticité n'empêche pas une réaction de formation du composé anti-aromatique, par exemple dans certains composés comportant un couple pyrazine-dihydropyrazine :
Le composé de gauche a un système à 14 électrons π, et est aromatique (déplacement chimique indépendant du cœur de –26,1 ppm); il peut être réduit dans une réaction extrêmement exothermique en un composé avec un système à 16 électrons π, anti-aromatique (+27,7 ppm)[3]. Cependant la dihydropyrazine est lentement reconvertie en pyrazine sous l'action du dioxygène.
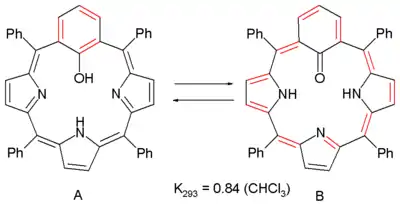
On peut aussi observer de l'anti-aromaticité dans l'équilibre chimique entre deux dérivés de la porphyrine[4]:
Une porphyrine « normale » est un composé aromatique avec un système à 18 électrons π (sans compter deux double liaisons ne participant au système), cependant, en substituant le noyau de pyrrole par un cycle phénylène en méta, on perd l'aromaticité par manque de conjugaison. Dans ce système, le groupe phénylène est aussi un phénol, et donc la structure A se trouve interconvertie en un composé B', anti-aromatique, avec un système à 20 électrons π par un mécanisme de tautomérie céto-énolique. L'anti-aromaticité du composé B est flagrante à la spectroscopie RMN avec un déplacement chimique des protons internes des radicaux NH de 10 ppm à 21 ppm. Le déplacement chimique indépendant du cœur du composé A est de +0,7 pour A (non-aromatique) est de +5 (anti-aromatique) pour B, et pourtant, des simulations informatiques prédisent que B est en fait plus stable que A.
Notes et références
- (en) « antiaromatic compounds », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8), accédé le .
- A Thiadiazole-Fused N,N-Dihydroquinoxaline: Antiaromatic but Isolable Shaobin Miao, Paul v. R. Schleyer (en), Judy I. Wu, Kenneth I. Hardcastle, and Uwe H. F. Bunz Org. Lett.; 2007; 9(6) p. 1073 - 1076; (Letter) DOI:10.1021/ol070013i
- Agent réducteur : hypophosphite de sodium, tips : triisopropylsilyle
- 22-Hydroxybenziporphyrin: Switching of Antiaromaticity by Phenol-Keto Tautomerization Marcin Stpie, Lechosaw Latos-Grayski, and Ludmia Szterenberg J. Org. Chem.; 2007; 72(7) p. 2259 - 2270; (Article) DOI:10.1021/jo0623437
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Antiaromaticity » (voir la liste des auteurs).