Anandamide
L’anandamide ou N-arachidonoylethanolamide ou AEA, est un neurotransmetteur cannabinoïde endogène présent dans l'organisme des animaux comme des humains, en particulier dans le cerveau. Il est aussi présent en faible quantité dans le cacao[2]. Son nom est la contraction du sanskrit ananda, qui signifie « béatitude » et amide, sa fonction chimique[3],[4]. Elle est synthétisée à partir du N-arachidonoyl phosphatidyléthanolamine par de nombreuses voies métaboliques[5]. Elle est dégradée essentiellement par l'enzyme Fatty Acid Amide Hydrolase (FAAH), qui convertit l'anandamide en éthanolamine et en acide arachidonique. Ainsi, les inhibiteurs de la FAAH entraînent une augmentation des niveaux d'anandamide et sont utilisés pour un usage thérapeutique[6],[7].
Pour les articles homonymes, voir AEA.
| Anandamide | |
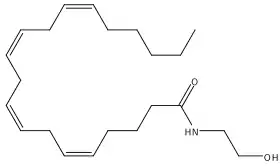
| |
| Structure de l'anandamide | |
| Identification | |
|---|---|
| Nom UICPA | (5Z,8Z,11Z,14Z)-N-(2-hydroxyethyl) icosa-5,8,11,14-tetraenamide |
| No CAS | |
| SMILES | |
| InChI | |
| Apparence | huile jaune clair |
| Propriétés chimiques | |
| Formule | C22H37NO2 [Isomères] |
| Masse molaire[1] | 347,534 7 ± 0,021 g/mol C 76,03 %, H 10,73 %, N 4,03 %, O 9,21 %, |
| Propriétés physiques | |
| Solubilité | sol dans l'éthanol |
| Masse volumique | 0,92 g·cm-3 à 25 °C |
| Précautions | |
| Directive 67/548/EEC | |
| Unités du SI et CNTP, sauf indication contraire. | |
Histoire
Elle a été isolée et sa structure fut décrite la première fois en 1992 par WA Devane, Lumir Hanus et leurs collègues qui travaillaient dans l'équipe menée par Raphael Mechoulam à l'Université hébraïque de Jérusalem[8].
Ligands et récepteurs endocannabinoïdes
C'est un cannabinoïde endogène ou endocannabinoïde qui agit au niveau du cerveau et sur d'autres parties du corps. Il agit comme le tétrahydrocannabinol en se liant avec le récepteur CB1. Il se lie également en périphérie avec le récepteur CB2 qui est un récepteur impliqué dans le système immunitaire[9].
Les récepteurs cannabinoïdes ont été à l'origine découverts comme étant sensibles au ∆9-tétrahydrocannabinol (∆9-THC, couramment appelé THC) qui est le composé psychoactif principal retrouvé dans le cannabis. La découverte de l'anandamide vient des recherches sur le CB1 et le CB2, puisqu'il était inévitable qu'un composé chimique endogène activant ces récepteurs serait trouvé.
En 1996, de l'anandamide a été découverte dans le chocolat. Deux substances ont aussi été découvertes qui pourraient avoir des effets proches de l'anandamide, la N-oleoylethanolamine et la N-linoleoylethanolamine[10].
Métabolisme
- Déclenchement de la synthèse
L'anandamide est synthétisée dans l'espace post-synaptique d'une synapse à la suite d'une dépolarisation calcique par l'augmentation de l’entrée de calcium dans les neurones post-synaptiques induit par la stimulation de différents récepteurs[11].
- Synthèse
L'anandamide est synthétisée à partir de la N-arachidonoyl phosphatidylethanolamine (NAPE), qui est elle-même fabriquée en transferrant l'acide arachidonique à partir de la lécithine au groupement amine libre d'une phosphatidylethanolamine grâce à l'enzyme N-acyltransférase[12],[13]. La synthèse d'anandamide à partir de NAPE intervient via de nombreuses voies métaboliques et implique des enzymes comme la phospholipase A2, la phospholipase C et la NAPE-PLD[5].
- Catabolisme
L'anandamide endogène est présente à des doses très faibles et a une durée de vie très courte à cause de l'action de la fatty acid amide hydrolase (FAAH), qui la catalyse en acide arachidonique libre et en éthanolamine[14]. Des études sur des cochons montrent qu'un régime enrichi en acide arachidonique et en autres acides gras essentiels augmentent les niveaux d'anandamide et d'autres endocannabinoïdes dans le cerveau[15].
- Action
L'anandamide agit comme signal rétrograde sur la membrane pré-synaptique où il active un récepteur couplé à une protéine G, le CB1. Celui-ci a une action inhibitrice sur la libération des neurotransmetteurs de la synapse (soit le glutamate, soit le GABA) par le processus d'inhibition de l’activité de l’adénylate cyclase (qui a pour effet de réduire la durée du potentiel d’action en diminuant la sensibilité au potentiel de membrane des canaux potassiques de type A) et de réduction des flux calciques et potassiques indispensables à l’exocytose des granules contenant le neurotransmetteur. D’autre part, l’activation du récepteur CB1 provoque une inhibition indirecte, par le biais d’une protéine Gi/o, de divers canaux Ca2+ sensibles au potentiel (type N, L et Q/P)[16].
Ainsi, l'anandamide diminue la transmission de l'influx nerveux, elle peut donc être qualifiée de neuromodulateur[17].
Physiologie
L'anandamide a montré qu'elle empêchait la mémoire de travail chez les rats[18]. Des études sont en cours pour explorer le rôle de l'anandamide dans le comportement humain, comme l'alimentation, les rythmes du sommeil et le soulagement de la douleur. Les rôles de cette modulation interviennent au niveau de nombreuses fonctions :
- modulation de la mémoire (hippocampe) ;
- modulation des émotions (amygdale) ;
- modulation de l'activité motrice (ganglions de la base) ;
- analgésie centrale (rhombencéphale) ;
- rôles potentiels dans l'habituation, la cognition et le système de récompense (contrôlant la prise alimentaire et les phénomènes d'addiction) ;
- implantation de l'embryon.
L'anandamide est aussi importante pour l'implantation de l'embryon sous sa forme blastocyste dans l'utérus. Par conséquent les cannabinoides comme le Δ9-THC pourraient influencer ce processus[19]. Les pics plasmatiques d'endocannabinoïdes apparaissent lors de l'ovulation et augmentent de manière parallèle avec les pics d’œstradiols et de gonadotrophines, ce qui suggère que ces molécules pourraient être impliquées dans la régulation des niveaux d'anandamide[20].
- Alimentation et plaisir
L'anandamide joue un rôle dans la régulation du comportement alimentaire et la génération neurale de motivation et de plaisir. Par ailleurs, l'anandamide injectée directement dans le noyau accumbens augmente les réponses au plaisir des rats à des récompenses sucrées et augmente aussi la prise de nourriture[9],[21].
Conséquences en médecine
- Liens avec le paracétamol
Le paracétamol est métaboliquement combiné avec l'acide arachidonique par la FAAH pour former l'AM404[22]. Ce métabolite du paracétamol est un possible agoniste du récepteur vanilloïde TRPV1, un faible agoniste des récepteurs CB1 et CB2 et un inhibiteur de la recapture de l'anandamide. Par conséquent, les niveaux d'anandamide dans le corps et le cerveau sont augmentés. Le paracétamol serait alors une pro-drogue des métabolites cannabimimétiques. Cette action pourrait être partiellement ou totalement responsable des effets antalgiques du paracétamol[23],[24]. Des études ont montré que la libération d'anandamide est associée à l'effet antalgique induit par l'exercice physique, notamment la course à pied[25].
- Cancer du sein
L'anandamide inhibe la prolifération cellulaire du cancer du sein humain[26].
- Obésité
Un régime enrichi en graisses augmente les niveaux d'anandamide dans le foie et augmente la lipogenèse[27]. Ceci suggère que l'anandamide pourrait jouer un rôle dans l'obésité, au moins chez les rongeurs.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) The Merck index, 13e édition, 2001, (ISBN 0911910-13-1)
- (en) Devane WA, Hanuš L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, Gibson D, Mandelbaum A, Etinger A, Mechoulam R. « Isolation and structure of a brain constituent that binds to the cannabinoid receptor » Science 258, 1946-1949 (1992)
- (en) Mechoulam R, Fride E. The unpaved road to the endogenous brain cannabinoid ligands, the anandamides in “Cannabinoid Receptors” (ed. R. Pertwee), Academic Press, London. p. 233-258 (1995)
- (en) Jun Wang et Natsuo Ueda, « Biology of endocannabinoid synthesis system », Prostaglandins & other lipid mediators, vol. 89, nos 3-4, , p. 112-119 (ISSN 1098-8823, PMID 19126434, DOI 10.1016/j.prostaglandins.2008.12.002, lire en ligne)
- (en) Silvana Gaetani, Pasqua Dipasquale, Adele Romano, Laura Righetti, Tommaso Cassano, Daniele Piomelli, Vincenzo Cuomo « Chapter 5 The Endocannabinoid System as A Target for Novel Anxiolytic and Antidepressant Drugs » International Review of Neurobiology 2009, Volume 85, Pages 57–72. DOI:10.1016/S0074-7742(09)85005-8
- (en) Jeannie Hwang, Crista Adamson, David Butler, David R Janero, Alexandros Makriyannis, Ben A Bahr, « Enhancement of endocannabinoid signaling by fatty acid amide hydrolase inhibition: a neuroprotective therapeutic modality », Life sciences, vol. 86, nos 15-16, , p. 615-623 (ISSN 1879-0631, PMID 19527737, DOI 10.1016/j.lfs.2009.06.003, lire en ligne)
- (en) WA Devane, L Hanus, A Breuer, RG Pertwee, LA Stevenson, G Griffin, D Gibson, A Mandelbaum, A Etinger et R Mechoulam, « Isolation and structure of a brain constituent that binds to the cannabinoid receptor », Science, vol. 258, no 5090, , p. 1946–9 (lire en ligne)
- (en) Pacher P, Batkai S, Kunos G, « The Endocannabinoid System as an Emerging Target of Pharmacotherapy », Pharmacol Rev., vol. 58, no 3, , p. 389–462 (PMID 16968947, PMCID 2241751, DOI 10.1124/pr.58.3.2)
- (en) di Tomaso E, Beltramo M, Piomelli D., « Brain cannabinoids in chocolate », Nature, vol. 382, no 6593, , p. 677–8 (PMID 8751435, DOI 10.1038/382677a0)
- « Le système endocannabinoïde : de la physiologie aux potentialités thérapeutiques », sur www.jle.com, (consulté le )
- (en) Natarajan V, Reddy PV, Schmid PC, Schmid HH, « N-Acylation of ethanolamine phospholipids in canine myocardium », Biochim. Biophys. Acta, vol. 712, no 2, , p. 342–55 (PMID 7126608)
- (en) Cadas H, di Tomaso E, Piomelli D, « Occurrence and biosynthesis of endogenous cannabinoid precursor, N-arachidonoyl phosphatidylethanolamine, in rat brain », J. Neurosci., vol. 17, no 4, , p. 1226–42 (PMID 9006968)
- (en) D. Piomelli « The molecular logic of endocannabinoid signalling » Nat Rev Neurosci. 4, 873-884 (2003)
- (en) Berger A, et al., « Anandamide and diet: Inclusion of dietary arachidonate and docosahexaenoate leads to increased brain levels of the corresponding N-acylethanolamines in piglets », Proc. Natl. Acad. Sci. U.S.A., vol. 98, no 11, , p. 6402–6 (PMID 11353819, PMCID 33480, DOI 10.1073/pnas.101119098)
- « Le système endocannabinoïde : de la physiologie aux potentialités thérapeutiques », sur http://www.jle.com/, (consulté le )
- Jean Chemin, Arnaud Monteil, Edward Perez-Reyes et Joël Nargeot, « Direct inhibition of T-type calcium channels by the endogenous cannabinoid anandamide », The EMBO Journal, vol. 20, no 24, , p. 7033–7040 (ISSN 0261-4189, PMID 11742980, DOI 10.1093/emboj/20.24.7033, lire en ligne, consulté le )
- (en) Mallet PE, Beninger RJ, « The endogenous cannabinoid receptor agonist anandamide impairs memory in rats », Behavioural Pharmacology, vol. 7, no 3, , p. 276–284 (lire en ligne)
- (en) Piomelli D, « THC: moderation during implantation », Nat. Med., vol. 10, no 1, , p. 19–20 (PMID 14702623, DOI 10.1038/nm0104-19)
- (en) El-Talatini MR, Taylor AH, Konje JC, « The relationship between plasma levels of the endocannabinoid, anandamide, sex steroids, and gonadotrophins during the menstrual cycle », Fertil. Steril., vol. 93, no 6, , p. 1989–96 (PMID 19200965, DOI 10.1016/j.fertnstert.2008.12.033)
- (en) Mahler SV, Smith KS, Berridge KC, « Endocannabinoid hedonic hotspot for sensory pleasure: anandamide in nucleus accumbens shell enhances 'liking' of a sweet reward », Neuropsychopharmacology, vol. 32, no 11, , p. 2267–78 (PMID 17406653, DOI 10.1038/sj.npp.1301376)
- DOI:10.1074/jbc.M501489200
- (en) Bertolini A, et al., « Paracetamol: new vistas of an old drug », CNS Drug Rev, vol. 12, nos 3–4, , p. 250–75 (PMID 17227290, DOI 10.1111/j.1527-3458.2006.00250.x)
- (en) Sinning C, et al., « New analgesics synthetically derived from the paracetamol metabolite N-(4-hydroxyphenyl)-(5Z,8Z,11Z,14Z)-icosatetra-5,8,11,14-enamide », J. Med. Chem., vol. 51, no 24, , p. 7800–5 (PMID 19053765, DOI 10.1021/jm800807k)
- Dietrich A, McDaniel W. Endocannabinoids and exercise. British Journal of Sports Medicine. 2004;38(5):536-541. doi:10.1136/bjsm.2004.011718. http://doi.org/10.1136/bjsm.2004.011718
- (en) De Petrocellis L. et al., « The endogenous cannabinoid anandamide inhibits human breast cancer cell proliferation », Proc Natl Acad Sci. USA, vol. 95, no 14, , p. 8375–80 (PMID 9653194, PMCID 20983, DOI 10.1073/pnas.95.14.8375)
- (en) Osei-Hyiaman D, et al., « Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity », J. Clin. Invest., vol. 115, no 5, , p. 1298–305 (PMID 15864349, PMCID 1087161, DOI 10.1172/JCI23057)
Voir aussi
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie