Arsénite
Les arsénites sont des oxydes d'arsenic qui possèdent un degré d'oxydation de III+. Ils n'apparaissent que très rarement spontanément dans la nature. Ils peuvent cependant être synthétisés et être utilisés dans l'industrie (production de pesticides notamment) [1]. Historiquement, ils ont joué un rôle important comme pigments vert-bleu pour la peinture, tel le vert de Paris ou le vert de Scheele avant d'être remplacés par des composés moins toxiques.
Description
Il existe 2 acides arsénieux : l'Acide orthoarsénieux de formule H3AsO3 et l'acide métaarsénieux de formule HAsO2. Ceci crée une liste des ions arsénite :
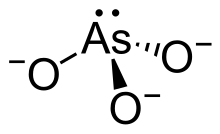
- ion dihydrogénoortho-arsénite ou dihydrogénoarsénite : H2AsO3−
- ion hydrogénoortho-arsénite ou hydrogénoarsénite : HAsO32−
- ion arsénite : AsO33−
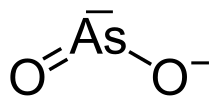
- ion méta-arsénite : AsO2−
Gisements naturels
Des localisations connues de tels minéraux sont situées :
- dans le complexe skarn de manganèse à Långban (Suède) ;
- dans les substrats polymétalliques de Tsumeb en Namibie.
Les radicaux les plus couramment observés sont :
- l'anion AsO33− présent par exemple dans la reinerite (Zn3(AsO3)2).
Il arrive que l'on observe un anion de diarsénite comme dans la leiteite (Zn[As2O4]) et dans la paulmooreite Pb[As2O5].
Des arsénites plus complexes existent, et comprennent par exemple la schneiderhöhnite Fe2+Fe3+3[As5O13] et la ludlockite PbFe3+4As10O22[2],[3],[4].
Toxicité et écotoxicité
Les arsénites sont des poisons pour les animaux et l'Homme, ainsi que pour la plupart des plantes[5].
Les fiches de sécurité internationales des arsénites (Cf. bibliographie plus bas) précisent :
« Il est fortement recommandé de ne pas laisser ce produit contaminer l'environnement en raison de sa persistance dans l'environnement »[6].
Pour les quelques plantes connues tolérantes à l'arsenic, l'arsénite est moins dangereux que l'arséniate. Deux mécanismes de tolérance sont connus :
- Certaines plantes transforment l'arséniate en arsénite et le stockent dans des vacuoles à l'intérieur de leurs cellules foliaires, en protégeant ainsi leur cytoplasme, mais en pouvant en accumuler des quantités considérables (pour les plantes bioaccumulatrices)[7],[8] ;
- D'autres plantes (ex : Brassica juncea complexent l'As (III) par des phytochélatines (PC)[9], avec probable stockage dans des vacuoles, en conditions acides favorables à la stabilité de ces complexes[10].
Références
- INRS, 2006 Arsenic et composés minéraux Fiche établie par les services techniques et médicaux de l'INRS, édition 2006
- Mindat
- Handbook of Mineralogy
- Webmineral
- Ullrich-Eberius CI, Sanz A, Novacky AJ. 1989. Evaluation of arsenate- and vanadate-associated changes of electrical membrane potential and phosphate transport in Lemna gibba G1. Journal of Experimental Botany 40: 119–128 (Résumé)
- Fiches internationales de sécurité chimique 1241 - Arsénite ferrique Pentahydrate (As2Fe2O6.Fe2O3.5H2O)
- Delnomdedieu M, Basti MM, Orvos JD, Thomas DJ. 1994. Reduction and binding of arsenate and dimethylarsenate by glutathione – a magnetic resonance study. Chemico–Biological Interactions 90: 139–155. (Résumé)
- Pickering IJ, Prince RC, George MJ, Smith RD, George GN, Salt DE. 2000. Reduction and coordination of arsenic in Indian mustard. Plant Physiology 122: 1171–1177 (Résumé)
- Pickering IJ, Prince RC, George MJ, Smith RD, George GN, Salt DE. 2000. Reduction and coordination of arsenic in Indian mustard. Plant Physiology 122: 1171–1177 (Résumé)
- Meharg AA, Hartley-Whitaker J. 2002. Arsenic uptake and metabolism in arsenic resistant and nonresistant plant species. New Phytologist 154: 29–44. (Résumé et article complet)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Arsenite » (voir la liste des auteurs).
Voir aussi
Articles connexes
- Arsenic
- Arséniate
- Arsénite de cuivre
- Arsénite de sodium
- Arsénite de potassium
- Arsénite ferrique
Bibliographie
- Fiches internationales de sécurité chimique 1213 - Arsénite de potassium (Métaarsénite de potassium. Arsonate de potassium KAsO2...) avis du comité de révision du PISSC
- Fiches internationales de sécurité chimique 1211 - Arsénite de cuivre (Orthoarsénite de cuivre. Arsonate de cuivre AsHO3Cu ..).
- Fiches internationales de sécurité chimique 1241 - Arsénite ferrique Pentahydrate (As2Fe2O6.Fe2O3.5H2O).
- (en) Quéméneur M, Cébron A, Billard P, Battaglia-Brunet F, Garrido F, Leyval C, Joulian C. (2010), Population structure and abundance of arsenite-oxidizing bacteria along an arsenic pollution gradient in waters of the upper Isle River Basin, France. ; Appl Environ Microbiol. 2010 Jul; 76(13):4566-70. Epub 2010 May 7.
- Portail des minéraux et roches
- Portail de la chimie