Pentafluorure d'arsenic
Le pentafluorure d'arsenic est un composé chimique de l'arsenic et du fluor dans lequel le degré d'oxydation de l'atome d'arsenic est +5.
| Pentafluorure d'arsenic | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | pentafluoro-λ5-arsane |
| Synonymes |
fluorure d'arsenic(V) |
| No CAS | |
| No ECHA | 100.029.146 |
| No CE | 232-061-6 |
| PubChem | 82223 |
| ChEBI | 30530 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore, fumant au contact de l'air |
| Propriétés chimiques | |
| Formule | AsF5 [Isomères] |
| Masse molaire[1] | 169,913 62 ± 2,0E−5 g/mol As 44,09 %, F 55,91 %, |
| Propriétés physiques | |
| T° fusion | −79,8 °C[2] |
| T° ébullition | −52,8 °C[2] |
| Solubilité | soluble dans l'éthanol, le diéthyl éther et le benzène[3] |
| Masse volumique | 2,138 g·cm-3 au point d'ébullition (−52,8 °C)[2] |
| Précautions | |
| SGH[2] | |
  |
|
| NFPA 704[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Le pentafluorure d'arsenic peut être préparé par combinaison directe de l'arsenic et du fluor[4] :
- 2As + 5F2 → 2AsF5
Il peut également être préparé par la réaction de trifluorure d'arsenic et du fluor :
- AsF3 + F2 → AsF5
Propriété
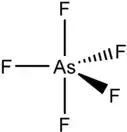
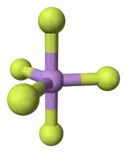
Le pentafluorure d'arsenic est un gaz incolore et a une structure moléculaire de bipyramide trigonale[4]. Dans l'état solide, les liaisons As-F axiales ont une longueur de 171,9 pm et celles équatoriales de 166,8 pm[4]. C'est aussi, du fait de l'arsenic (V), un acide de Lewis fort et également un agent oxydant et un agent de fluoration.
Réaction
Le pentafluorure d'arsenic forme facilement des complexes avec les halogénures car il est un puissant accepteur comme représenté par sa réaction avec le tétrafluorure de soufre[5]:
- AsF5 + SF4 → SF3+AsF6−
Sécurité
Le pentafluorure d'arsenic est un composé toxique extrêmement dangereux, qui empoisonne principalement les cellules hépatiques. Il a une odeur apparente qui est semblable à celle du chlorure de vinyle[réf. souhaitée].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Arsenic pentafluoride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Arsenic(V) fluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29/06/2014 (JavaScript nécessaire)
- G. Brauer, Handbook of Preparative Inorganic Chemistry, 2nd ed., vol. 1, Academic Press, 1963, pp. 198-9.
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the elements, Oxford Boston, Butterworth-Heinemann, , 2e éd. (1re éd. 1984), 1341 p. (ISBN 978-0-7506-3365-9, OCLC 804401792).
- M. Azeem, M. Brownstein, R. J. Gillespie, An investigation of the structures of the adducts of SF4 with BF3, PF5, AsF5, and SbF5 in the solid state and in solution in HF, Can. J. Chem., 1969, vol. 47(22), p. 4159–4167. DOI:10.1139/v69-689.
- Portail de la chimie
