Base de Michler
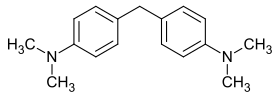
La base de Michler ou 4,4′-méthylènebis(N,N-diméthylaniline) (MDMA) est un composé aromatique de formule C17H22N2, appartenant à la famille des diphénylméthanes et à celle des aminobenzènes. Elle doit son nom au chimiste allemand Wilhelm Michler (1846-1889) qui l'a découverte et synthétisée.
| Base de Michler | |
| |
| Identification | |
|---|---|
| Nom systématique | 4,4′-bis(diméthylamino)diphénylméthane |
| Synonymes |
N,N,N′,N′-tétraméthyl-4,4′-méthylèndianiline, 4,4′-méthylènebis(N,N-diméthylaniline) |
| No CAS | |
| No ECHA | 100.002.691 |
| No RTECS | BY5250000 |
| PubChem | 7567 |
| SMILES | |
| InChI | |
| Apparence | feuillets blancs à blanc-bleuâtre à l'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | C17H22N2 |
| Masse molaire[2] | 254,37 ± 0,015 5 g/mol C 80,27 %, H 8,72 %, N 11,01 %, |
| Propriétés physiques | |
| T° fusion | 90 à 91 °C[1] |
| T° ébullition | 390 °C[1] 155 à 157 °C (0,13 hPa)[1] |
| Solubilité | pratiquement insoluble dans l'eau[1] |
| Masse volumique | 1,039 g·cm-3 |
| Point d’éclair | 178 °C (coupelle fermée)[1] |
| Précautions | |
| SGH[1] | |
  |
|
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 3 160 mg·kg-1 (souris, oral)[3] |
| LogP | 4,370[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
La base de Michler est un solide blanc à blanc-bleuâtre, à l'odeur caractéristique. Elle est combustible mais difficilement inflammable (point d'éclair de 178 °C), et pratiquement insoluble dans l'eau[1].
Synthèse
Il existe plusieurs méthode de synthèse de la base de Michler, la plupart à partir de la diméthylaniline :
- réaction de la diméthylaniline avec le formaldéhyde en présence d'acide chlorhydrique concentré[5] ;
- réaction entre la diméthylaniline et le peroxyde de diacétyle[5] ;
- réaction entre la diméthylaniline et le perbenzoate de tert-butyle[5] ;
- oxydation anodique de la diméthylaniline[6].
Utilisations
La base de Michler est un intermédiaire dans la synthèse de colorants, par exemple l'auramine O. C'est également un réactif permettant de détecter le plomb[7], et elle peut être utilisée pour le dosage qualitatif des cyanogènes[8]. Elle a notamment été utilisée pour contrôler la production de cyanure d'hydrogène (HCN) par des bactéries[9].
La base de Michler est un composant du papier de Feigl-Anger, permettant de visualiser les dégagement de HCN[10].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Michlers Base » (voir la liste des auteurs).
- Entrée « Methylenebisdimethylaniline » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 septembre 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Progress Report for Contract No. NIH-NCI-E-C-72-3252, Submitted to the National Cancer Institute by Litton Bionetics, Inc. Vol. NCI-E-C-72-3252, Pg. 1973.
- Fiche (en) « Base de Michler », sur ChemIDplus, consulté le 27 septembre 2019.
- « BIS(P-(DIMETHYLAMINO)PHENYL)METHANE » dans la base de données Hazardous Substances Data Bank
- (ja) Takashi MICHIDA, Eriko OSAWA, et Yumiko YAMAOKA, « Formation Mechanism of 4,4-Methylenebis(N,N-dimethylaniline) by the Anodic Oxidation of N,N-Dimethylaniline », Journal of the Pharmaceutical Society of Japan, vol. 121 (12), , p. 1005-1010 (DOI 10.1248/YAKUSHI.121.1005)
- Ranjodh Singh Eighth Annual Report on Carcinogens (1999)
- D. Dufour, G. M. O'Brien, Rupert Best, Cassava flour and starch : progress in research and development, , 409 p. (ISBN 958-94-3988-8, lire en ligne), p. 157
- Rezzonico F, Zala M, Keel C, Duffy B, Moënne-Loccoz Y, Défago G., « Is the ability of biocontrol fluorescent pseudomonads to produce the antifungal metabolite 2,4-diacetylphloroglucinol really synonymous with higher plant protection? », New Phytol, vol. 173 (4), (PMID 17286834, DOI 10.1111/j.1469-8137.2006.01955.x)
- Pentzold S, Zagrobelny M, Roelsgaard PS, Møller BL, Bak S, « The multiple strategies of an insect herbivore to overcome plant cyanogenic glucoside defence. », PLOS One, vol. 9 (3), (PMID 24625698, DOI 10.1371/journal.pone.0091337)
