Anhydride trifluoroacétique
L'anhydride trifluoroacétique (TFAA) est un composé chimique de formule F3C–COOCO–CF3. Il s'agit de l'anhydride de l'acide trifluoroacétique F3C–COOH, dérivé perfluoré de l'anhydride acétique CH3COOCOCH3. Il se présente sous la forme d'un liquide fortement hygroscopique et très corrosif lorsqu'il s'hydrolyse ; il est stocké dans des récipients dont les parois intérieures sont protégées par une couche de polyéthylène.
| Anhydride trifluoroacétique | |||
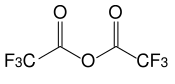 Structure de l'anhydride trifluoroacétique |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | (2,2,2-trifluoroacétyl) 2,2,2-trifluoroacétate | ||
| Synonymes |
anhydride perfluoroacétique, |
||
| No CAS | |||
| No ECHA | 100.006.349 | ||
| No CE | 206-982-9 | ||
| No RTECS | AJ9800000 | ||
| PubChem | 9845 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C4F6O3 [Isomères] |
||
| Masse molaire[1] | 210,031 4 ± 0,004 1 g/mol C 22,87 %, F 54,27 %, O 22,85 %, |
||
| Propriétés physiques | |||
| T° fusion | −65 °C[2] | ||
| T° ébullition | 39,5 à 40 °C[2] | ||
| Masse volumique | 1,511 g·cm-3[2] à 20 °C | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
L'anhydride trifluoroacétique est un réactif utilisé en chimie analytique. Il permet de produire des esters et des amides de l'acide trifluoroacétique F3C–COOH afin par exemple d'introduire un groupe trifluorométhyle –CF3, important pour l'industrie pharmaceutique. Il peut être obtenu à l'échelle du laboratoire par déshydratation de l'acide trifluoroacétique à l'aide de pentoxyde de phosphore P4O10. Cette méthode n'est cependant pas efficace pour une production à grande échelle, et l'on préfère alors utiliser un excès de chlorures d'acyle α-halogénés, tel que le chlorure de dichloroacétyle Cl2CHCOCl :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Anhydride trifluoroacétique ReagentPlus®, ≥ 99 %, consultée le 18 avril 2013.
- Portail de la chimie
