Thiophène
Le thiophène est un composé chimique de formule C4H4S. C'est un composé organosulfuré hétérocyclique de la classe des métalloles. Sa nature aromatique se traduit par un grand nombre de réactions de substitution. Il se présente sous la forme d'un liquide incolore à l'odeur rappelant celle du benzène. Sa chimie rappelle également celle du benzène.
| Thiophène | |
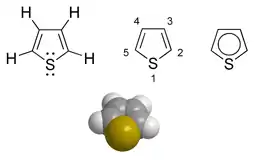
| |
| Structure chimique du thiophène | |
| Identification | |
|---|---|
| Nom UICPA | Thiophène |
| Synonymes |
Sulfure de divinylène |
| No CAS | |
| No ECHA | 100.003.392 |
| No CE | 203-729-4 |
| No RTECS | XM7350000 |
| PubChem | 8030 |
| ChEBI | 30856 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, d'odeur âcre[1] rappelant celle du benzène[2]. |
| Propriétés chimiques | |
| Formule | C4H4S [Isomères] |
| Masse molaire[3] | 84,14 ± 0,008 g/mol C 57,1 %, H 4,79 %, S 38,11 %, |
| pKa | 38,4 |
| Moment dipolaire | 0,55 ± 0,01 D [4] |
| Propriétés physiques | |
| T° fusion | −38 °C[1] |
| T° ébullition | 84 °C[1] |
| Solubilité | dans l'eau : nulle[1] |
| Paramètre de solubilité δ | 20,1 MPa1/2 (25 °C)[5] |
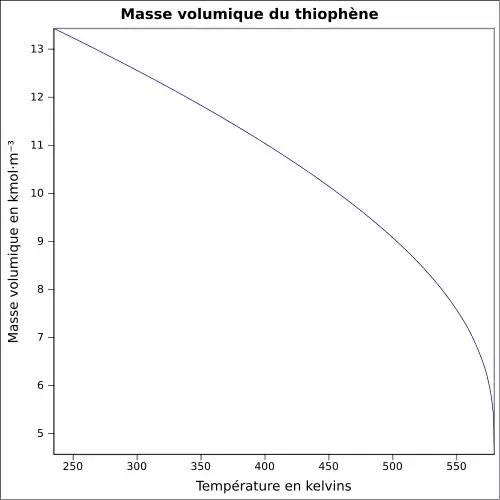
| Masse volumique | 1,06 g·cm-3[1] à 20 °C, 2,9 (air = 1) |
| T° d'auto-inflammation | 395 °C[1] |
| Point d’éclair | −1 °C[1] ; −9 °C |
| Limites d’explosivité dans l’air | 1,5–12,5 %vol[1] |
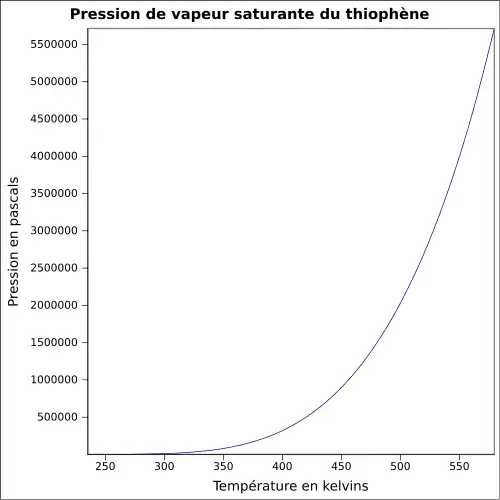
| Pression de vapeur saturante | à 12,5 °C : 5,3 kPa[1]
|
| Thermochimie | |
| S0liquide, 1 bar | 181 J/mol·K |
| ΔfH0gaz | 115,0 kJ/mol |
| ΔfH0liquide | 81 kJ/mol |
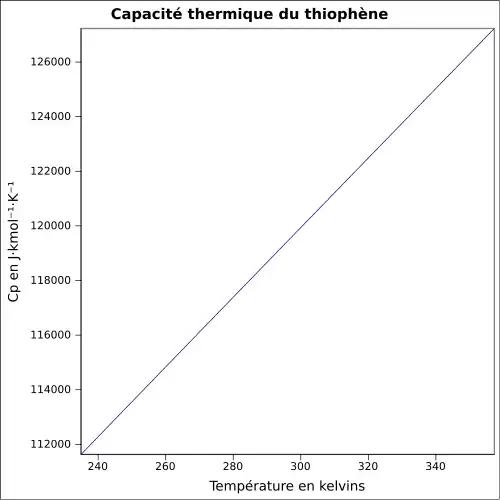
| Cp | 122.4 J/mol·K (liq.)
|
| Propriétés électroniques | |
| 1re énergie d'ionisation | 8,86 ± 0,02 eV (gaz)[8] |
| Propriétés optiques | |
| Indice de réfraction | 1,529 (20 °C) |
| Précautions | |
| SGH[2] | |
  Danger |
|
| NFPA 704 | |
| Transport[2] | |
| Écotoxicologie | |
| LogP | 1,81[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
On trouve souvent le thiophène naturellement dans le pétrole, à des concentrations pouvant atteindre 1 à 3 %. Il a également été détecté sur Mars dans des échantillons prélevés dans le cratère Gale[9] et dont le contenu organique évoque le kérogène terrestre[10].
Le thiophène est un des composés utilisés pour dénaturer l'alcool. Les analogues du thiophène sont par exemple le furane C4H4O, le sélénophène C4H4Se et le pyrrole C4H4NH, qui se distinguent les uns des autres par l'hétéroatome présent dans le cycle.
La réaction de polymérisation du thiophène conduit au polythiophène.
Chimie
La chimie du thiophène est essentiellement marquée par son caractère aromatique (quatre électrons apportés par les doubles liaisons, deux par le soufre). Le cycle peut donc subir les substitutions électrophiles aromatiques classiquement rencontrées sur les aromatiques, telles les halogénations, les réactions de Friedel-Crafts (rarement en présence de chlorure d'aluminium AlCl3, qui a tendance à favoriser des polymérisations par ouverture du cycle, néanmoins), des formylations de Wilsmeier-Haack, …
De par la présence du soufre, les substitutions sont fortement orientées sur les carbones 2 et 5, et il est quasiment impossible d'orienter une réaction en position 3 ou 4 si ces deux positions ne sont pas déjà occupées. Une exception notable est par exemple l'isomérisation du 2-bromothiophène en 3-bromothiophène en présence de silice acide.
Le thiophène est cependant nettement plus fragile qu'un aromatique simple, et peut subir des réactions de dégradation en présence d'acide fort (notamment l'acide sulfurique H2SO4) ou d'acide de Lewis (AlCl3).
L'hydrogénation des doubles liaisons est nettement plus simple que sur le benzène, mais il est très difficile de s'arrêter à une seule réaction.
Voir aussi
Composés structurellement ou chimiquement apparentés :
Liens externes
Notes et références
- THIOPHENE, Fiches internationales de sécurité chimique
- Entrée « Thiophene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 juin 2018 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- (en) Paul Voosen, « NASA rover hits organic pay dirt on Mars », sur http://www.sciencemag.org/, (consulté le ).
- Portail de la chimie