Chalcogénure d'hydrogène
Les chalcogénures d'hydrogène (ou hydrures de chalcogène) sont des composés binaires de l'hydrogène et d'un atome de chalcogène (éléments du groupe 16 : oxygène, soufre, sélénium, tellure et polonium). L'eau, constituée d'un atome d'oxygène et deux atomes d'hydrogène, est le premier composé de cette série et est le composé le plus courant à la surface de la Terre[1].
Chalcogénures de dihydrogène
Les composés les plus importants de cette série, ce qui inclut l'eau, ont une formule chimique du type H2X, où X représente un chalcogène. Ces composés sont triatomiques, adoptent une géométrie moléculaire coudée et sont des molécules polaires. En dehors l'eau, essentielle à la vie sur Terre, tous les autres chalcogénures d'hydrogène sont extrêmement toxiques et possèdent une forte odeur nauséabonde ressemblant à des œufs ou des végétaux pourris. Le sulfure de dihydrogène, H2S est un produit commun de décomposition dans un environnement pauvre en oxygène, et est l'un des composés responsable de l'odeur des flatulences.
L'eau dissout les autres chalcogénures d'hydrogène (du moins jusqu'au tellurure d'hydrogène), formant des solutions acides connues sous le d'« acides chalcogénohydriques » (ou « acides hydochalcogéniques »). Bien que plus faibles que les acides halogénohydriques, ils suivent la même tendance à être plus fort plus le chalcogène est lourd, et se forment de la même façon (transformant l'eau en ion hydronium H3O+ et se transformant en ion XH−). Il n'est en revanche pas connu si l'hydrure de polonium forme une solution acide dans l'eau comme ses homologues plus légers, ou s'il se comporte plus comme un hydrure métallique (voir aussi astature d'hydrogène).
| Composé | Solution aqueuse | Formule chimique | Géométrie | pKa | modèle |
|---|---|---|---|---|---|
| oxyde d'hydrogène hydrure d'oxygène eau (oxydane) | eau | H2O | 13,995 | 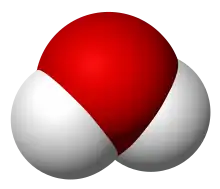 | |
| sulfure d'hydrogène hydrure de soufre (sulfane) | acide hydrosulfurique acide sulfhydrique | H2S |  | 7,0 |  |
| séléniure d'hydrogène hydrure de sélénium (sélane) | acide hydrosélénique acide sélénhydrique | H2Se |  | 3,89 |  |
| tellurure d'hydrogène hydrure de tellure (tellane) | acide hydrotellurique acide tellurhydrique | H2Te |  | 2,6 |  |
| poloniure d'hydrogène hydrure de polonium (polane) | acide hydropolonique acide polonihydrique | H2Po | ? |  |
| Propriété | H2O | H2S | H2Se | H2Te | H2Po |
|---|---|---|---|---|---|
| Point de fusion (°C) | 0,0 | −85,6 | −65,7 | −51 | −35,3 |
| Point d'ébullition (°C) | 100,0 | −60,3 | −41,3 | −4 | 36,1 |
| ΔHf° (kJ.mol−1) | −285,9 | +20,1 | +73,0 | +99,6 | ? |
| Angle de liaison (H–X–H) (gaz) | 104,45° | 92,1° | 91° | 90° | 90,9° (prédiction)[3] |
| Constante de dissociation (HX−, K1) | 1,8 × 10−16 | 1,3 × 10−7 | 1,3 × 10−4 | 2,3 × 10−3 | ? |
| Constante de dissociation (X2−, K2) | 0 | 7.1 × 10−15 | 1 × 10−11 | 1.6 × 10−11 | ? |
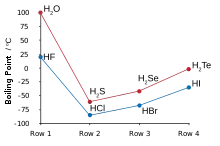
La plupart des propriétés physiques « anormales » de l'eau, comparées aux autres chalcogénures, peuvent en grande partie expliquées par les importantes liaisons hydrogène entre les atomes d'hydrogène et d'oxygène des différentes molécules. C'est notamment ce qui explique les points élevés de fusion et d'ébullition de l'eau, faisant d'elle le seul composé liquide de la série à température ambiante, ainsi que les valeurs élevées de sa permittivité, de son enthalpie et entropie de vaporisation, de sa tension superficielle et de sa viscosité[4].
Les autres chalcogénures d'hydrogène sont des gaz malodorants et hautement toxiques. Le sulfure d'hydrogène est courant dans la nature, et ses propriétés comparées à celle de l'eau montre une absence totale de liaisons hydrogène[5].
L'eau, le sulfure d'hydrogène et le séléniure d'hydrogène peuvent être produits en chauffant leur élément constitutifs au dessus de 350 °C, ce qui n'est pas possible pour le tellurure d'hydrogène et l'hydrure de polonium, du fait de leur instabilité thermique. Le tellurure d'hydrogène se décompose en présence d'humidité, à la lumière, et pour des températures supérieure à 0 °C. L'hydrure de polonium est instable et, du fait de l'intense radioactivité du polonium (résultant en une auto-radiolyse lors de sa formation), ne peut être obtenu qu'à l'état de traces trace en traitant des feuilles de magnésium plaquées de polonium par de l'acide chlorhydrique dilué. Ses propriétés sont relativement distinctes des autres chalcogénures d'hydrogène du fait que le polonium est un métal pauvre, alors que les autres chalcogènes non ; ses propriétés sont en fait intermédiaires entre celles d'un chalcogénure d'hydrogène ou un halogénure d'hydrogène, tel que le chlorure d'hydrogène, et un hydrure métallique, tel que le stannane. Tout comme l'eau, le poloniure d'hydrogène est liquide à température ambiante, mais contrairement à elle, ce haut point d'ébullition ne résulte pas de liaisons hydrogène, mais du fait d'importantes forces de van der Waals, résultantes de l'important nuage électronique du polonium[2].
Dichalcogénures de dihydrogène
Les dichalcogénures de dihydrogène ont pour formule générale H2X2 et sont en général moins stables que les monochalcogénures, se décomposant en monochalcogénure et chalcogène.
Le plus important d'entre eux est le peroxyde d'hydrogène, H2O2, un liquide bleu pâle, presque incolore, moins volatil, plus dense et plus visqueux que l'eau. C'est un composé chimiquement important, car il peut être réduit ou oxydé dans des solutions de n'importe quel pH, peut facilement former des complexes de peroxométal ou de peroxoacide, ainsi que participer à de nombreuses réactions acido-basiques. Sa solution aqueuse moins concentrée, l'eau oxygénée, est utilisée couramment comme désinfectant ou comme décolorant.
| Composé | Formule chimique | Longueur de liaison | Représentation |
|---|---|---|---|
| peroxyde d'hydrogène (dioxydane) | H2O2 |  | |
| disulfure de dihydrogène (disulfane) | H2S2 |  | |
| diséléniure de dihydrogène[6] (disélane) | H2Se2 | — |  |
| ditellurure de dihydrogène[7] (ditellane) | H2Te2 | — | — |
| Propriété | H2O2 | H2S2 | H2Se2 | H2Te2 |
|---|---|---|---|---|
| Point de fusion (°C) | -0,43 | −89,6 | ? | ? |
| Point d'ébullition (°C) | 150,2 (décomposition) | 70,7 | ? | ? |
Des études in silico ont été faites sur des isomères structurels de dichalcogénures dans lesquels les deux atomes d'hydrogène sont liés au même atomes de chalcogène lui-même lié à l'autre atome de chalcogène. Ces structures de type H2X+–X− sont des ylures. La forme isomérique du peroxyde d'hydrogène, l'« oxywater », n'a pas été synthétisée, mais celle du disulfure, le thiosulfoxyde (en) a été détecté par spectrométrie de masse[8].
Il existe aussi des dichalcogénures mixtes, comme le thioperoxyde d'hydrogène (en) (H2SO).
Chalcogénures de dihydrogène supérieurs
Les polyoxydes d'hydrogène supérieurs à H2O2 ne sont pas stables[9]. Le trioxydane, avec trois atomes d'oxygène, est un intermédiaire transitoire instable dans plusieurs réactions. Les deux suivants de la série, les tétroxyde d'hydrogène et pentoxyde d'hydrogène, ont également été synthétisés et se sont révélés hautement réactifs. Un isomère structurel du trioxydane, dans lequel les deux atomes d'hydrogène sont attachés à l'atome central d'oxygène dans la chaîne des trois oxygène plutôt que un à chaque extrémité, a été étudié in silico[10].
Au delà de H2S et H2S2, de nombreux polysulfanes (en) supérieurs H2Sn (n = 3–8) ont été étudiés et sont stables[11]. Ils présentent des chaînes linéaires de soufre, reflétant la propension du soufre à la caténation. Depuis H2S2, tous les polysulfanes connus sont liquides à température ambiante. H2S2 est incolore alors que les autres polysulfanes sont jaunes ; plus n est important, plus la couleur est intense, et plus la masse volumique, la viscosité et le point d’ébullition sont élevés.
| Composé | Masse volumique à 20 °C (g•cm−3) | Pression de vapeur (mmHg) | Point d'ébullition extrapolé (°C) |
|---|---|---|---|
| H2S | 1,363 (g•dm−3) | 1740 (kPa, 21 °C) | -60 |
| H2S2 | 1,334 | 87,7 | 70 |
| H2S3 | 1,491 | 1,4 | 170 |
| H2S4 | 1,582 | 0,035 | 240 |
| H2S5 | 1,644 | 0,0012 | 285 |
| H2S6 | 1,688 | ? | ? |
| H2S7 | 1,721 | ? | ? |
| H2S8 | 1,747 | ? | ? |
Cependant, ils peuvent être facilement oxydés et sont instables thermiquement, se décomposant facilement en soufre et sulfure d'hydrogène, une réaction catalysées par les bases[12] :
- H2Sn → H2S + n − 18 S8
Ils réagissent aussi avec les sulfites et les cyanures pour produire du thiosulfate et du thiocyanate, respectivement[12].
Un isomère structurel du trisulfure, dans lequel les deux atomes d'hydrogène sont attachés à l'atome central de soufre dans la chaîne des trois soufre plutôt que un à chaque extrémité, a été étudié in silico[10].
Il est possible que des hydrures de polonium supérieurs existent[13].
Autres composés hydrogène-chalcogène

Les chalcogénures de monohydrogène existent mais sont instables ; les plus simples sont les radicaux hydroxyle (HO•) et hydroperoxyle (HOO•). L'ozonure d'hydrogène (HO3) n'a jamais été isolé, mais certains des sels alcalins d'ozonure de formule MO3 si[14]. L'analogue soufré de l'hydroxyle est le radical sulfanyle (HS•).

Un ou plusieurs atomes de protium de l'eau peuvent être substitués par l'isotope deutérium, donnant respectivement de l'eau semi-lourde et de l'eau lourde. Du fait de l'importante différence de densité entre le deutérium et le protium, l'eau lourde présente de nombreuses propriétés anormales. Le radioisotope tritium peut de même former de l'eau tritiée. Un autre chalcogénure de deutérium notable est le disulfure de deutérium (DSSD), dont les propriétés relatives à l'effet tunnel en font un objet d'étude pour l'effet Zénon quantique. Le tellurure de deutérium (D2Te) possède une stabilité thermique légèrement supérieure à celle du tellurure de protium, ce qui a été utilisé expérimentalement dans des méthodes de dépôt chimique de couches minces de tellurure[15].
L'hydrogène partage de nombreuses propriétés avec les halogènes ; substituer l'hydrogène par des halogènes produit des halogénures de chalcogène, tel que le difluorure d'oxygène et le monoxyde de dichlore, ainsi que des composés impossibles à obtenir avec l'hydrogène, tel que le dioxyde de chlore.
Ions
Un des ions de chalcogénure les plus connus est l'anion hydroxyde (HO−), caractéristique des solutions aqueuses basiques. Il est présent dans les hydroxydes de métaux alcalins, d'alcalino-terreux, et de terres rares, formés par réactions entre ces métaux et l'eau. L'équivalent soufré est l'anion hydrogénosulfure (ou bisulfure, HS−) présent dans les sels d'hydrogénosulfure, notamment l'hydrogénosulfure de sodium.
Le cation hydronium (H3O+) est lui caractéristique des solutions aqueuses acides, ce qui inclut les acides hydrochalcogéniques eux-mêmes.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hydrogen chalcogenide » (voir la liste des auteurs).
- « CIA – The world factbook », Central Intelligence Agency (consulté le )
- Greenwood and Earnshaw, pp. 766–7
- K. Sumathi et K. Balasubramanian, « Electronic states and potential energy surfaces of H2Te, H2Po, and their positive ions », Journal of Chemical Physics, vol. 92, no 11, , p. 6604–6619 (DOI 10.1063/1.458298, Bibcode 1990JChPh..92.6604S)
- Greenwood and Earnshaw, p. 623
- Greenwood and Earnshaw, p. 682
- Andreas Goldbach, Marie-Louise Saboungi, J. A. Johnson, Andrew R. Cook et Dan Meisel, « Oxidation of Aqueous Polyselenide Solutions. A Mechanistic Pulse Radiolysis Study », J. Phys. Chem. A, vol. 104, no 17, , p. 4011–4016 (DOI 10.1021/jp994361g, Bibcode 2000JPCA..104.4011G)
- Cornelis E. C. A. Hop et Marco A. Medina, « H2Te2 Is Stable in the Gas Phase », Journal of the American Chemical Society, vol. 1994, no 116, , p. 3163–4 (DOI 10.1021/ja00086a072)
- Pascal Gerbaux, Jean-Yves Salpin, Guy Bouchoux et Robert Flammang, « Thiosulfoxides (X2S=S) and disulfanes (XSSX): first observation of organic thiosulfoxides », International Journal of Mass Spectrometry, vol. 195/196, , p. 239–249 (DOI 10.1016/S1387-3806(99)00227-4, Bibcode 2000IJMSp.195..239G)
- Greenwood and Earnshaw, pp. 633–8
- J. A. Dobado, Henar Martínez-García, José Molina et Markku R. Sundberg, « Chemical Bonding in Hypervalent Molecules Revised. 2. Application of the Atoms in Molecules Theory to Y2XZ and Y2XZ2 (Y = H, F, CH3; X = O, S, Se; Z = O, S) Compounds », J. Am. Chem. Soc., vol. 121, no 13, , p. 3156–3164 (DOI 10.1021/ja9828206)
- R. Steudel "Inorganic Polysulfanes H2S2 with n > 1" in Elemental Sulfur and Sulfur-Rich Compounds II (Topics in Current Chemistry) 2003, Volume 231, pp 99-125. DOI:10.1007/b13182
- Greenwood and Earnshaw, p. 683
- https://arxiv.org/ftp/arxiv/papers/1503/1503.08587.pdf
- Wiberg 2001, p. 497
- Xiao, M. & Gaffney, T. R. Tellurium (Te) Precursors for Making Phase Change Memory Materials. (Google Patents, 2013) (https://www.google.ch/patents/US20130129603)
Bibliographie
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 0080379419)
- Portail de la chimie


