Coloration (microscopie)
La coloration de tissu biologique est souvent nécessaire pour la mise en évidence et l'identification de cellules ou de la structure tissulaire. Certaines colorations sont compatibles avec la vie cellulaire, d'autres nécessitent la fixation des tissus, et parfois la création de coupes histologiques.
Pour les articles homonymes, voir Coloration.

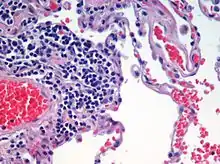
Colorations en microscopie photonique
Pour permettre l'observation des organites en microscopie optique, des substances colorantes sont utilisées.
Colorations topographiques
Un colorant consiste souvent en une solution aqueuse contenant un composé portant des groupements chimiques chargés électriquement (fonctions anioniques ou cationiques) et qui peut colorer une ou plusieurs substances de manière stable.
Constitué d'un groupement chromophore (couleur) et d'un groupement auxochrome (groupement ionisé): fixation permanente sur des groupements acides ou basiques des constituants cellulaires (à un pH donné).
Caractéristiques :
- non spécifique d'un type de molécule ;
- donne une vue d'ensemble du tissu : renseigne sur la répartition, l'architecture et la structure des cellules ;
- résulte de l'action conjuguée d'un colorant acide (éosine) et d'un colorant basique (hémalun, bleu de méthylène).
Les substances acides (chargées -) de la cellule sont colorées par un colorant basique (chargé +), les substances basiques (chargées +) de la cellule par un colorant acide (chargé -).[pas clair]
Cette coloration colore un type de charge. On peut voir la morphologie de la cellule (forme), la position du noyau et sa forme. Ainsi, on peut déterminer le nombre de types cellulaires dans le tissu et la structure de ce tissu (cellules collées ou non).
Colorations histochimiques
Réactions rédox agissant sur des macromolécules, renseignent sur la constitution chimique de la cellule. Exemples :
Types de tissu révélés par coloration
Colorants acides
Les colorants acides ont une bonne affinité avec les substances alcalines, ils mettent en évidence des tissus basiques donc acidophiles.
- éosine (rouge)
- acide picrique (jaune)
- vert rapide
- orange G
- fuchsine acide (rouge)
- érythrosine [rouge]
Colorants basiques
Ils mettent en évidence des tissus acides, dits basophiles.
- hématoxyline (rouge)
- safranine (orange)
- carmin (rouge)
- bleu de méthylène
- thionine (bleu)
- fuchsine basique (rouge)
- vert d'iode[2] (vert)
De nombreuses colorations utilisent deux colorants : carmino-vert ou carmin vert d'iode (technique de double coloration en rose et vert)[3], éosine-bleu de méthylène …
Colorations argentiques
Certains tissus fixent l'argent. On parle de structures argentaffines ou de structures argyrophiles.
Coloration aux sels de Chrome
On met ainsi en évidence les tissus chromaffines, comme la médullo-surrénale.
Différentes méthodes de coloration
Plusieurs méthodes de coloration ont été mises au point pour révéler certaines structures. En voici quelques-unes répertoriées dans un tableau :
| Coloration | Composants | Cytoplasme | Collagène | Élastine | ADN | Autres | pH |
|---|---|---|---|---|---|---|---|
| Hématoxyline et éosine | Hématoxyline et éosine | rouge/rose | rouge/rose | rouge | bleu/noir | ? | |
| van Gieson | Hématoxyline, fuchsine acide et acide picrique | jaune | rouge | - (parfois rose) | noir | ? | |
| Goldner | Hématoxyline, fuchsine acide, Light Green SF | rouge | vert | - | noir | ? | |
| Elastica | Résorcine, fuchsine | brun-violet | |||||
| Azan | Azocarmine, bleu aniline | rouge | bleu | - (parfois rose) | rouge | ||
| Ladewig | Orange G, bleu de méthylène, fuchsine acide, hématoxyline | rouge (érythrocyte orange) | bleu | noir | |||
| Sudan III | Colorant soluble dans les lipides | Lipides en orange | |||||
| PAS | Hématoxyline, acide periodique, réactif de Schiff | bleu | Polysaccharides : violet-rouge | ||||
| Nissl | Thionine (ou toluidine ou violet de crésyl) | bleu (avec le RE) | bleu | ||||
| Coloration de May-Grünwald Giemsa | Éosine, bleu de méthylène et azur de methylène | rouge chez les GR, bleu chez les lymphocytes | bleu |
Colorations utilisées en microbiologie
Même s'il ne s'agit pas directement de colorations histologiques, ces méthodes visent à distinguer entre plusieurs types cellulaires. Elles utilisent aussi les mêmes types de colorants :
- la coloration de Gram, pour déterminer des types de cellules procaryotes ;
- la coloration de Ziehl-Neelsen révèle les mycobactéries.
Colorations au microscope électronique
Pour permettre l'observation des organites en microscopie électronique, des métaux lourds comme le plomb, l'uranium ou le tungstène sont utilisés. Les régions à colorer deviennent sombres car peu d'électrons parviennent à traverser ces métaux.
Notes et références
- Roger Prat, Expérimentation en biologie et physiologie végétales, Editions Quae, , p. 64.
- Triphénylméthane du groupe des rosanilines.
- Technique classique des coupes botaniques en France, elle utilise le carmin aluné qui colore les noyaux cellulaires et la paroi strictement cellulosique, en combinaison avec le vert d'iode, colorant qui a une affinité plus prononcée vis-à-vis des tissus ayant des cellules aux parois cutinisées, lignifiées et subérifiées. Cette technique d'une grande simplicité d'utilisation a le désavantage de détruire le contenu cellulaire mais elle apporte un complément d’information par la coloration spécifique de ces parois selon leur composition. Elle est appelée coloration carmino-vert de Mirande car elle a été mise au point en 1920 par Robert Mirande, professeur à la Faculté des Sciences de Grenoble (R. Mirande, « Sur le carmin aluné et son emploi, combiné avec celui du vert d'iode, en histologie végétale », Comptes rendus de l'Académie des sciences, Vol. 170, 1920, p. 197-199). D'après Georges Deflandre, Microscopic pratique, P. Lechevalier, , p. 106.
Articles connexes
- Portail de la biologie cellulaire et moléculaire
- Portail de la physiologie