Couplage de Castro-Stephens
La réaction de Castro-Stephens est une réaction de couplage croisé entre un acétylure de cuivre(I) et un halogénure d'aryle, formant un alcyne disubstitué et un halogénure de cuivre(I).
 Réaction de Castro-Stephens
Réaction de Castro-Stephens
La réaction a été découverte en 1963 par les chimistes R.D. Stephens et C.E. Castro[1],[2], de l'université de Californie (Riverside), et constitue un outil pour la synthèse de composés organiques. La réaction possède des similarités avec la synthèse plus ancienne de Rosenmund–von Braun (1916) entre des halogénures d'aryle et le cyanure de cuivre(I), et a été modifiée en 1973 pour donner le couplage de Sonogashira par addition d'un catalyseur de palladium et préparation de l'organocuprate in situ, permettant l'utilisation catalytique du cuivre.
Une réaction typique est le couplage de l'iodobenzène avec le phénylacétylure de cuivre, dans la pyridine à reflux, produisant le diphénylacétylène :
 Application du couplage de Castro–Stephens avec l'iodure de phényle.
Application du couplage de Castro–Stephens avec l'iodure de phényle.
Contrairement au couplage de Sonogashira, le couplage de Castro-Stephens peut produire des composés hétérocycliques lorsqu'un groupe nucléophile se situe en ortho de l'halogène, bien que ceci nécessite typiquement l'usage du DMF comme solvant[3],[4].
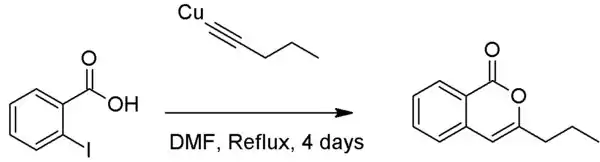 Application du couplage de Castro-Stephens coupling avec l'acide o-iodobenzoic pour produire une isocoumarine.
Application du couplage de Castro-Stephens coupling avec l'acide o-iodobenzoic pour produire une isocoumarine.
Références
- (en) R. D. Stephens et C. E. Castro, « The Substitution of Aryl Iodides with Cuprous Acetylides. A Synthesis of Tolanes and Heterocyclics », J. Org. Chem., vol. 28, no 12, , p. 3313–3315 (DOI 10.1021/jo01047a008)
- D. C. Owsley et C. E. Castro, Organic Syntheses, Coll. vol. 6, p. 916 (1988) ; vol. 52, p. 128 (1972), orgsyn.org
- (en) G. Batu, R. Stevenson, « Synthesis of natural isocoumarins, artemidin and 3-propylisocoumarin », J. Org. Chem., vol. 45, no 8, , p. 1532–1534 (DOI 10.1021/jo01296a044)
- (en) C. E. Castro, R. Havlin, V. K. Honwad, A. Malte et Steve Moje, « Copper (I) Substitutions. Scope and Mechanism of Cuprous Acetylide Substitutions », J. Am. Chem. Soc., vol. 91, no 23, , p. 6464–6470 (DOI 10.1021/ja01051a049)
- Portail de la chimie