Organocuprate
Un organocuprate est un composé organométallique contenant une liaison carbone-cuivre. Les organocuprates sont une importante classe de réactifs en chimie organique.


Historique
Le premier organocuprate est l'acétylure de cuivre(I) Cu2C2 (Cu-C≡C-Cu), un explosif synthétisé par Rudolf Christian Böttger en 1859 en faisant circuler de l'acétylène gazeux dans une solution de chlorure de cuivre(I)[1] :
- C2H2 + 2 CuCl → Cu2C2 + 2 HCl.
Henry Gilman (en) synthétise le méthylcuivre en 1936. En 1941, Kharash découvre que la réaction entre un réactif de Grignard et la cyclohexénone en présence de Cu(I) résulte d'une addition-1,4 au lieu d'une addition-1,2[2]. En 1952, Gilman travaille sur le premier dialkylcuivre. Dans les années 1960, on fabrique des complexes d'alcènes et de CO en présence de cuivre(I).
Propriétés
Les organocuprates sont très réactifs avec le dioxygène et l'eau, formant l'oxyde de cuivre(I) et tendent à être instables thermiquement. Comme la plupart des cuprates sont des sels, ils sont en général insolubles dans les solvants apolaires. Malgré ces problèmes, les organocuprates sont fréquemment synthétisés et consommés in situ, sans que l'on tente de les isoler. Ils sont très souvent utilisés en chimie organique comme agents alkylants car ils ont une plus grande tolérance vis-à-vis des groupes fonctionnels que les réactifs de Grignard ou les organolithiens correspondants. L'électronégativité du cuivre étant bien plus grande que celle des éléments du groupe 12 (zinc, cadmium, mercure), la nucléophilie du carbone qui en résulte est moins grande.
Le cuivre appartient aux éléments du groupe 11, comme l'argent et l'or et partage certaines de leurs propriétés. Son état d'oxydation peut être +1 ou +2 et ses intermédiaires peuvent avoir un état d'oxydation +3. Les alkylcuprates monovalents (RCu) sont des polymères mais forment les organocuprates lithiés (R2CuLi) ou « réactifs de Gilman » lorsqu'ils sont traités avec des organolithiens (RLi). Les organocuprates peuvent être stabilisés par complexation avec divers ligands tels que les organophosphines (R3P), les thioéthers (R2S) ou les cyanures (CN−).
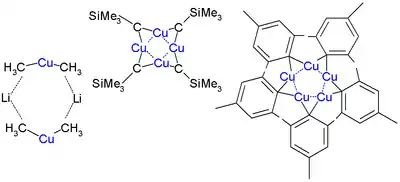
Les complexes de cuprates forment des aggrégats compliqués aussi bien sous forme cristalline qu'en solution. Le diméthylcuprate de lithium se dimérise dans le diéthyléther sous la forme d'un cycle à huit où deux atomes de lithium sont coordonnés entre les deux groupes méthyle. De façon similaire, le diphénylcuprate de lithium forme un dimère éthéré, [{Li(OEt2)}(CuPh2)]2, à l'état solide[3] :
En 1972, Lappert est le premier à déterminer la structure cristalline d'un organocuprate, CuCH2SiMe3. Ce composé est relativement stable à cause des groupes triméthylsilyle encombrants, qui lui assurent une protection stérique. C'est un tétramère formant un cycle à huit avec des liaisons Cu-C alternées. De plus, les quatre atomes de cuivre forme un cycle Cu4 plan à base de liaisons à trois centres et deux électrons. La liaisons cuivre-cuivre est de 242 pm contre 256 pm pour le cuivre solide. Dans le pentamésitylpentacuprate un cycle de cuivre à cinq se forme et le pentafluorophénylcuprate est un tétramère[4].
Intermédiaires Cu(III)
Dans de nombreuses réactions organométalliques impliquant le cuivre, le mécanisme réactionnel passe par un intermédiaire du cuivre à l'état d'oxydation +3. Par exemple, lors d'éliminations réductrices, le Cu(III) est réduit en Cu(I). Cependant, les composés du Cu(III) sont plutôt rares en chimie, et jusqu'à récemment, l'existence d'organocuivre(III) a été sujet à caution. En 2007, on a obtenu la première preuve spectroscopique de la présence d'un Cu(III) dans une addition conjuguée d'un réactif de Gilman sur une énone[5] :
Dans une expérience RMN dite à injection rapide à −100 °C, le réactif de Gilman Me2CuLi (stabilisé par l'iodure de lithium) fut introduit dans un milieu de cyclohexénone (1) permettant de détecter un complexe pi du cuivre — alcène (2). Par addition successive de cyanure de triméthylsilyle l'espèce Cu(III) (3) est formée (stable indéfiniment à cette température), et en augmentant la température jusqu'à −80 °C, l'addition conjuguée produit (4). Selon une expérience d'accompagnement in silico [6], l'intermédiaire Cu(III) a une géométrie plan carré avec le groupe cyano en position cis par rapport au groupe méthinecyclohexényle et anti-parallèle au proton du groupe méthine. Avec d'autres ligands que le groupe cyano, cette étude prédit des composés du Cu(III) stables à température ambiante.
Synthèse
Les halogénures de cuivre réagissent avec les organolithiens pour former des organocuprates. Le phénylcuivre est préparé par réaction entre le phényllithium avec le bromure de cuivre(I) dans le diéthyléther. La réaction avec un second équivalent de R-Li sur le R-Cu donne le diorganocuprate lithié. Les halogénures de cuivre peuvent aussi réagir avec les organomagnésiens. Le pentamesitylpentacuivre est préparé à partir du bromure de mésityl magnésium et du chlorure de cuivre(I).
Des sels de cuivre additionnés sur un alcyne terminal forment un acétylure de cuivre. Le (cyclopentadiényl)cuivre triéthylphosphine (η5-C5H5)Cu(Et3P), un complexe en tabouret de piano, peut être préparé par réaction entre l'oxyde de cuivre(II) CuO, le cyclopentadiène C5H5 et la triéthylphosphine (en) (C2H5)3P (généralement notée Et3P) dans le pentane à reflux.
Réactions
Les réactions impliquant les organocuprates peuvent être classifiées selon différents types.
Réactions de substitution
Les réactions de substitution des organocuprates lithiés R2CuLi sur les halogénoalcanes R'-X donnent l'alkylcuivre R-Cu, le produit de couplage R-R' et l'halogénure de lithium Li-X. Le mécanisme réactionnel est basé sur une attaque nucléophile, plus exactement une addition oxydante de l'halogénure d'alkyle sur le Cu(I), l'oxydant en intermédiaire Cu(III) plan, suivie par une élimination réductrice, l'attaque nucléophile étant l'étape cinétiquement déterminante. Dans le cas d'une substitution par un iodure, un mécanisme de transfert monoélectronique a été proposé.
La réaction fonctionne avec beaucoup d'électrophiles. L'ordre de réactivité, du plus réactif au moins réactif est à peu près celui-ci : chlorure d'acyles[7] > aldéhydes > tosylates ~ époxydes > iodoalcanes > bromoalcanes > chloroalcanes > cétones > esters > nitriles >> alcènes.
Réactions de couplage
Les organocuprates peuvent réagir par couplage oxydant, réducteur ou neutre.
Le couplage oxydant peut être le couplage de l'acétylure de cuivre avec des alcynes conjugués comme dans le couplage de Glaser (utilisé par exemple dans la synthèse du cyclooctadécanonaène) ou avec des halogénures d'aryle dans le couplage de Castro-Stephens.
Le couplage réductif peut être le couplage entre un halogénure d'aryle avec un équivalent w en cuivre métallique comme dans la réaction d'Ullmann. Un exemple de couplage croisé utilisé de nos jours est la réaction dite de couplage décarboxylant : une quantité catalytique de Cu(I) déplace un groupe carboxyle formant un intermédiaire arylcuivre (ArCu). Simultanément un catalyseur au palladium convertit un bromure d'aryle en intermédiaire organopalladique (Ar'PdBr) et un biaryle est formé par transmétallation[8],[9].
Le couplage neutre peut être le couplage entre un alcyne terminal et halogénoalcyne en présence d'un sel de cuivre(I) comme dans le couplage de Cadiot-Chodkiewicz. Le couplage thermique de deux organocuprates est aussi possible.
Voir aussi la synthèse du PPO.
Addition conjuguée
Il est possible d'effectuer une addition conjuguée entre une énone et un organocuprate. Dans une situation similaire, si un organomagnésien (RMgX) était utilisé, la réaction serait une addition 1,2[10]. Le mécanisme de l'addition 1,4 du cuprate sur les énones passe par une addition nucléophile des espèces Cu(I) sur le carbone en β de la fonction alcène pour former un intermédiaire Cu(III), suivie par une élimination réductrice en Cu(I)[11]. Dans l'exemple ci-dessous, (réaction entre le bromure de méthylmagnésium et l'isophorone), les produits de réaction ont été analysés en fonction de l 'ajout ou non de chlorure de cuivre au milieu réactionnel[2]. Le schéma ci-dessous présente le cas en présence de CuCl :
Sans le sel de cuivre, les produits majoritaires sont l'alcool B (42 %) formé par addition nucléophile du groupe carbonyle et le diène C (48 %) résultant d'une réaction de déshydratation. En présence de sel de cuivre, le produit majoritaire est l'adduit 1,4 A (82 %).
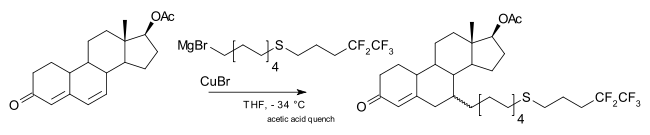
Il est également possible d'effectuer des additions 1,6, comme dans la production commerciale en une étape du fulvestrant [12] :
Carbocupration
La carbocupration est une addition nucléophile d'un organocuprate (R-Cu) sur l'acétylène ou un sur un alcyne terminal. Le produit de la réaction est un alcénylcuivre (RC=C-Cu)[13].C'est un cas particulier de carbométallation appelé aussi réaction de Normant[14].
Notes et références
- (en) R. C. Böttger, « Ueber die Einwirkung des Leuchtgases auf verschiedene Salzsolutionen, insbesondere auf eine ammoniakalische Kupferchlorürlösung », Annalen, vol. 109, no 3, , p. 351 (DOI 10.1002/jlac.18591090318)
- (en) Kharasch, M. S et Tawney, P. O, « Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide », J. Am. Chem. Soc., vol. 63, , p. 2308 (DOI 10.1021/ja01854a005)
- (en) N. P. Lorenzen, E. Weiss, « Synthesis and Structure of a Dimeric Lithium Diphenylcuprate:[{Li(OEt)2}(CuPh2)]2 », Angew. Chem. Int. Ed., vol. 29, no 3, , p. 300–302 (DOI 10.1002/anie.199003001)
- A. Cairncross et al., Pentafluorophenylcopper tetramer, a reagent for synthesis of fluorinated aromatic compounds. [Copper, tetrakis(pentafluorophenyl)tetra], Org. Synth. 6, coll. « vol. », Vol. 59, p.122 (1979)
- (en) Steven H. Bertz, Stephen Cope, Michael Murphy, Craig A. Ogle et Brad J. Taylor, « Rapid Injection NMR in Mechanistic Organocopper Chemistry. Preparation of the Elusive Copper(III) Intermediate1 », Journal of the American Chemical Society, vol. 129, no 23, , p. 7208–9 (PMID 17506552, DOI 10.1021/ja067533d)
- (en) Haipeng Hu et James P. Snyder, « Organocuprate Conjugate Addition: The Square-Planar "CuIII" Intermediate », Journal of the American Chemical Society, vol. 129, no 23, , p. 7210–1 (PMID 17506553, DOI 10.1021/ja0675346)
- Voir par exemple : G. H. Posner et al., Secondary and tertiary alkyl ketones from carboxylic acid chlorides and lithium phenylthio(alkyl)cuprate reagents: tert-butyl phenyl ketone. [1-Propanone, 2,2-dimethyl-1-phenyl], Org. Synth. 6, coll. « vol. », ; Vol. 55, p.122 (1976)
- (en) L. J. Goossen, G Deng et LM Levy, « Synthesis of Biaryls via Catalytic Decarboxylative Coupling », Science, vol. 313, no 5787, , p. 662–4 (PMID 16888137, DOI 10.1126/science.1128684, Bibcode 2006Sci...313..662G)
- Reagents: base potassium carbonate, solvent NMP, catalysts palladium acetylacetonate, Copper(I) iodide, MS stands for molecular sieves, ligand phenanthroline
- Voir par exemple : Organic Syntheses, Coll. vol. 9, p. 328 (1998) ; vol. 72, p. 135 (1995), lire en ligne.
- (en) Eiichi Nakamura et Seiji Mori, « Wherefore Art Thou Copper? Structures and Reaction Mechanisms of Organocuprate Clusters in Organic Chemistry », Angewandte Chemie, vol. 39, no 21, , p. 3750–3771 (PMID 11091452, DOI 10.1002/1521-3773(20001103)39:21<3750::AID-ANIE3750>3.0.CO;2-L)
- Fulvestrant: From the Laboratory to Commercial-Scale Manufacture Eve J. Brazier, Philip J. Hogan, Chiu W. Leung, Anne O’Kearney-McMullan, Alison K. Norton, Lyn Powell,Graham E. Robinson, and Emyr G. Williams Organic Process Research & Development 2010, 14, 544–552 DOI:10.1021/op900315j
- For an example: Organic Syntheses, Coll. vol. 7, p. 236 (1990) ; vol. 64, p. 1 (1986) lire en ligne
- (en) J. Normant et M. Bourgain, « Synthese stereospecifique and reactivite d' organocuivreux vinyliques », Tetrahedron Letters, vol. 12, no 27, , p. 2583 (DOI 10.1016/S0040-4039(01)96925-4)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Organocopper compound » (voir la liste des auteurs).
Voir aussi
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * |
Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * |
Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, mais pas d'usage courant | Liaison inconnue / non évaluée |
- Portail de la chimie