Complexe en tabouret de piano
Un complexe en tabouret de piano, également dit demi-sandwich, est un complexe organométallique présentant un ligand organique cyclique lié par hapticité à un centre métallique MLn, où L est un ligand monodentate et n un entier naturel non nul.
Exemples
On connaît plusieurs milliers de complexes en tabouret de piano[1].
Parmi les exemples notoires, apparaît le (cyclobutadiène)fer tricarbonyle (η4-C4H4)Fe(CO)3 et le trichlorure de (cyclopentadiényl)titane (η5-C5H5)TiCl3. Des produits commerciaux comme le (cyclopentadiényl)cobalt dicarbonyle (η5-C5H5)Co(CO)2, utilisé pour la synthèse de pyridines substituées, et le (méthylcyclopentadiényl)manganèse tricarbonyle (MMT) (η5-CH3C5H4)Mn(CO)3, utilisé pour améliorer l'indice d'octane de l'essence, sont industriellement importants.
L'iodure de (cyclopentadiényl)fer dicarbonyle (η5-C5H5)Fe(CO)2I est un exemple dont le métal est lié à des ligands différents (en l'occurrence, deux carbonyles et un iodure), tandis que le (cycloheptatriène)molybdène tricarbonyle (η6-C7H8)Mo(CO)3 est un précurseur de complexes du cation aromatique tropylium [C7H7]+.
- Exemples de complexes en tabouret de piano
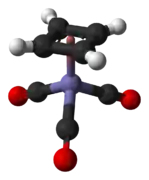
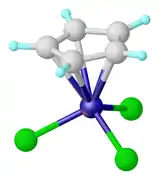
2new.svg.png.webp)
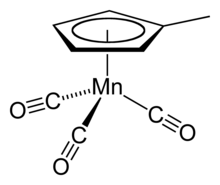
2I-2D-skeletal.png.webp)
3.png.webp)
Complexes à ligand cyclopentadiényle (η5-C5H5)
Il existe de nombreux complexes en tabouret de piano ayant un ligand cyclopentadiényle (η5-C5H5). Ce sont par exemple les complexes (η5-C5H5)V(CO)4, (η5-C5H5)Cr(CO)3H, (η5-CH3C5H4)Mn(CO)3, (η5-C5H5)Cr(CO)3H, [(η5-C5H5)Fe(CO)3]+, (η5-C5H5)V(CO)4I et [(η5-C5H5)Ru(NCMe)3]+.
Les ligands cyclopentadiényle encombrants tels que le [1,2,4-(tert-Bu)3C5H2]− forment des complexes aux structures inhabituelles[2].
Complexes à ligand benzénique (η6-C6H6)
Ce sont des complexes de la forme (η6-C6H6)ML3 où M = Cr(I), Mo, W, Mn(I) et Re(I), et L = CO typiquement. Les complexes en tabouret de piano à (η6-C6H6) sont des espèces stables à 18 électrons ayant des applications chimiques et matérielles variées. Les premières études sur le (benzène)chrome tricarbonyle (η6-C6H6)Cr(CO)3 ont été menées par Natta, Ercoli et Calderazzo[3] et Fischer et Öfele[4],[5] tandis que sa structure a été déterminée par Corradini et Allegra à la fin des années 1950[6]. Les données par cristallographie aux rayons X indiquent que le plan du cycle benzénique est pratiquement parallèle au plan défini par les atomes d'oxygène des ligands carbonyle.
Complexes du chrome et du manganèse(I) à ligand benzénique
Les complexes de type benzène métal tricarbonyle (η6-C6H6)M(CO)3, où M = Cr ou Mn(I), sont généralement produits en chauffant le carbonyle de métal approprié avec du benzène C6H6. Il est également possible de procéder par carbonylation de composés sandwich bis(arène) (η6-C6H6)2M avec le carbonyle de métal M(CO)n correspondant : cette méthode peut s'avérer plus appropriée pour les arènes ayant des substituants sensibles à la chaleur[7].
Réactivité de (η6-C6H6)Cr(CO)3
Le ligand benzène C6H6 du complexe (benzène)chrome tricarbonyle (η6-C6H6)Cr(CO)3 peut être déprotoné[8]. Les organolithiens forment par exemple des adduits comportant des ligands cyclopentadiényle C5H5. Une oxydation supplémentaire entraîne la formation d'un benzène substitué[9],[10]. On a pu montrer que l'oxydation de l'atome de chrome par le diiode I2 et d'autres réactifs iodés favorise l'échange de ligands arène, mais l'intermédiaire d'iodure de chrome n'a pas été caractérisé[11].
3_Reaction_with_RLi.png.webp)
Les complexes de (benzène)chrome tricarbonyle présentent des substitutions nucléophiles aromatiques ciné et télé[12], c'est-à-dire une substitution adjacente à l'atome de carbone du groupe partant dans le premier cas, et au-delà de la position adjacente dans le second. Les procédés de ce type font intervenir le (benzène)chrome tricarbonyle avec un réactif alkyllithium avec traitement subséquent par un acide pour l'addition d'un nucléophile au cycle benzénique en position ortho (ciné), méta ou para (télé) du carbone ipso.
chromiumtricarbonyl_electrophile_nucleophilic_carbonylation.png.webp)
Le n-butyllithium permet la lithiation du ligand benzénique en raison de l'acidité accrue de ce dernier. L'organolithien qui en résulte peut à son tour intervenir comme nucléophile dans diverses réactions, comme avec le chlorure de triméthylsilyle (CH3)3SiCl :
chromiumtricarbonyl_lithiation_TMS.png.webp)
Le (benzène)chrome tricarbonyle est un catalyseur utile pour l'hydrogénation des 1,3-diènes ; il n'hydrogène pas les doubles liaisons isolées. Divers autres ligands ont été utilisés hormis le benzène[13]. Il est possible d'employer des ligands peu coordinants pour faciliter l'échange des ligands et donc la vitesse de substitution des complexes (η6-C6H6)M(CO)3[7]. De tels complexes ont été incorporés à des matériaux poreux à surface spécifique élevée[14].
Les complexes (benzène)métal tricarbonyle sont étudiés comme modèles pour l'interaction des carbonyles de métal avec le graphène et les nanotubes de carbone[15]. On a pu montrer que la présence de M(CO)3 sur des matériaux à réseau de liaisons π étendu en améliore la conductivité électrique[16].
Réactivité de (η6-C6H6)Mn(CO)3+
Les tricarbonyles d'arènes de manganèse(I) et de rhénium(I) sont cationiques et présentent ainsi une réactivité accrue envers les nucléophiles. L'arène modifié peut être récupéré du métal après addition nucléophile[17],[18].
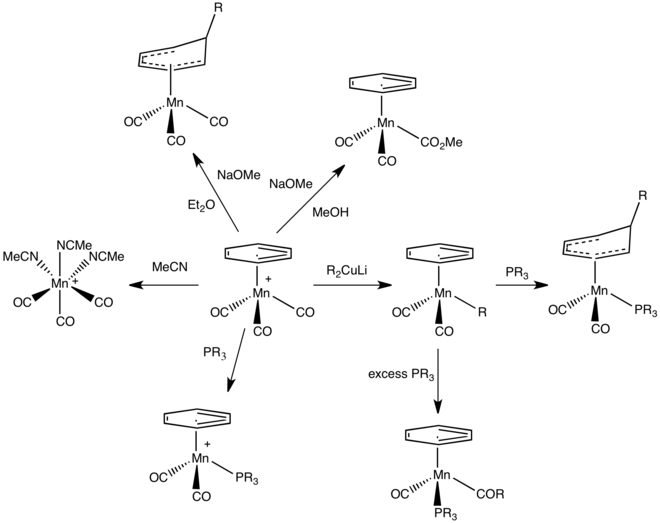
Complexes du ruthénium à ligand benzénique
Les complexes à ruthénium(II) en tabouret de piano tels que le dimère de dichlorure de (cymène)ruthénium [(η6-cymène)RuCl(µ-Cl)]2 ont été étudiés essentiellement comme catalyseurs pour l'hydrogénation par transfert[19]. Ces complexes portent trois sites de coordination susceptibles d'être substitués, tandis que le ligand arène est étroitement lié et protège le métal contre l'oxydation en Ru(III). On les obtient par réaction de RuCl3·xH2O avec des 1,3-cyclohexadiènes[20]. Ils font également l'objet de recherches comme médicaments anticancéreux[21].

Le (η6-C6H6)RuCl2 peut facilement échanger un ligand par clivage des ponts chlorure, ce qui fait de ce complexe un précurseur polyvalent de dérivés en tabouret de piano du Ru(II)[16].
Notes et références
- (en) Christoph Elschenbroich, Organometallics, Wiley, 2006. (ISBN 978-3-527-29390-2)
- (en) Hanan E. Abdou, Ahmed A. Mohamed, John P. Fackler, Mukunda M. Ghimire, Mohammad A. Omary, David Schilter, Thomas B. Rauchfuss, Jason A. Denny, Marcetta Y. Darensbourg, Mahbod Morshedi, Peter V. Simpson, Bandar Babgi, Katy A. Green, Graeme J. Moxey, Mark S. Jennaway, Marie P. Cifuentes, Mark G. Humphrey, Samantha G. Eaves, Paul J. Low, Kendric J. Nelson, Joel S. Miller, Toby J. Woods, Kim R. Dunbar, Timothy C. Johnstone, Pavel Starha, Abraha Habtemariam, Sergey S. Zalesskiy, Valentine P. Ananikov, Alan J. Reay, Ian J. S. Fairlamb, William E. Geiger, Jeremy R. Zink, Michael J. Shaw, Jared S. Silvia, Christopher C. Cummins, Daniel J. Mindiola, Peter L. Damon, Trevor W. Hayton, Daniel J. Mindiola, Matthias Reiners, Nico Ehrlich, Marc D. Walter, Alexandre Herve, Chadwick D. Sofield et Richard A. Andersen, « Synthesis of selected transition metal and main group compounds with synthetic applications », Inorganic Syntheses, vol. 37, (DOI 10.1002/9781119477822.ch8, S2CID 105376454, lire en ligne)
- (en) G. Natta, R. Ercoli et F. Calderazzo, « (η-C6H6)Cr(CO)3 », La Chimica e l'Industria, vol. 40, no 12, , p. 1003-1007
- (de) Ernst Otto Fischer, Karl Öfele, Hans Essler, Walter Fröhlich, Jens Peter Mortensen et Walter Semmlinger, « Über Aromatenkomplexe von Metallen, XXIV. Über gemischte Tricarbonylkomplexe des Chroms, Molybdäns und Wolframs mit Benzol und seinen Derivaten », Chemische Berichte, vol. 91, no 12, , p. 2763-2772 (DOI 10.1002/cber.19580911231, lire en ligne)
- (de) Ernst Otto Fischer et Karl Öfele, « Über Aromatenkomplexe von Metallen, XIII Benzol-Chrom-Tricarbonyl », Chemische Berichte, vol. 90, no 11, , p. 2532-2535 (DOI 10.1002/cber.19570901117, lire en ligne)
- (en) Paolo Corradini et Giuseppe Allegra, « X-ray détermination of the strcture of tricarbonylchromium-benzene », Journal of the American Chemical Society, vol. 81, no 9, , p. 2271-2272 (DOI 10.1021/ja01518a065, lire en ligne)
- (en) John Hartwig, Organotransition Metal Chemistry, University Science Books, 2010, p. 443. (ISBN 978-1-891389-53-5)
- (en) R. Crabtree, (2009). The Organometallic Chemistry of Transition Metals, 5e éd., John Wiley & Sons, 2009, p. 145. (ISBN 978-0-470-25762-3)
- (en) Didier Astruc, Organometallic Chemistry and Catalysis, Springer-Verlag, 2007, p. 243–246. (ISBN 978-3-540-46128-9)
- (en) James W. Herndon et Stéphane Laurent, « (η6-Benzene)tricarbonylchromium », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rb025.pub2, lire en ligne)
- (en) J. J. Harrison, « Iodine-catalyzed arene exchange of (arene)tricarbonylchromium(0) complexes », Journal of the American Chemical Society, vol. 106, no 5, , p. 1487-1489 (DOI 10.1021/ja00317a052, lire en ligne)
- (en) Jean-Pierre Djukic, Francoise Rose-Munch, Eric Rose, Frederic Simon et Yves Dromzee, « Nucleophilic Aromatic Substitutions: Hydrodealkoxylation, Hydrodehalogenation, and Hydrodeamination of Alkoxy, Halogeno, and Amino (η6-Arene)tricarbonylchromium Complexes », Organometallics, vol. 14, no 4, , p. 2027-2038 (DOI 10.1021/om00004a065, lire en ligne)
- (en) Ian P. Clark, Michael W. George, Gregory M. Greetham, Emma C. Harvey, Conor Long, Jennifer C. Manton et Mary T. Pryce, « Photochemistry of (η6-Arene)Cr(CO)3 (Arene = Methylbenzoate, Naphthalene, or Phenanthrene) in n-Heptane Solution: Population of Two Excited States Following 400 nm Excitation As Detected by Picosecond Time-Resolved Infrared Spectroscopy », The Journal of Physical Chemistry A, vol. 115, no 14, , p. 2985-2993 (PMID 21413775, DOI 10.1021/jp112168u, Bibcode 2011JPCA..115.2985C, lire en ligne)
- (en) Takashi Kamegawa, Masakazu Saito, Takahiro Sakai, Masaya Matsuoka et Masakazu Anpo, « Characterization of phenylene-bridged hybrid mesoporous materials incorporating arenetricarbonyl complexes (–C6H4Me(CO)3–; Me = Cr, Mo) and their catalytic activities », Catalysis Today, vol. 181, no 1, , p. 14-19 (DOI 10.1016/j.cattod.2011.10.019, lire en ligne)
- (en) Michael A. Duncan, « Structures, energetics and spectroscopy of gas phase transition metal ion–benzene complexes », International Journal of Mass Spectrometry, vol. 272, nos 2-3, , p. 99-118 (DOI 10.1016/j.ijms.2008.01.010, lire en ligne)
- (en) Bruno Therrien, « Functionalised η6-arene ruthenium complexes », Coordination Chemistry Reviews, vol. 253, nos 3-4, , p. 493-519 (DOI 10.1016/j.ccr.2008.04.014, lire en ligne)
- (en) P. J. C. Walker et R. J. Mawby, « Patterns of nucleophilic attack on tricarbonyl π-arene complexes of manganese(I) », Inorganica Chimica Acta, vol. 7, , p. 621-625 (DOI 10.1016/S0020-1693(00)94897-7, lire en ligne)
- (en) M. Brookhart, Allan R. Pinhas et Alexander Lukacs, « Reaction of lithium dimethylcuprate with C6H6Mn(CO)3+. Observation of methyl group migration from manganese to the arene ring in C6H6(CO)2MnMe », Organometallics, vol. 1, no 12, , p. 1730-1731 (DOI 10.1021/om00072a040, lire en ligne)
- (en) Takao Ikariya et A. John Blacker, « Asymmetric Transfer Hydrogenation of Ketones with Bifunctional Transition Metal-Based Molecular Catalysts », Accounts of Chemical Research, vol. 40, no 12, , p. 1300-1308 (PMID 17960897, DOI 10.1021/ar700134q, lire en ligne)
- (en) M. A. Bennett, T.-N. Huang, T. W. Matheson, A. K. Smith, Steven Ittel et William Nickerson, « 16. (η6-Hexamethylbenzene)Ruthenium Complexe », Inorganic Syntheses, vol. 21, (DOI 10.1002/9780470132524.ch16, lire en ligne)
- (en) Pieter C. A. Bruijnincx et Peter J. Sadler, « Controlling platinum, ruthenium, and osmium reactivity for anticancer drug design », Advances in Inorganic Chemistry, vol. 61, , p. 1-62 (PMID 21258628, PMCID 3024542, DOI 10.1016/S0898-8838(09)00201-3, lire en ligne)
- Portail de la chimie