(Cyclobutadiène)fer tricarbonyle
Le (cyclobutadiène)fer tricarbonyle est un complexe organoferrique (en) de formule chimique (η4-C4H4)Fe(CO)3. Il s'agit d'un solide jaune, soluble dans les solvants organiques, utilisé en chimie organique comme précurseur du cyclobutadiène, très instable à l'état libre[2]. Il présente une géométrie demi-sandwich dite « en tabouret de piano », avec des liaisons C–C longues de 142,6 pm[3]. Il a été préparé pour la première fois en 1965 à partir de 3,4-dichlorocyclobutène C4H4Cl2 et de nonacarbonyle de difer Fe2(CO)9[4],[5] :
| (Cyclobutadiène)fer tricarbonyle | |
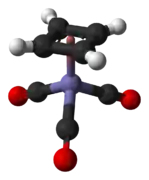
| |
| Structure tridimensionnelle du (cyclobutadiène)fer tricarbonyle | |
| Identification | |
|---|---|
| No CAS | |
| InChI | |
| Propriétés chimiques | |
| Formule | C7H4FeO3 |
| Masse molaire[1] | 191,95 ± 0,009 g/mol C 43,8 %, H 2,1 %, Fe 29,09 %, O 25,01 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Réactions
On réalise la décomplexation (en) oxydante du cyclobutadiène en traitant le complexe tricarbonyle avec du nitrate d'ammonium cérique (NH4)2Ce(NO3)6. Le cyclobutadiène libéré est piégé avec une quinone, qui agit comme diénophile[6].
Le (cyclobutadiène)fer tricarbonyle présente une certaine aromaticité, qui se révèle à travers certaines de ses réactions, pouvant être classées comme substitutions électrophiles aromatiques[7] :
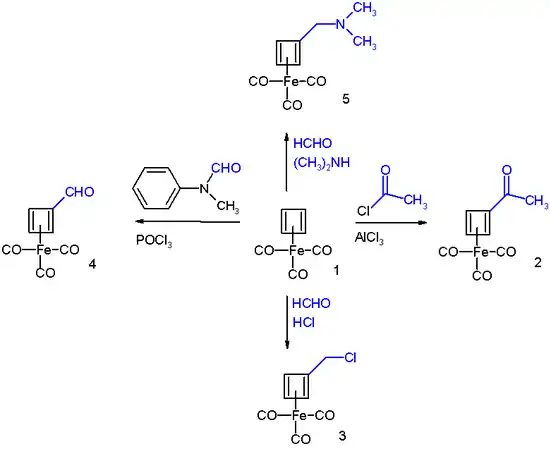
Il subit une acylation de Friedel-Crafts avec du chlorure d'acétyle CH3COCl et du chlorure d'aluminium AlCl3 pour donner le dérivé acétyle (2), il réagit avec du formaldéhyde HCHO et de l'acide chlorhydrique HCl pour donner le dérivé chlorométhylé (3), par une réaction de Vilsmeier-Haack avec de la N-méthylformanilide (de) et du trichlorure de phosphoryle POCl3 pour donner le dérivé aldéhyde (4), et par une réaction de Mannich pour donner le dérivé aminé (5). Le mécanisme réactionnel est celui d'une substitution électrophile aromatique :
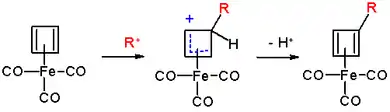
Complexes apparentés
Le (tétraphénylcyclobutadiène)fer tricarbonyle (η4-C4Ph4)Fe(CO)3 avait été préparé plusieurs années avant le (cyclobutadiène)fer tricarbonyle (η4-C4H4)Fe(CO)3 par réaction de pentacarbonyle de fer Fe(CO)5 et de diphénylacétylène C6H5–C≡C–C6H5[8].
Le (butadiène)fer tricarbonyle (en) (η4-C4H6)Fe(CO)3 est isoélectronique avec le (cyclobutadiène)fer tricarbonyle.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
-
(en) Dietmar Seyferth, « (Cyclobutadiene)iron Tricarbonyl – A Case of Theory before Experiment », Organometallics, vol. 22, no 1, , p. 2-20 (DOI 10.1021/om020946c, lire en ligne
 )
) - (en) Pierre D. Harvey, William P. Schaefer, Harry B. Gray, Denis F. R. Gilson et Ian S. Butler, « Structure of tricarbonyl(η4-cyclobutadienyl)iron(0) at -45 °C », Inorganic Chemistry, vol. 27, no 1, , p. 57-59 (DOI 10.1021/ic00274a013, lire en ligne)
- (en) G. F. Emerson, L. Watts et R. Pettit, « Cyclobutadiene- and Benzocyclobutadiene-Iron Tricarbonyl Complexes », Journal of the American Chemical Society, vol. 87, no 1, , p. 131-133 (DOI 10.1021/ja01079a032, lire en ligne)
-
(en) R. Pettit et J. Henery, « Cyclobutadieneiron Tricarbonyl », Organic Syntheses, vol. 50, , p. 21 (DOI 10.15227/orgsyn.050.0021, lire en ligne
 )
) - (en) L. Brener, J. S. McKennis et R. Pettit, « Cyclobutadiene in Synthesis: endo-Tricyclo[4.4.0.02,5]deca-3,8-diene-7,10-dione », Organic Syntheses, vol. 55, , p. 43 (DOI 10.15227/orgsyn.055.0043, lire en ligne)
- (en) J. D. Fitzpatrick, L. Watts, G. F. Emerson et R. Pettit, « Cyclobutadieneiron Tricarbonyl. A New Aromatic System », Journal of the American Chemical Society, vol. 87, no 14, , p. 3254-3255 (DOI 10.1021/ja01092a050, lire en ligne)
- (en) R. P. Dodge et V. Schomaker, « Crystal Structure of Tetraphenylcyclobutadiene Iron Tricarbonyl », Nature, vol. 186, no 4727, , p. 798-799 (DOI 10.1038/186798b0, Bibcode 1960Natur.186..798D, lire en ligne)
- Portail de la chimie