Dégradation thermique d'un polymère
La dégradation thermique d'un polymère est une détérioration moléculaire de ce dernier due à l'élévation de température. Aux températures modérément élevées, les composants du polymère peuvent commencer à se briser (scission de la chaîne) et réagir les uns avec les autres pour modifier les propriétés du polymère. La dégradation thermique peut présenter une limite supérieure à la température de service des polymères autant que la possibilité de perte de propriétés. À moins d'une prévention convenable, une dégradation thermique importante peut se produire à des températures très inférieures à celles auxquelles une défaillance mécanique est susceptible de se produire.
Ce mécanisme est utilisé pour les boucliers thermiques fonctionnant jusqu'à des températures très élevées. Dans ce cas, outre l'aspect endothermique de la dégradation, la production de gaz procure une protection contre la diffusion de gaz chaud provenant de l'extérieur du matériau.
Effets
Les réactions chimiques impliquées dans la dégradation thermique conduisent à des changements des propriétés du polymère par rapport aux propriétés initialement spécifiées. La dégradation thermique implique généralement des modifications des grandeurs caractéristiques d'un polymère (masse molaire et distribution des masses molaires) et des changements de propriétés tels que la diminution de la ductilité et l'augmentation de la fragilité, le farinage, des changements de couleur, des fissures, une réduction générale de la plupart des autres propriétés physiques souhaitables[1].
Les produits de dégradation thermique peuvent comprendre un mélange complexe de composés, y compris, mais sans s'y limiter, le monoxyde de carbone, l'ammoniac, des amines aliphatiques, des cétones, des nitriles et le cyanure d'hydrogène, qui peuvent être inflammables, toxiques ou irritants. Les molécules spécifiques générées varient en fonction des additifs et des colorants utilisés, de la température, du temps d'exposition et d'autres facteurs environnementaux immédiats[2].
Polymères concernés
En général, la résistance à la dégradation thermique dépend de la composition chimique du polymère.
Les polymères à squelette essentiellement aromatique tels que les polysulfones, les polyimides, les polyamides aromatiques et les polyaryléthercétones possèdent une excellente résistance à la dégradation thermique et oxydative. Les polysiloxanes (silicones) sont aussi stables.
Les polymères contenant des groupes méthylène tels que le polypropylène (PP), les polyéthylènes (PE), le polychlorure de vinyle (PVC) et le polybutadiène sont sensibles à la dégradation thermique, même à température normale, et ne peuvent résister à la dégradation que grâce à l'ajout d'antioxydants.
Les polymères à carbone quaternaire (polyméthacrylate de méthyle ou PMMA, poly(α-méthylstyrène) ou PαMS, polyisobutylène ou PIB, etc.) ou le polyoxyméthylène (POM), sont pratiquement intransformables sans une stabilisation appropriée[3].
Étapes
La plupart des types de dégradation suivent un schéma de base similaire. Le modèle classique de dégradation thermique est celui d'un processus d'auto-oxydation qui implique les étapes majeures d'amorçage, de propagation et de terminaison.
Il faut noter que les polymères possèdent une nanoporosité qui les rend hydrophiles. La première étape pour un échantillon non préalablement séché est la désorption de l'eau, un mécanisme physique lent.
Amorçage
L'amorçage de la dégradation thermique implique la perte d'un atome d'hydrogène de la chaîne du polymère en raison de l'apport d'énergie provenant de la chaleur ou de la lumière. Cela crée un radical libre (R•) polymère très réactif et instable et un atome d'hydrogène avec un électron non apparié (H•).
Propagation
La propagation de la dégradation thermique peut impliquer une variété de réactions et l'une d'entre elles est où le radical libre (R•) réagit avec l'oxygène (O2) pour former un radical peroxy (ROO•) qui peut alors retirer un atome d'hydrogène d'une autre chaîne polymère pour former un hydroperoxyde (ROOH) et ainsi régénérer le radical libre (R•). L'hydroperoxyde peut ensuite se diviser en deux nouveaux radicaux libres, (RO•) + (•OH), qui continueront à propager la réaction à d'autres molécules de polymère. Le processus peut donc s'accélérer en fonction de la facilité avec laquelle l'hydrogène est éliminé de la chaîne polymère .
Terminaison
La terminaison de la dégradation thermique est obtenue en « nettoyant » les radicaux libres pour créer des produits inertes. Cela peut se produire naturellement en combinant des radicaux libres ou cela peut être aidé en ajoutant des stabilisants aux polymères.
Mécanismes
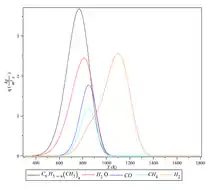
Dépolymérisation
Sous l'effet thermique, la fin de la chaîne de polymère part et forme un faible radical libre qui a une faible activité. Ensuite, selon le mécanisme de réaction en chaîne, le polymère perd ses unités monomères une par une. Cependant, la chaîne moléculaire ne change pas beaucoup en peu de temps. La réaction est montrée ci-dessous[5]. Ce processus est commun pour le polyméthacrylate de méthyle à partir de 180 °C[6].
~CH2-C(CH3)(COOCH3)-CH2-C*(CH3)(COOCH3)~ → ~CH2-C*(CH3)(COOCH3)~ + CH2=C(CH3)COOCH3
Scission aléatoire de la chaîne
La chaîne principale du polymère se désagrège au hasard, cela peut se produire à n'importe quelle position de la chaîne principale, en conséquence la masse molaire diminue rapidement. Au fur et à mesure, de nouveaux radicaux libres à haute réactivité se forment et des réactions de transfert intermoléculaire de chaîne peuvent se produire. Ce processus est commun pour le polyéthylène[7].
~CH2-CH2-CH2-CH2-CH2-CH2-CH2’~ → ~CH2-CH2-CH=CH2 + CH3-CH2-CH2’~ ou ~CH2’~ + CH2=CH-CH2-CH2-CH2-CH3
Élimination des groupes latéraux
Les groupes qui sont attachés latéralement à la chaîne principale sont tenus généralement par des liens qui sont plus faibles que les liens reliant les composants de la chaîne. Lorsque le polymère est chauffé, les groupes latéraux sont retirés de la chaîne avant d'être brisés en plus petits morceaux. Par exemple, le polychlorure de vinyle (PVC) se dégrade à partir de 175 °C en donnant notamment du chlorure d'hydrogène (HCl)[6].
~CH2-CH(Cl)-CH2-CH(Cl)~ → ~CH=CH-CH=CH~ + 2HCl
Condensation, réactions gaz-solide
À plus haute température se produisent des phénomènes de condensation par liaison -OH avec -CH2 et des réactions gaz-solide. Il s'agit d'une étape fortement endothermique.
Déshydrogénation, graphitation
La plupart des polymères produisent à partir de 1 000 K environ un résidu solide plus ou moins graphité avec perte d'hydrogène.
Prédiction
Pour l'étude de la dégradation d'un polymère à long terme, impliquant des durées typiquement supérieures à un jour, des vieillissements accélérés dans des enceintes climatiques peuvent être réalisés. La norme internationale ISO 4577[8] présente un test de vieillissement dans une étuve pour le polypropylène et les copolymères de propylène.
Pour caractériser le comportement à court terme, impliquant des durées typiquement de l’ordre d’une heure ou moins : une analyse thermique (ATG, ATD, DSC) couplée à une analyse des gaz émanents est possible.
ATG
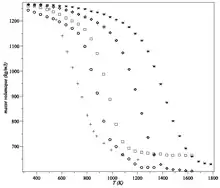
L'analyse thermogravimétrique (ATG) se réfère à une technique où un échantillon est chauffé dans une atmosphère contrôlée à une vitesse de chauffe définie pendant que la masse de l'échantillon est mesurée. Quand un échantillon de polymère se dégrade, sa masse diminue en raison de la production de produits gazeux. La perte de masse est liée à la température et à la vitesse de chauffe.
ATD et DSC
L'analyse thermodifférentielle (ATD) et la calorimétrie différentielle à balayage (DSC) analysent les effets de chauffage du polymère pendant les changements physiques en termes de transition vitreuse, de fusion, etc.[9] Lors de la dégradation du polymère, cette technique mesure le flux de chaleur associé à l'oxydation.
Dégradation induite
Il est possible d'induire la dégradation d'un polymère en le mettant dans certaines conditions telles que celles indiquées dans le tableau suivant.
| Type de thermolyse | Matière ajoutée | Température | Pression | Principaux produits finis |
|---|---|---|---|---|
| Pyrolyse | ~ 500 °C | Pression réduite | ||
| Hydrogénation | Dihydrogène | ~ 450 °C | ~ 200 bars | |
| Gazéification | Dioxygène et/ou eau | Sous pression | Monoxyde de carbone, dioxyde de carbone et dihydrogène |
Références
- (en) Thermal Degradation of Plastics [PDF], Zeus Technical whitepaper.
- (en) « MSDS - Nylon 6 » [PDF], sur Geotech Polymers, SUNY (consulté le ).
- Jacques Verdu, Différents types de vieillissement chimique des plastiques, Techniques de l'ingénieur, réf. AM 3 152, 2002
- (en) G. Duffa, Ablative Thermal Protection Systems Modeling, Reston, VA, AIAA Educational Series, , 431 p. (ISBN 978-1-62410-171-7).
- (en) « Thermal and Oxidative Degradation of Polymers » [PDF].
- « Produits de dégradation thermique des matières plastiques - Note documentaire », INRS, 01/1999.
- Bernard Lamy, Les matériaux sandwichs - calcul, mise en œuvre, contrôle, dégradation - Cours et applications, 2017
- NF EN ISO 4577 Septembre 1999 Plastiques - Polypropylène et copolymères de propylène. Détermination de la stabilité à l'oxydation à chaud dans l'air - Méthode à l'étuve
- (en) M. A. Villetti, J. S. Crespo, M. S. Soldi, A. T. N. Pires, R. Borsali et V. Soldi, Thermal degradation of natural polymers, Journal of Thermal Analysis and Calorimetry, vol. 67, 2002, 295-303.
- Portail de la chimie
- Portail de la physique
- Portail des sciences des matériaux