Neurogenèse
La neurogenèse désigne l'ensemble du processus de formation d'un neurone fonctionnel du système nerveux à partir d'une cellule souche neurale[1]. Elle a principalement lieu lors du développement neuronal du cerveau chez l'embryon et l'enfant (« neurogenèse primaire »). Certaines structures cérébrales des mammifères continuent cependant à produire des neurones chez l'individu adulte (neurogenèse adulte (en)).
Issues du neuroectoderme, provenant lui-même de l'ectoderme, ces cellules migrent pendant la formation des structures du système nerveux central (tube neural puis vésicules cérébrales primitives : prosencéphale, mésencéphale et rhombencéphale). De leur corps cellulaire croissent des prolongements cellulaires ou neurites : axones et dendrites. Une structure appelée « cône de croissance », située à l'extrémité distale de l'axone notamment (mais aussi, dans une moindre mesure, des dendrites), permet la croissance et la progression du neurite en permettant un couplage mécanique entre le neurite (et notamment son cytosquelette) et le substrat (matrice extracellulaire, autres neurites, cellules gliales). Ce cône de croissance est une structure sensible à l'environnement moléculaire du neurone qui permet d'orienter la croissance des neurites, et d'établir le réseau fonctionnel éminemment complexe qu'est le système nerveux. Il faut en effet que le neurone puisse établir des synapses (synaptogenèse) avec des milliers d'autres neurones, qui ne sont pas forcément ses plus proches voisins.
Une neurogenèse réparatrice[2] peut également avoir lieu à la suite d'un traumatisme (accident vasculaire cérébral[3],[4] ou ischémie[5] par exemple) via l'activation de cellules souches neurales endogènes[6], même si ce mécanisme imparfait ne permet pas une complète régénération des structures atteintes.
La neurogenèse peut également désigner, par généralisation, la formation de la totalité des structures du système nerveux au cours du développement mais on lui préfèrera alors le terme moins équivoque de neurodéveloppement.
Mécanismes de formation d'un neurone

La neurogenèse ne décrit pas seulement la différenciation d'une cellule souche neurale en cellules neuronales, elle désigne l'ensemble de la formation d'un neurone fonctionnel et intégré au sein du système nerveux. Elle comprend donc différentes étapes, schématiquement successives :
- Différenciation d'une cellule souche ou pluripotente en neuroblaste (cellule progénitrice des neurones) ;
- Migration du corps cellulaire vers la zone d'accueil prédéterminée (ex: couche cellulaire du cortex) ;
- Prolongement de l'axone vers sa structure cible ;
- Formation des dendrites et synaptogenèse ;
- Maturation par renforcement des synapses « utiles » et élimination des neurones non utilisés (élagage) ;
- Plasticité (modification constante des propriétés du neurone au cours de la vie adulte).
Neurogenèse embryonnaire
Durant la gastrulation, le feuillet ectodermique qui se situe à la surface de l'embryon reçoit, sur une partie de sa surface, des signaux provenant du mésoderme sous-jacent. Ses signaux induisent la différenciation d'une partie du tissu en neuroectoderme ; le reste de l'ectoderme, lui, deviendra de l'épiderme. Cette différenciation entre deux identités cellulaires différentes (ici, futur tissu nerveux ou futur tissu épidermique) repose sur des gradients de molécules sécrétées, activatrices ou inhibitrices de la différenciation, notamment les protéines de la morphogenèse osseuse (en anglais : Bone Morphogenetic Protein ou BMP), les protéines Wnt et les sonic hedgehog (SHH).
La formation de ces gradients de molécules antagonistes permet le guidage axonal à partir du cône de croissance et constitue un des mécanismes majoritaires permettant d'expliquer l'embryogenèse.
La surface induite en neuroectoderme s'appelle la plaque neurale. Durant l'étape suivante de neurulation, cette plaque va se refermer pour permettre la formation du tube neural et de la crête neurale. La fermeture s'effectue d'abord au niveau thoracique puis s'étend de part et d'autre. Elle est complète à 28 jours chez l'embryon humain. S'ensuit une importante phase de régionalisation, où l'ensemble du tissu nerveux se structure pour donner chaque sous-partie du futur système nerveux adulte. (cf. Neurodéveloppement).
Entre la 10e et la 20e semaine de gestation chez l'Homme, survient la neurogenèse à proprement parler : des cellules souches situées dans le tube neural se multiplient massivement et se différencient pour former la totalité des cellules gliales et des neurones du système nerveux. La cavité du tube neural, formé durant la neurulation, forme les futurs ventricules du cerveau et le canal épendyme de la moelle épinière. Au sein de cette cavité circule le liquide cérébrospinal. C'est cette cavité qui sert de base interne au système nerveux, le bord externe étant à la périphérie. Au départ formé d'une seule couche cellulaire, le tissu nerveux va proliférer sur les bords des ventricules et s'étendre vers l'extérieur. Les divisions cellulaires s'effectuent à proximité de la lumière du tube neural et les futurs neurones migrent ensuite vers la partie externe du tube. Les cellules prolifératives sont appelées cellules neuroépithéliales et sont par définition des cellules souches neurales.
La neurogenèse embryonnaire chez l'être humain permet de former un stock de 86 milliards de neurones en moyenne[7],[8]. Ces nouveaux neurones s'assemblent ensuite en six couches superposées pour constituer le cortex cérébral lors de la migration opérée entre la 12e et la 24e semaine[9]. De manière contre-intuitive, la majorité des neurones nouvellement formés migre plus loin que ceux qui sont déjà en place, ce qui fait que la couche corticale se forme de l'intérieur vers l'extérieur (exception faite du cervelet). Les premières cellules formées sont les neurones, les cellules gliales sont formées par des mécanismes différents, plus tardivement. Contrairement au neurone qui est une cellule post-mitotique - qui perd la capacité de se diviser - les cellules gliales peuvent continuer à proliférer localement.
Les principales études de la neurogenèse embryonnaire se sont faites par injection de marqueurs radioactifs ou fluorescents ou par injection de cellules repérables (xénogreffe ou modification génétique[10]). Différents modèles animaux ont été utilisés, comme le ver Caenorhabditis elegans, la drosophile, le poisson zèbre, le poulet et la souris, chacun permettant d'étudier les mécanismes de différenciation et de migration par différentes approches complémentaires.
Neurogenèse adulte
La formation du système nerveux commence durant le développement embryonnaire, se poursuit durant les premières années de la vie[11] et ne s'achève entièrement que durant l'adolescence.
Néanmoins, une neurogenèse localisée persiste par la suite chez l'adulte. Cette « jouvence neurale » [12] semble jouer un rôle fonctionnel important dans la plasticité cérébrale générale ; via la plasticité neuronale du cerveau[13], grâce notamment à une possible migration de certains de ces nouveaux neurones, à grande distance, dans le cerveau[14] comme cela est observé dans le cerveau de l'enfant[15],[16].
Histoire scientifique
La neurogenèse adulte a longtemps été considérée comme impossible, selon le « dogme de la fixité neuronale » formulé par Santiago Ramón y Cajal selon lequel l'émergence de la complexité du cerveau au cours de l'évolution se serait accompagnée d'une incapacité pour le cerveau adulte à renouveler ses cellules nerveuses.
Des doutes sont soulevés dès le milieu du XXe siècle avec par exemple la découverte de mitoses et de synthèse d'ADN dans le cerveau d'une souris jeune adulte grâce à l'incorporation de Bromodésoxyuridine[17]. La biologiste polonaise Liliana Lubińska met en évidence en 1959 le rôle des nœuds de Ranvier sur la myéline dans la régénération de neurones sectionnés[18] puis ultérieurement le rôle du flux axoplasmique[19]. Le biologiste américain Joseph Altman met en évidence la neurogenèse chez le cochon d'inde à partir de cellules-souches dans les années 1960[20].[pertinence contestée] Puis dans les années 1970 Cavanagh constate une prolifération d'astrocytes autour d'une blessure provoquée dans le cerveau de rats de laboratoire[21]
Durant les années 1980-90, de nombreuses études montrent peu à peu que de nouvelles cellules neuronales sont en réalité générées dans le système nerveux adulte chez la plupart des espèces. Ce phénomène a d'abord été mis en évidence chez les canaris[22],[23] et d'autres oiseaux adultes[24], puis chez les poissons (poisson zèbre), cnidaires (éponge), insectes (grillon), souris, rats[25] et autres mammifères.
Chez les mammifères, dont l’être humain[26], la neurogenèse adulte se déroule principalement dans deux régions du cerveau[27],[28],
- le gyrus denté de l'hippocampe ;
- la zone sous-ventriculaire, située sous la paroi des ventricules latéraux.
Neurogenèse de l'hippocampe
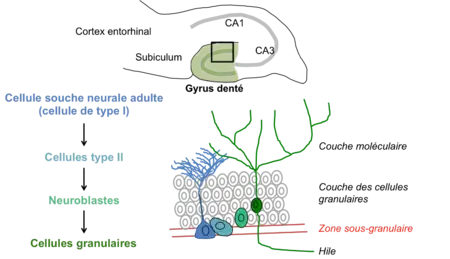
Dans l'hippocampe, la neurogenèse adulte a lieu au niveau du gyrus denté et, plus précisément, au niveau de la zone sous-granulaire.
Les cellules souches neurales (cellules de type I), qui résident et se maintiennent au cours de la vie adulte dans cette zone, produisent, par division asymétrique, des cellules progénitrices (cellules de type II). Celles-ci prolifèrent puis se différencient en neuroblastes et migrent dans la couche granulaire. Ces neuroblastes se différencient majoritairement en neurones excitateurs appelés cellules granulaires. Il est également suspecté que cette niche de cellules souches produit également des interneurones du gyrus denté et quelques cellules gliales (oligodendrocytes ou astrocytes). Les nouveaux neurones subissent une intense sélection et ne deviennent matures et fonctionnels qu'une infime partie des neurones produits. Cela permet notamment de maintenir le volume du gyrus denté constant.
La raison fonctionnelle du maintien de cette « niche » dans l'hippocampe n'a pas encore été établie. Il est supposé que ce phénomène serait nécessaire aux mécanismes de mémorisation et de repérage spatial - deux des fonctions principales de l'hippocampe - chez l'adulte, en apportant un support pour coder de nouvelles informations et ainsi participer à la plasticité de cette structure.
Les antidépresseurs tels que la fluoxétine (Prozac) augmentent la neurogénèse dans l'hippocampe indiquant un rôle possible dans le contrôle de l'humeur. La première étude qui a mis en évidence ce phénomène a été réalisée par une équipe suédoise en 1998, du bromodéoxyuridine incorporé dans le cerveau de patients atteints de cancer de cet organe montrant la multiplication des cellules nerveuses dans le gyrus denté[29]. Elle a été confirmée par une étude de chercheurs de l'Institut Karolinska en 2013 qui permet de dater par radiocarbone les cellules neuronales[30] et de modéliser que le gyrus denté produit 700 neurones chaque jour, soit un taux de renouvèlement d'environ 1,75 % par an[31].
Neurogenèse sous-ventriculaire
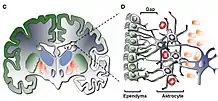
La neurogenèse sous-ventriculaire diffère sur certains points de la neurogenèse de l'hippocampe. Les cellules souches neurales résident au sein d'une niche localisée dans la paroi des ventricules latéraux, la zone sous-ventriculaire (ZSV) ou zone sous-épendymale puisqu'elles se situent sous la couche des cellules épendymaires qui tapissent la paroi et constitue la barrière entre le liquide cérébrospinal et le cerveau.
Les cellules souches neurales sont des cellules pseudo-gliales car elles présentent, de manière intrigante, plusieurs caractéristiques des astrocytes (ex. : elles expriment le marqueur glial GFAP de l'anglais : Glial Fibrillary Acidic Protein). Elles ont une morphologie étoilée comme les astrocytes. Elles ont un prolongement en contact direct avec le liquide cérébrospinal et présentent un unique cil à cet endroit appelé cil primaire, dont la fonction semble liée à la régulation de la neurogenèse. Enfin certains de leurs prolongements sont en contact direct avec des vaisseaux sanguins qui irriguent cette zone et pourrait, là encore, intervenir dans la régulation de la neurogenèse.
Ces cellules, souvent appelées cellules B, engendrent des cellules progénitrices, les cellules C, qui sont des cellules qui prolifèrent transitoirement dans la niche. Celles-ci se différencient ensuite en neuroblastes ou cellules A. La niche neurogénique sous-ventriculaire est donc composée de trois types cellulaire (B, C et A) qui sont en contact étroit et communiquent pour réguler la neurogenèse (boucle d'auto-régulation).
Contrairement à la niche du gyrus denté, les neuroblastes ne restent pas au niveau de la ZSV et migrent hors de cette zone sous forme de chaîne. Les différentes chaines de neuroblastes se rejoignent au niveau du toit des ventricules et se dirigent vers la partie antérieure du cerveau où elles forment un flux de migration, appelé RMS (pour rostral migratory stream en anglais). Ce flux part de la ZSV et aboutit dans le bulbe olfactif, structure la plus antérieure chez le rongeur et situé juste au-dessus de la cavité nasale chez l'Homme.
Dans le bulbe olfactif, les neuroblastes migrent radialement et s’intègrent dans différentes couches de cette structure où ils se différencient en interneurones. Deux types d'interneurones ont été principalement décrits : les neurones granulaires et les neurones périglomérulaires. Cet apport continu en nouveaux interneurones pourrait jouer un rôle dans le codage des nouvelles odeurs. Le volume du bulbe olfactif n'augmentant pas durant la vie adulte, il existe un mécanisme de sélection capable de supprimer les neurones non utilisés et de sélectionner parmi les nouveaux neurones seulement ceux qui s'intègrent durant le codage d'une nouvelle odeur.
Contrairement à ce qui se passe chez les rongeurs (neurogenèse de 30 000 neurones par jour[32]), les cellules nerveuses du bulbe olfactif humain ne se renouvellent pas ou très peu (moins de 1 % en 100 ans)[33],[34].
Régulation de la neurogenèse adulte
La neurogenèse adulte est un système dynamique contrôlé par de multiples facteurs intrinsèques et extrinsèques.
Elle est notamment régulée par :
- des facteurs de croissance ; facteur de croissance des fibroblastes (FGF), facteur de croissance épidermique (EGF), brain-derived growth factor (BDGF), etc.
- des neurotransmetteurs, ex. : sérotonine, dopamine, glutamate, etc.
- des hormones, ex. : œstrogène, prolactine, corticostéroïdes ;
- des médicaments, ex. : antidépresseur, opiacé, lithium, etc.
De nombreuses conditions de vie influent également sur la neurogenèse adulte, parmi lesquels on trouve le vieillissement, la grossesse, le stress, les maladies, l'activité physique, la richesse de l'environnement, la diète, l'apprentissage, etc. Les facteurs qui ont un effet (positif ou négatif) sur le nombre de nouveaux neurones produits sont susceptibles d'agir à n'importe quel niveau du processus, de la division de la cellule-souche, jusqu'à la maturation du neurone. Cette complexité de la régulation commence à peine à être appréhendée[35].
Pathologies liées à la neurogenèse
Pathologies adultes
La neurogenèse adulte est un mécanisme très récemment découvert qui génère beaucoup d'espoirs pour le traitement de différentes pathologies. L'idée centrale consiste à être capable de rediriger la neurogenèse vers les sites de lésion et ainsi d'être capable de réparer avec les propres cellules du patient et avec un minimum d'intervention le manque de neurones.
Enjeux thérapeutiques
Les découvertes sur la neurogenèse adulte et les cellules souches neurales ouvrent de nouvelles perspectives en médecine[36].
L'exploitation de cellules souches multipotentes neurales et d'une certaine capacité à « détourner, depuis leur zone germinative, les neurones nouvellement formés dans un cerveau adulte » permettront peut-être de nouvelles stratégies de réparation du système nerveux et de traitement de certaines maladies dégénératives.
Cela permettra peut-être aussi de fabriquer à partir de cellules souches embryonnaires ou de cellules souches adultes d'autres structures (comme la peau) un cerveau artificiel[36],[37], avec plusieurs avantages par rapport à l'utilisation de cellules souches embryonnaires ou fœtales :
- moins de problèmes éthiques[12] ;
- élimination du risque de rejet immunologique par l’hôte[12] ;
- moindre risque d'apparition de mutations génétiques susceptible d'apparaître durant la durée de maintien en culture des cellules souches[38]
Plusieurs facteurs endogènes de régulation de la neurogenèse ont déjà été découverts[12]. Pouvoir contrôler ou faciliter le recrutement, la survie et la différenciation des progéniteurs neuraux est donc une piste thérapeutique pour le traitement de certaines pathologies du cerveau[12].
Notes et références
- (en) R. McKay « Stem cells in the central nervous system » Science 1997;276:66–71.
- (en) Bernal GM & Peterson DA « Neural stem cells as therapeutic agents for age-related brain repair » Aging Cell 2004;3:345–351.
- Thored P, Arvidsson A, Cacci E, Ahlenius H, Kallur T, Darsalia V, Lindvall O. et al. « Persistent production of neurons from adult brain stem cells during recovery after stroke » Stem cells 2006;24(3):739-747.
- (en) Zhang R, Zhang Z, Wang L. et al. « Activated neural stem cells contribute to stroke-induced neurogenesis and neuroblast migration toward the infarct boundary in adult rats » J Cereb Blood Flow Metab. 2004;24:441–448.
- (en) Zhang RL, Zhang ZG, Zhang L. et al. « Proliferation and differentiation of progenitor cells in the cortex and the subventricular zone in the adult rat after focal cerebral ischemia » Neuroscience 2001;105:33–41.
- (en) Arvidsson A, Collin T, Kirik D. et al. « Neuronal replacement from endogenous precursors in the adult brain after stroke » Nat Med. 2002;8:963–970.
- (en) Frederico A. C. Azevedo et al., « Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain », The Journal of Comparative Neurology, vol. 513, no 5, (DOI 10.1002/cne.21974, lire en ligne).
- (en) Suzana Herculano-Houzel, « The human brain in numbers: a linearly scaled-up primate brain », Frontiers in Human Neuroscience, vol. 3, (ISSN 1662-5161, DOI 10.3389/neuro.09.031.2009, lire en ligne).
- Elena Sender, Dossier : les 5 âges du cerveau, Sciences et avenir, février 2010, page 46.
- Okada A, Lansford R, Weimann JM, Fraser SE & McConnell SK Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein Exp. Neurol., 156 (1999), pp. 394–406.
- J. Altman Autoradiographic and histological studies of postnatal neurogenesis. IV. Cell proliferation and migration in the anterior forebrain, with special reference to persisting neurogenesis in the olfactory bulb J. Comp. Neurol., 137 (1969), pp. 433–458.
- De Chevigny A & Lledo PM (2006) http://www.erudit.org/revue/MS/2006/v22/n6/013501ar.html#no2 La neurogenèse bulbaire et son impact neurologique]. M/S: médecine sciences, 22(6-7), 607-613.
- Ming & Song, Adult neurogenesis in the Mammalian brain: significant answers and significant questions. Neuron 2011.
- C. Lois, A. Alvarez-Buylla (1994) Long-distance neuronal migration in the adult mammalian brain Science, 264, pp. 1145–1148.
- Luskin MB (1993) Restricted proliferation and migration of postnatally generated neurons derived from the forebrain subventricular zone Neuron, 11, pp. 173–189.
- Mayer-Proschel M, Kalyani AJ, Mujtaba T, Rao MS (1997) http://www.sciencedirect.com/science/article/pii/S0896627300809605/pdfft?md5=4f8719f48eb0ca93c28ac29e6a0de604&pid=1-s2.0-S0896627300809605-main.pdf Isolation of lineage-restricted neuronal precursors from multipotent neuroepithelial stem cells] Neuron, 19, pp. 773–785.
- (en) Messier B, Leblond CP, Smart I (1958) « Presence of DNA synthesis and mitosis in the brain of young adult mice » Exp. Cell Res. 1958;14:224–226.
- Liliana Lubińska, « Region of transition between preserved and regenerating parts of myelinated nerve fibers », Journal of comparative Neurology, vol. 113, no 2, , p. 169-335 (DOI 10.1002/cne.901130206)
- Oderfeld-Nowak B et al., « Liliana Lubinska (1904-1990) - the pioneer of investigations on axonal transport and nerve regeneration », Acta Neurobiologiae Experimentalis, (présentation en ligne)
- (en) J. Altman et G. Das, « Postnatal Neurogenesis in the Guinea-pig », dans Nature no 214, p. 1098-1101 (10 juin 1967).
- (en) Cavanagh JB, « The proliferation of astrocytes around a needle wound in the rat brain » J. Anat. 1970;106:471–487.
- (en) J. Paton et F. Nottebohm, « Neurons generated in the adult brain are recruited into functional circuits », Science, vol. 225, no 4 666, , p. 1046-1048. (DOI 10.1126/science.6474166).
- (en) Alvarez-Buylla A, García-Verdugo JM, Mateo A, Merchant-Larios H, « Primary neural precursors and intermitotic nuclear migration in the ventricular zone of adult canaries » J. Neurosci. 1998;18:1020–1037.
- (en) A. Alvarez-Buylla, M. Theelen, F. Nottebohm, « Proliferation “hot spots” in adult avian ventricular zone reveal radial cell division » Neuron 1990;5:101–109.
- (en) Palmer TD, Takahashi J, Gage FH, « The adult rat hippocampus contains primordial neural stem cells » Mol. Cell. Neurosci. 1997;8:389–404.
- (en) Eriksson PS, Perfilieva E, Bjork-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH. « Neurogenesis in the adult human hippocampus ». Nat. Med. 1998;4(11):1313-7. .
- (en) Taupin P, Gage FH, « Adult neurogenesis and neural stem cells of the central nervous system in mammals » J Neurosci Res. 2002;69(6):745-9. .
- (en) Taupin P. « Neurogenesis in the pathologies of the nervous system » Med Sci (Paris). 2005 Aug-Sep;21(8-9):711-4. .
- (en) Peter S. Eriksson, Ekaterina Perfilieva, Thomas Björk-Eriksson, Ann-Marie Alborn, Claes Nordborg, Daniel A. Peterson et Fred H. Gage, « Neurogenesis in the adult human hippocampus », Nature Medicine, vol. 4, no 11, , p. 1313-1317 (DOI 10.1038/3305).
- Les retombées radioactives des essais de bombes atomiques entre 1945 et 1963 ont dispersé des particules radioactives dans l’atmosphère de la Terre, dont le carbone 14 qui s’est retrouvé dans l’ADN des cellules. Certaines cellules du gyrus denté de personnes vivant lors de ces essais ont des niveaux inférieurs en C14, ce qui signifie qu'elles se sont multipliées après 1963.
- (en) Kirsty L. Spalding, Olaf Bergmann, Kanar Alkass, Samuel Bernard, Mehran Salehpour, Hagen B. Huttner, Emil Boström, Isabelle Westerlund, Céline Vial, Bruce A. Buchholz, Göran Possnert, Deborah C. Mash, Henrik Druid et Jonas Frisén, « Dynamics of Hippocampal Neurogenesis in Adult Humans », Cell, vol. 153, no 6, , p. 1219-1227 (DOI 10.1016/j.cell.2013.05.002).
- (en) Scott Lipnick, Mohan C. Vemuri, Melissa Carpenter, Neural Development and Stem Cells, Springer Science & Business Media, , p. 29.
- (en) (en) Bergmann O, Liebl J, Bernard S, Alkass K, Yeung MS, Steier P, Kutschera W, Johnson L, Landén M, Druid H, Spalding KL et Frisén J., « The age of olfactory bulb neurons in humans », Neuron, vol. 74, no 4, , p. 634-639 (PMID 22632721, DOI 10.1016/j.neuron.2012.03.030, lire en ligne [PDF], consulté le ).
- BE Autriche numéro 146 (6/08/2012), « Les cellules nerveuses du bulbe olfactif ne se renouvellent pas », Ambassade de France en Autriche / ADIT, (consulté le ).
- (en) Encinas JM, Enikolopov G, « Identifying and quantitating neural stem and progenitor cells in the adult brain », Methods Cell Biol, vol. 85, , p. 243-72. (PMID 18155466, DOI 10.1016/S0091-679X(08)85011-X).
- (en) James Gallagher, « Miniature 'human brain' grown in lab », sur bbc.com, (consulté le )
- Lois C, Alvarez-Buylla A. (1994) Long-distance neuronal migration in the adult mammalian brain. Science ; 264 : 1145-8.
- Mitchell BD, Emsley JG, Magavi SS, et al. (2004) Constitutive and induced neurogenesis in the adult mammalian brain: manipulation of endogenous precursors toward CNS repair. Dev Neurosci ; 26 : 101-17.
Voir aussi
Bibliographie
- Doetsch F, Caille I, Lim DA, García-Verdugo JM & Alvarez-Buylla A (1999) Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell, 97(6), 703-716.
- Calaora V, Chazal G, Nielsen PJ, Rougon G, Moreau H (1996) mCD24 expression in the developing mouse brain and in zones of secondary neurogenesis in the adult ; Neuroscience, 73, p. 581–594.
- Davis AA & Temple S (1994) A self-renewing multipotential stem cell in embryonic rat cerebral cortex Nature, 372, p. 263–266.
- Doetsch F & Alvarez-Buylla A(1996) Network of tangential pathways for neuronal migration in adult mammalian brain Proc. Natl. Acad. Sci. USA, 93, p. 14895–14900.
- F. Doetsch, J.M. Garcia-Verdugo, A. Alvarez-Buylla (1997) Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain J. Neurosci., 17, p. 5046–5061.
- Eckenhoff MF & Rakic P (1988) Nature and fate of proliferative cells in the hippocampal dentate gyrus during the life span of the Rhesus monkey J. Neurosci., 8, p. 2729–2747.
- K. Frederiksen, R.D.G. McKay (1988) Proliferation and differentiation of rat neuroepithelial precursor cells in vivo J. Neurosci., 8, p. 1144–1151.
- Gage FH, Ray J & Fisher LJ (1995) Isolation, characterization, and use of stem cells from the CNS Annu. Rev. Neurosci., 18, p. 159–192.
- García-Verdugo JM, Doetsch F, Wichterle H, Lim DA & Alvarez-Buylla A (1998) Architecture and cell types of the adult subventricular zone: in search of the stem cells J. Neurobiol., 36, p. 234–248.
- Johansson CB, Momma S, Clarke DL, Risling M, Lendahl U & Frisén J (1999) Identification of a neural stem cell in the adult mammalian central nervous system Cell, 96, p. 25–34.
Articles connexes
Lien externe
- Portail de la biologie
- Portail des neurosciences
- Portail de la médecine