Rat de laboratoire
On appelle « rat de laboratoire » des souches ou lignées de rats sélectionnées et élevés et reproduits pour les besoins de l'expérimentation animale en laboratoires, ou parfois pour les leçons d'anatomie et de dissection[1].
| Sous-page d'un taxon biologique |
| Article principal : |
|
 |
| Rats de laboratoire (de la lignée wistar). |
| Sous-articles |
|
| Autres articles liés |
| Rat |
Le rat étant bien plus facile à élever que les singes (plus proches génétiquement de l'homme), il est devenu l'une des espèces les plus utilisées pour l'expérimentation animale. Après la souris, c'est le rat qui est le mammifère le plus fréquemment utilisé en expérimentation animale (il compte pour à peu près 20 % du nombre total de mammifères utilisés dans la recherche).
Toutes les souches de laboratoire ont été produites par sélection à partir de reproducteurs choisis par les éleveurs au sein d'élevages de Rat brun, dont les premiers exemplaires provenaient de l'espèce sauvage Rattus norvegicus.
Le rat albinos de compagnie et la plupart des rats de compagnie sont des descendants de rats de laboratoires.
Génomique du rat
Le rat (Rattus norvegicus) est le troisième mammifère dont le séquençage du génome a été entrepris (juste après celui de la souris[2] et de l'Humain, et avant celui du chien) ; La souche choisie pour le séquençage a été une souche « BN rat » (BN/SsNHsd) provenant du Medical College of Wisconsin (en) (MCW) à partir d'une lignée « Harlan Sprague Dawley » et la plus grande partie du génome analysé provient de deux femelles, sauf quelques éléments et le séquençage du chromosome Y provenant d'un mâle[3].
Le génome du rat (ADN double brin linéaire, d'environ 2,75 milliards de paires de bases) est plus petit que celui de l'humain (2,9 milliards), mais plus grand que celui de la souris (2,6 milliards) avec lesquels il partage un certain nombre de gènes[3]. Ce génome comprend environ 2,7 milliards de paires de bases organisées en 21 chromosomes. En 2004, il était séquencé à 90 %, permettant de supposer qu'environ 90 % des gènes du rat sont partagés avec l'Homme. Ce travail s'est fait avec l'aide du National Human Genome Research Institute (NHGRI)[3]. De plus, selon le consortium qui étudie ce génome, Rat Genome Sequencing project Consortium[4], tous les gènes humains connus pour être associés à des maladies ont des équivalents dans le génome du rat[5],[3].
Selon ce consortium, malgré un génome de taille différente, « le génomes du rat, de la souris et celui du génome humain codent le même nombre de gènes. La majorité ont persisté sans délétion ni duplication depuis le dernier ancêtre commun ; Les structures introniques sont bien conservées »[3].
Quelques spécificités génétiques du rat
- Certains gènes du rat n'existent pas chez la souris ; Ils proviendraient de l'expansion - au cours de l'évolution - de certaines familles de gènes (dont des gènes produisant des phéromones, ou impliqués dans l'immunité, la chemosensation, la désintoxication ou la protéolyse)[3] ;
- Le rat dispose de gènes homologues (et plus précisément « orthologues ») de presque tous les gènes humains associés à des maladies connues chez l'Homme, mais avec des différences dans leurs taux de substitution synonyme par rapport aux autres gènes[6],[3] ;
- Environ 3 % du génome du rat est constitué de segments largement dupliqués ; ce taux est intermédiaire entre celui qui a été mesuré chez la souris (1-2 % du génome) et celui de l'humain (5-6 % du génome). Ces duplications se produisent principalement dans les régions « péricentromériques » (autour du centromère). Plusieurs expansions récentes de familles de gènes majeurs pourraient être dues à ces duplications génomiques[3].
- Le cœur euthérien de ce génome (paires de bases correspondant orthologuement à celles trouvées chez la souris et l'Homme) comprend environ un milliard de nucléotides (soit environ 40 % du génome euchromatique du rat). Il contient aussi la plupart des « exons » et des éléments régulateurs connus, soit 1-2 % du génome). Une partie de ce cœur semble être sous contrainte sélective chez les rongeurs et les primates ; elle constitue 5 à 6 % du génome du rat. Le reste du génome semble évoluer de façon neutre[3] ;
- Environ 30 % du génome du rat s'aligne sur le génome de la souris, et une part considérable de ces 30 % est constituée de répétitions propres aux rongeurs. Pour le reste (ce qui n'est pas aligné sur la souris), environ la moitié est constituée de répétitions spécifiques au rat [3].
- On observe plus d'occurrences de changements génomiques dans les lignées de rongeurs que dans celles de primates [3].
- Les taux locaux de microinsertions et de microdélétions, d'insertion d'éléments transposables sont fortement corrélés aux substitutions de nucléotides apparues depuis la divergence des rats et des souris (bien que ces événements se soient produits en plusieurs millions d'années et indépendamment chez les rats et les souris)[3].
Base de données mondiale
Cette base, appelée « Rat Genome Database » (RGD) rassemble les informations sur la génétique et génomique du rat[7]. Cette base a été fondée en 1995 par le United States National Institutes of Health et hébergée par le Medical College of Wisconsin (en)[8].
De nouveaux outils ont été construits pour l'accompagner et la valoriser dont le GBrowse[9] de Lincoln Stein, qui est une interface WEB open-source pour le genome project database[10],[11].
Élevage et reproduction



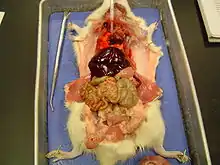




Ce rongeur omnivore et opportuniste, facile à élever produit une descendance rapide, grâce à une gestation courte (environ trois semaines) et à une maturité sexuelle acquise dès 40 jours environ ; dans de bonnes conditions, une même femelle peut ainsi produire soixante petits par an, soit indirectement 1 000 descendants en un an.
Caractéristiques
Elles varient selon les souches que les éleveurs ont cherché à standardiser et stabiliser.
- Durée de vie : 2,5 à 3 ans ;
- Mode de vie : crépusculaire ;
- Régime alimentaire : omnivore à tendance granivore (opportuniste) ;
- Poids moyen adulte : 350 g en moyenne (250 à 500 g pour les femelles, 450 à 700 g pour les mâles) ;
- Taille à l'âge adulte : 25 cm en moyenne (20 à 28 centimètres à l'âge adulte sans compter la queue) ;
- Longueur de la queue: 13 à 15 centimètres.
- Comportement, intelligence : Cet animal grégaire[14]. est capable d'apprendre et mémoriser (par exemple un chemin dans un labyrinthe[15].. C'est un animal social. Capable de distinguer certaines causes et de les associer à des effets (« raisonnement causal »[16],[17]), il adapte dans une certaine mesure son comportement à son environnement pour échapper aux pièges ou activer des mécanismes, par exemple pour trouver des récompenses sous forme de nourriture. Il se montre capable d'empathie pour ses semblables[18], notamment en difficulté[19].
Ces caractéristiques en font un modèle intéressant pour l'éthologie ou l'étude de certains neurotoxiques.
Ces rats domestiqués diffèrent significativement des rats sauvages, de plusieurs manières :
- Ils sont plus calmes, ils mordent moins et peuvent tolérer une plus grande promiscuité et un espace individuel plus restreint ;
- Ils se reproduisent plus tôt, et en produisant une descendance plus abondante ;
- Leurs cerveau, cœur, foie, reins, glandes surrénales sont plus petits.
Utilisations
Au fil des ans, les rats ont été utilisés dans de nombreuses études expérimentales, qui ont ajouté à notre compréhension de l'évolution des mammifères (dont le rat[20]), et de nombreux aspectes de la génétique, des maladies, des effets de l'addiction aux drogues (dont alcool, tabac et nicotine[21]) et médicaments, ou d'autres substances ou environnement susceptibles d'affecter la santé ou d'intéresser la médecine ou la nutrition.
Rien que dans le domaine de la médecine, le rat a été très utilisé dans les domaines suivants :
- Greffes et transplantations de divers organes[23],[24],[25].
- certains troubles du comportement et physiologiques (ex-épilepsie[30]…) ;
- désordres psychiatriques tels que le syndrome de Gilles de La Tourette[31] ;
- Mal de l’espace[32],
- Certains mécanismes d'addiction, dont neurologiques [33]
- médicaments et diverses thérapeutiques, par ex contre l'épilepsie[42] ou pour soigner des traumatismes du cerveau[43]
- toxicologie, pharmacotoxicologie[44],[45],[46],[47].
- parasitoses (ex : Malaria[48])
Le rat de laboratoire est notamment utilisé comme substitut ou modèle pour :
- reproduire des maladies (cf. ci-dessus…) ;
- être résistant à certains pathogènes ou facteurs de stress, ou au contraire y être plus sensible ;
- tester la réaction d'un organe ou de tout l'organisme à un produit ou à un cocktail de produits, ou à un environnement particulier (par exemple en médecine aérospatiale[49]) ;
- Des rats de laboratoire se sont également révélés précieux dans les études sur la psychologie de l'apprentissage et d'autres processus mentaux.
L'importance historique de cette espèce pour la recherche scientifique est notamment traduite par l'abondante littérature à ce sujet (à peu près 50 % de plus que pour la souris de laboratoire[1]).
Les rats « knock-out »
Parmi les rats mutants créés ou élevés par ou pour des laboratoires, les rats « knock-out » (ou « knockout ») sont des cas particuliers. Ce sont des rats chez lesquels un ou plusieurs gènes ont été désactivés (au moyen du génie génétique), pour causer l'équivalent de maladies ou malformations connues chez l'Homme ou des animaux. Cette déficience se transmet de génération en génération, quand la reproduction de l'animal est possible. La recherche académique et pharmaceutique utilisent ces rats knock-out pour l'étude du développement, certaines maladies et la génomique fonctionnelle (l'étude des fonctions de certains gènes ou de groupes de gènes), ou encore pour tester certains médicaments, notamment destinés à traiter des maladies génétiques.
Les rats knock-out sont restés rares jusqu'à la fin des années 2000-2010, et bien moins nombreux que les souris knock-out, parce que l'élevage de lignées stables de rats knock-out est longtemps resté non rentable car techniquement très difficile[50] (jusqu'en 2008[51],[52],[53],[54]).
Dans les années 2000, des progrès dans la maitrise des agents mutagènes (ex. : N-éthyl-N-nitrosourea (ou ENU) chez le rat sprague Dawley[55]), de techniques de mutagenèse dirigée[56],[57] des cellules-souches pluripotentes chez le rat ont facilité la production de lignées transgéniques knock-out de rats[58].
En France, une unité de l'Inserm produit des rats transgéniques depuis 1996, avec un minimum de trois « fondateurs » pour chaque « construction génétique nouvelle » par microinjection[59],[60]. Elle a notamment produit des rats Sprague-Dawley knock-out, avec les techniques « Zinc-Finger nucleases » (ZFN)[61] ou « TALE nucleases » ; en conformité avec les lignes directrices pour l'expérimentation animale des services vétérinaires français[60].
Des rats-modèles knock-out permettent par exemple d'étudier les mécanismes de la maladie de Parkinson[62], la maladie d'Alzheimer, l'hypertension et le diabète[63] ou divers autres sujets dont le « SRAA » (Système rénine-angiotensine-aldostérone) ; la cascade de régulation endocrinienne et enzymatique qui entretient l'homéostasie hydrosodée du rein (l'équilibre entre les ions Na+ et l'eau)[64],[65], du rôle du système sérotonergique dans le système nerveux[66] ou la douleur[67].
Statut légal
Les rats de laboratoire, en tant qu'animaux d'élevage ainsi que leurs élevages doivent répondre à des prescriptions particulières, dont en Europe. Il existe des « dispositions relatives à la protection des animaux de laboratoire utilisés à des fins expérimentales », aux installations d'élevage et de traitement des animaux, aux soins, logement et confinement des systèmes d'essais biologiques[68] et des contrôles spécifiques[69], y compris pour les essais de médicaments vétérinaires[70]. Une certaine « protection de l'animal »[71] et des bonnes pratiques existent, dont en France - sous l'égide d'une Commission nationale de l'expérimentation animale où, par exemple, « Les systèmes d'essai animaux et végétaux récemment reçus sont isolés jusqu'à ce que leur état sanitaire ait été évalué. Si l'on observe une mortalité ou une morbidité anormale, le lot considéré n'est pas utilisé dans les études et, s'il y a lieu, est détruit dans le respect des règles d'humanité. Au commencement de la phase expérimentale d'une étude, les systèmes d'essai sont exempts de toute maladie ou symptôme qui pourrait interférer avec l'objectif ou le déroulement de l'étude. Des sujets d'essai qui tombent malades ou sont blessés au cours d'une étude sont isolés et soignés, si besoin est, pour préserver l'intégrité de l'étude. Tout diagnostic et tout traitement de toute maladie, avant ou pendant une étude, sont consignés [...] L'Agence française de sécurité sanitaire des aliments tient dûment compte des résultats des inspections d'installations d'essai et des vérifications d'études faites dans un État-membre de la Communauté européenne, afin d'éviter, dans la mesure du possible tout risque de double emploi selon le principe de protection des animaux de laboratoire »[72].
Ces rats peuvent être légalement considérées comme domestiques, c'est le cas par exemple dans la législation française (comportant des dispositions relatives à la protection des animaux de laboratoire utilisés à des fins expérimentales en application du droit européen).
Risques
La libération volontaire, accidentelle ou la fuite dans la nature d'animaux issus de certaines souches génétiquement modifiées, ou porteuses de pathogènes dangereux doivent être évitées.
L'élevage, le transport et la destruction des cadavres doivent faire l'objet de précautions particulières qui relèvent tantôt des bonnes pratiques tantôt de la législation (qui peut varier selon les pays).
Histoire
- En 1828 aurait eu lieu la première expérience scientifique faite sur le rat (un groupe de rats mutants albinos)[73]. Elle portait sur les effets du jeûne[1]. Cet animal fut ensuite de plus en plus utilisé pour diverses expériences, comme la souris, le hamster, le cochon d'inde, le lapin ou le singe[1] ;
- En 1856, Une première colonie d'élevage à fins expérimentales est constituée[73], permettant quelques-unes des premières études sur la génétique de mammifères (par Crampe de 1877 à 1885, qui étudie l'héritabilité de certains caractères de couleurs[74]) ; la souris remplacera le rat pour les études de génétique, mais le rat sera de plus en plus utilisé par les physiologistes, et nutritionnistes ;
- En 1880 des rats sont élevés en captivité aux États-Unis, d'abord pour un laboratoire de Chicago pour des études neurologiques ;
- En 1906, quelques rats issus de cette colonie ont été transférés au Wistar Institute (en) de Philadelphie. Une partie de leur descendance formera la lignée (en)wistar encore très utilisée.
Lignées, souches
Au moins 234 souches consanguines différentes de R. norvegicus ont été développées (par sélection et/ou mutation dirigée dans les élevages, par ou pour les laboratoires[75] (et une seule de ces 234 souches peut comprendre plusieurs « sous-souches » présentant des caractéristiques et/ou des comportements différents).
Une souche est un groupe d'individus dont tous les membres sont génétiquement aussi proches que possible, ce qui implique une reproduction consanguine. Ces populations génétiquement homogènes permettent des expériences sur le rôle des gènes, ou nécessitant d'exclure l'influence de variations génétiques. Inversement, des populations non consanguines sont utilisées quand un génotype identique ou réduit n'est pas utile ou nuirait à l'expérience (quand la diversité génétique est nécessaire). Les laboratoires parlent alors de « stocks » plutôt que de « souches »[76],[77].
Les lignées sont créées par sélection et reproduction consanguine, par des élevages spécialisés ou par les laboratoires, éventuellement à partir de mutations apparues par hasard, ou pour répondre à besoins spécifiques ;
- Wistar[78]. De nombreuses lignées utilisées aujourd'hui proviennent de cette souche albinos « Wistar » créée par croisements consanguins à partir de l'espèce Rattus norvegicus dans le Wistar Institute (en) à partir de 1906 pour une utilisation en recherche biomédicale. Cette souche de rats a d'abord été développée pour produire un organisme modèle à un moment où les laboratoires utilisaient principalement la souris de laboratoire (Mus musculus). Plus de la moitié de toutes les souches actuelles de rats de laboratoire descendent d'une colonie initiale établie par le physiologiste Henry Donaldson, le scientifique et administrateur Milton J. Greenman, et la généticiennne/embryologiste Helen Dean King[79],[80]. Ce rat est caractérisé par une tête large, de longues oreilles, et ayant une longueur de queue toujours inférieure à celle du corps. Il est plus actif que le Sprague Dawley. C'est à partir de cette lignée qu'ont notamment été développées les souches de rats Sprague Dawley et Long-Evans ou encore le rat spontanément hypertendu et rat Lewis, mais il en existe bien d'autres.
- Lewis ; Ce rat albinos tient son nom de celui du Dr Lewis qui l'a développé à partir de la lignée Wistar au début des années 1950. Il est docile mais peu fécond[81]. Comme cela est fréquent dans les nouvelles souches consanguines, il exprime spontanément plusieurs pathologies : il présente une incidence élevée de tumeurs, qui causent une certaine réduction de sa durée moyenne de vie. Les plus courantes sont les adénomes de l'hypophyse et les adénomes et/ou adénocarcinomes du cortex surrénalien chez les deux sexes. Les femelles développent de fréquentes tumeurs des glandes mammaires et des carcinomes de l'endomètre. Les mâles développent plutôt des adénomes des cellules parafolliculaires (de la thyroïde) et des adénocarcinomes de la glande thyroïde ainsi que des tumeurs du système hématopoïétique. De plus, les rats Lewis sont enclins à la leucémie lymphoïde chronique spontané transplantable. Enfin, quand ils vieillissent ils développent parfois une sclérose glomérulaire spontanée[81].
Il est notamment utilisé par la recherche sur les transplantations, l'arthrite induite par inflammation, l'encéphalite allergique expérimentale, et un diabète induit par la STZ [81].
- Sprague-Dawley ; C'est l'une des espèces de laboratoire les mieux connues[82] et les plus utilisées au monde (Le , avec Sprague-Dawley comme mot clé, le moteur de recherche de pubMed, principal moteur de recherche de données bibliographiques en médecine et biologie, rapportait 239 852 résultats), et Google scholar, avec le même mot-clé en donnait 367 000. Sans doute à cause d'une mutation génétique qui reste à identifier, cette souche développe plus de tumeurs endocrines dites « spontanées » que toutes les autres souches communes de rats de laboratoire[83], peut être en raison d'une sensibilité particulière aux perturbateurs endocriniens.
Après une étude russe ayant montré en 1976 d'importantes différences dans la propension aux tumeurs de différentes souches de rats de laboratoire[84], notamment chez les rats Sprague-Dawley âgés remarquait une étude japonaise de 1977[85] ayant observé 77 mâle et 73 femelles qui ont vécu de cinq mois à trois ans (60 % des mâles et 95 % des femelles ont développé des tumeurs, la différence selon le sexe étant essentiellement due aux tumeurs mammaires des femelles, très fréquentes[85]. 30 % des mâles et 66 % des femelles de cinq à trente-six mois ont développé une tumeur de l'hypophyse[85], alors que des tumeurs des îlots de Langerhans du pancréas et des tumeurs de la thyroïde apparaissent plus tardivement (incidence élevée chez les rats ayant vécu 2 à 3 ans[85]. Une leucémie myéloïde a touché certains jeunes, dès cinq mois d'âge[85]. Cette incidence élevée de cancers spontanés a été confirmée en 1972, par deux chercheurs américains dans un rapport sur les néoplasmes apparus (apparemment spontanément) chez des rats Sprague-Dawley fournis par six éleveurs commerciaux différents basés dans deux régions (Osborne-Mendel, and Oregon) et élevés dans sept laboratoires différents. Il s'agissait ici aussi de tumeurs endocrines (dont mammaires), avec des variations significatives de l'incidence de tumeurs de la glande médullosurrénale chez les rats provenant d'une même éleveur mais utilisés dans différents laboratoires. Tous les rats ayant développé des cancers des testicules (sauf un) venaient du même élevage (Oregon) ; Les tumeurs de la thyroïde et de l'hypophyse étaient plus fréquentes chez les femelles, alors que les tumeurs de la médullosurrénale et des cellules des îlots pancréatiques étaient plus fréquentes chez les mâles. Les tumeurs du cerveau étaient également plus fréquentes chez les mâles, et survenaient plus tôt chez eux. Les organes touchés et la différence entre sexe peut évoquer une sensibilité élevée de cette souche aux cancers dits hormonaux c'est-à-dire liés au système endocrinien (parmi les rats porteurs de tumeurs endocrines, 9 à 15 % présentaient des tumeurs sur deux ou plus de deux glandes endocrines). Constatant que l'incidence des tumeurs chez ces rats Sprague-Dawley provenant de différentes sources commerciales variaient autant entre eux qu'entre d'autres lignées différentes de rats de laboratoire, ces deux chercheurs ont appelé à la plus grande prudence dans l'évaluation des études de cancérogénicité menées dans des laboratoires différents ou sur des rats provenant de sources différentes[86].
Une autre étude en 1979 a confirmé cette vulnérabilité aux tumeurs endocrines[83] ; les auteurs ont comptabilisé 81 tumeurs chez 100 rats « Sprague-Dawley » (42 mâles et 39 femelles) qu'ils ont laissé vivre plus de deux ans. Ces tumeurs étaient surtout des carcinomes médullaires de la thyroïde, suivies de tumeurs de l'hypophyse antérieure, des phéochromocytomes et des adénomes corticaux de la glande surrénale, puis des tumeurs des cellules des îlots pancréatiques. Plusieurs tumeurs ont été fréquemment observées chez un même rat ; ceci a été en 2001 confirmé au Japon[87], avec des lésions néoplasiques observées chez des rats « Sprague Dawley » dès l'âge de cinq semaines. Ils ont vécu de 89 à 105 semaines d'âge. 70 à 76,7 % des mâles et de 87 à 95,8 % des femelles ont développé des néoplasmes ; adénome hypophysaire et phéochromocytome surrénalien le plus souvent (chez les deux sexes), puis tumeur des testicules et/ou des cellules de Leydig chez les mâles, ou des tumeurs des glandes mammaires, adénome des Cellules parafolliculaires thyroïdiennes, ou encore polypes du stroma (Tissu conjonctif) de l'endomètre utérin chez les femelles. Ce rat ayant une propension naturelle à produire des tumeurs, il est souvent utilisé pour tester la cancérogénicité et/ou le caractère de perturbateur endocrinien de produits dont les effets nocifs ne s'exprimeraient probablement chez d'autres espèces qu'après plusieurs décennies. Ce rat a par exemple été utilisé pour étudier la régulation par le cerveau du métabolisme des graisses abdominales et subcutanées (démontrant qu'il diffère chez le mâle et la femelle)[88]. Il a aussi servi de support à l'étude de la biosécurité de bandages enrichi de nanoparticules de zinc[89] ; celle des aérosols de propylène glycol (fumée artificielle de spectacle)[90], et avant cela (2006) pour évaluer la cancérogénicité de l'Aspartame[91]. L'apparition de tumeurs chez cette espèce est à considérer comme indices que comme des preuves absolues, uniquement si anormalement précoces par rapport au lot-témoin (en raison de cette susceptibilité plus élevée à certaines tumeurs), tester (2012, sur dix rats femelles) l'efficacité de la stimulation électrique du sphincter anal ou du nerf pudental comme moyen de tester sa valeur comme modèle animal[92] et pour certains effets de la sphinctérotomie[93] ou de lutter contre l'incontinence fécale[94]. Il a aussi été utilisé comme modèle pour l'ostéoporose[95], les effets de la supplémentation en calcium sur les os (cf. ostéoporose) chez les femelles après ovariectomie[96], avec ou sans exercice physique[97].
- Fischer 344[98] ;
- BioBreeding (rats « BB », aussi appelés « Biobreeding Diabetes Prone » ou rats « BBDP ») ; c'est une souche consanguine qui développe spontanément une maladie auto-immune de plus en plus fréquente chez l'Homme ; le diabète de type 1. Comme les souris NOD, les rats BB sont utilisés comme modèle animal pour l'étude du diabète de type 1 car cette souche récapitule de nombreuses caractéristiques de cette maladie chez l'homme. Elle a aussi grandement contribué à la recherche de la pathogenèse de cette forme de diabète[99] ;
- Long-Evans ; cette souche non-consanguine[100] a été produite par les docteurs. Long et Evans (d'où son nom) durant la Première Guerre mondiale (en 1915) par le croisement de plusieurs femelles Wistar avec un mâle sauvage gris. Les rats Long Evans » sont de couleur blanche avec une « cagoule noire », ou parfois blanc avec un « capuchon brun ». Ils sont utilisés comme organisme modèle polyvalent ; souvent dans les recherches sur le comportement et l'obésité ;
- Rat Zucker ; il est principalement élevé pour la recherche génétique, et pour les travaux portant l'obésité et l'hypertension[101]. Il est ainsi nommé d'après le nom de Lois et Theodore F. Zucker, deux chercheurs pionniers dans l'étude de la génétique de l'obésité. Il existe deux types de rats Zucker : un rat Zucker maigre, désignée par le trait dominant (Fa/Fa) ou (Fa/fa) et le rat Zucker « obèse » caractéristique (ou gras) qui peut peser jusqu'à 1 kg (plus de deux fois le poids normal d'un rat), en raison d'une mutation (fa/fa) du récepteur de la leptine[102],[103]. Les rats Zucker obèses sont tous touchés par une hyperlipidémie et une hypercholestérolémie sanguines et sont « naturellement » résistants à l'insuline, sans être hyperglycémiques. Leur obésité est à la fois due à une hypertrophie (taille) et une hyperplasie (nombre) des adipocytes (cellules graisseuses)[104].
L'obésité des rats Zucker est principalement liée à un défaut du système de satiété (on les dit hyperphages, c'est-à-dire ayant toujours faim), mais l'apport alimentaire n'explique pas entièrement l'hyperlipidémie ou la composition corporelle globale qui caractérise cette souche[102],[104] ;
- Hairless rats (rats dits « nus », « glabres » ou « chauves ») ; ces rats sont fournis aux laboratoires comme modèles pour le travail sur le système immunitaire et les maladies génétiques rénales. On estime qu'il y a plus de vingt-cinq gènes en cause (allèle récessif dans l'absence de poils et fourrure chez cette souche de rat de laboratoire[105].
Les sous-souches les plus fréquentes sont dites rnu (Rowett nude), fz (fuzzy), and shn (shorn). La souche Rowett nude (rnu) a été sélectionnée en 1953 en Écosse. Elle est caractérisée par une mutation causant une absence de thymus, qui compromet gravement le système immunitaire des rats qui en sont affectés, chez lesquels les infections des voies respiratoires et des yeux augmentent de manière spectaculaire (mais ils sont plus sensibles à la plupart des infections)[106].
- le rat Fuzzy (fz/fz) est une souche qui a été sélectionnée en 1976 par un laboratoire de Pennsylvanie pour une déficience rénale qui est leur principale cause de mortalité, à cause d'un syndrome d'insuffisance rénale progressive qui commence vers l'âge d'un an[107]. Le rat Shorn a été sélectionné à partir de rats Sprague Dawley affectés d'une mutation causant une hypotrichose (absence de poils), par un laboratoire du Connecticut en 1998[108]. Ce rat est également affecté d'une déficience rénale sévère ;
- Royal College of Surgeons rat (ou rats « RCS ») ; « mis au point » par le Collège royal des chirurgiens, c'est le premier animal modèle et le premier animal connu affecté d'une dégénérescence rétinienne héréditaire. la cause génétique de cette déficience a été identifiée en 2000 ; il s'agit d'une mutation du gène MERTK induisant une phagocytose défectueuse dans l'épithélium pigmentaire rétinien des segments externes des photorécepteurs[109] ;
- Rat Kawasaki ; le Shaking rat Kawasaki (ou SRK) est une souche mutante autosomique récessive décrite en 1988[110] caractérisé par une courte délétion dans le gène RELN[111] ; ce qui est cause d'une production insuffisante de la protéine Reelin, essentielle pour le développement du cortex cérébral et du cervelet. Son phénotype peut être comparé à celui de la souris reeler[110] ;
- Holtzman albinos ;
- D'autres souches consanguines sont disponibles, mais moins couramment utilisées que ne le sont les souris de laboratoire consanguines
Souches transgéniques
Elles sont plus rares que chez la souris, car les techniques de transgenèse efficaces chez la souris, le sont moins chez le rat, ce qui a gêné certains chercheurs, d'une part parce qu'ils considèrent que pour de nombreux aspects du comportement et de la physiologie, le rat est plus proche de l'Homme que ne l'est la souris, et d'autre part parce qu'ils souhaitaient pourvoir travailler sur des gènes humains, qui ne sont disponibles que transférés à des souris ;
Rats clonés
Disposer d'individus les plus proches possible intéresse certains chercheurs. Des groupes de rats clonés (1er clonage réussi en par transfert du noyau d'une cellule somatique adulte dans un ovocyte énucléé) devaient permettent de multiplier les études génomiques ou les études de mutagénicité de produits suspectés d'être des génotoxines.
Maintenant qu'une grande partie du génome de Rattus norvegicus a été séquencé[112], de nouvelles possibilités sont ouvertes à la recherche.
Procédures standardisées
Les expériences doivent être les plus reproductibles possibles, dans un environnement contrôlé. Des guides de bonnes pratiques existent pour favoriser ces aspects. Parmi les procédures plus ou moins standardisées lors des expériences figurent
- les mises en quarantaine et la préparation des animaux ;
- la manipulation des animaux ;
- l'alimentation, la boisson ;
- le chauffage, l'éclairage des cages (cycle 12 heures de lumière/12 heures d'obscurité, qui interdit la reproduction des cycles saisonniers, mais permet la comparabilité des études). Lors d'études sur les effets de la privation de lumière ou de l'éclairage artificiel nocturne, on peut au contraire modifier ce cycle, d'une manière qui doit être précisément décrite dans les études ;
- les soins et diverses procédures répétitives et classiques tendent à être de plus en plus standardisées pour permettre une meilleure comparabilité, quand cela est compatible avec le protocole de l'expérience ;
- les biopsies, nécropsies ;
- les prises de sang ou prélèvement d'échantillons d'autres fluides corporels ;
- les injections (les Voies d'administration par injections chez les rats de laboratoire sont principalement sous-cutanées, intrapéritonéales, intraveineuses et intramusculaires[113]).
- la mise à mort … qui doit se faire sans souffrance ou stress supplémentaires ou inutiles dans la mesure du possible.
L'OCDE a récemment publié une série de « Documents de consensus pour les travaux sur la sécurité des nouveaux aliments »[114] comprenant des bonnes pratiques de laboratoire (BPL)
Alimentation
Elle doit être contrôlée (comme l'eau et l'environnement), de manière à ne pas produire de biais dans les expériences. Selon une étude menée par les Laboratoires Harlan [115], son alimentation doit respecter les taux de 14 % de protéines pour 4 % de lipides, pour un rat adulte en bonne santé. La dose quotidienne, donnée à heure fixe, est de 20 grammes environ de nourriture par jour par rat, ceci variant évidemment selon la taille, l'âge et l'activité du rat[116].
Limites de l’expérimentation et du modèle animal utilisant le rat
Il a parfois été reproché au rat d'être trop éloigné de l'humain pour un certain nombre de recherches ; par exemple concernant les expériences relatives au cerveau et à la psychologie animale, il faut tenir compte du fait que les rats possèdent normalement une hiérarchie et des mœurs complexes, atténuées chez le rat de laboratoire, et qu'ils peuvent développer des comportements non-naturels ou déviants quand ils sont séparés très tôt de leur mère, de leur fratrie ou d'un groupe plus élargi (sevrage social ou psychologique qui ne devrait pas se faire avant six mois).
Des questions morales, éthique et de bioéthique se posent également aux chercheurs et à la société quant aux stress et souffrances aiguës infligées aux rats lors de certaines expériences, de même concernant la production d'animaux génétiquement « modifiés » pour inévitablement développer de pathologies graves (dont cancers ou tumeurs) ou pour les animaux intégrant des gènes humains.
La réhabilitation des rats de laboratoire, rendue possible par le biais d'associations comme le GRAAL[117] ou White Rabbit[118], est encore peu utilisée et peu connue du grand public[119]. Elle est basée sur le volontariat des chercheurs qui souhaitent permettre une alternative à l'euthanasie des rats de laboratoire[120].
Annexes
Articles connexes
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (fr) Conseil canadien de protection des animaux (1984), Manuel sur le soin et l'utilisation des animaux d'expérimentation : XXI Les rats d'expérimentation, 31 pages.
- (en) Alison Abbott (2004), [Laboratory animals: The Renaissance rat], Nature 428, 464 (2004-04-01) ; doi:10.1038/428464a
- (en) [Choix d'études scientifiques ayant utilisé le rat comme support expérimental] (proposé par la revue Genome Research en , à titre d'exemples, à l'occasion de la publication du génome du rat)
- (en) Dycaico, MJ, Provost, GS, Kretz, PL, Ransom, SL, Moores, JC, and Short, JM (1994). The use of shuttle vectors for mutation analysis in transgenic mice and rats. Mutat Res 307, p. 461–478
Liens externes
- (en) Rat Genome Sequencing & Rat Genome Database (rgd.mcw.edu)
- (en) Nature: Rat Genome - Nature
- (en) Rat Genome Database
- (en) Charles River Laboratories
- (en) « Harlan Sprague Dawley »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) Jax Index of Inbred Rat Strains
- (en) Knock Out Rat Consortium - KORC database
Notes et références
- (en) George J. Krinke (Gillian R. Bullock (series ed.), Tracie Bunton (series ed.)), The Laboratory Rat (Handbook of Experimental Animals), Academic Press, , 3–16 p. (ISBN 0-124-26400-X), « History, Strains and Models »
- (en) Waterston RH, Lindblad-Toh K, Birney E, Rogers J, Abril JF, Agarwal P, Agarwala R, Ainscough R, Alexandersson M, et al., Initial sequencing and comparative analysis of the mouse genome. Mouse Genome Sequencing Consortium, Nature, 5 décembre 2002 ; 420(6915):520-62
- (en) Richard A. Gibbs & al., Genome sequence of the Brown Norway rat yields insights into mammalian evolution, Rat Genome Sequencing Project Consortium ; Nature 428, 493-521, 1er avril 2004, doi:10.1038/nature02426
- Le consortium « About the Project »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) réunit les laboratoires : Celera Genomics, Genome Therapeutics (now Oscient Pharmaceuticals), The Institute for Genome Research (aujourd'hui J. Craig Venter Institute), The University of Utah, le Children's Hospital Oakland Research Institute, le Medical College of Wisconsin, et le BC Genome Sciences Center
- (en) Sous-portail consacré au génome du rat - Nature
- « their rates of synonymous substitution are significantly different from the remaining genes » (voir article du journal Nature → citation suivante)
- (en) Shimoyama, Mary, et al, Using Multiple Ontologies to Integrate Complex Biological Data Comp Funct Genomics, octobre-décembre 2005, 6(7-8): pp. 373–378
- (en) A community view of progress and prospects in rat genetics - T. Aitman et al., Nat Genet, Nature, mai 2008 [PDF]
- GBrowse
- Donlin, M. (2007, March) The Bioperl toolkit: Perl modules for the life sciences Curr Protoc Bioinformatics.
- (en) Stein LD et al. (2002) The generic genome browser: a building block for a model organism system database. Genome Res 12: 1599-610
- (en) Infant Sleep: A Precursor to Adult Sleep? - PLoS Biology Vol. 3/5/2005, e168
- Karlsson KÆ, Gall AJ, Mohns EJ, Seelke AMH, Blumberg MS (2005) The Neural Substrates of Infant Sleep in Rats. PLoS Biol 3(5): e143. doi:10.1371/journal.pbio.0030143
- Catherine Solau Poissonnet, Principales maladies du lapin, du cobaye, du chinchilla, du hamster et du rat de compagnie, Maison-Alfort, Thèse de médecine vétérinaire (lire en ligne) [PDF]
- « Vidéo : l'école du rat »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- « Pavlov aux oubliettes »
- (en) « Lien web Causal reasoning in Rats » [PDF]
- Inbal Ben-Ami Bartal1, Jean Decety1,2,4, Peggy Mason (2011), "Report Empathy and Pro-Social Behavior in Rats" ; Science 9 December 2011: Vol. 334 no. 6061 pp. 1427-1430 DOI: 10.1126/science.1210789 (résumé)
- Emily Underwood (2015) Rats forsake chocolate to save a drowning companion; News du magazine Science ; 12 mai 2015, consulté 2015-05-14
- (en) Karn RC, Laukaitis CM, The roles of gene duplication, gene conversion and positive selection in rodent esp and mup pheromone gene families with comparison to the abp family ; PLoS One. 2012; 7(10):e47697. Epub 19 octobre 2012
- (en) Chen H, Hiler KA, Tolley EA, Matta SG, Sharp BM, Genetic factors control nicotine self-administration in isogenic adolescent rat strains ; PLoS One. 2012; 7(8):e44234. Epub 28 août 2012
- (en) Kuntz, C. et al. Comparison of laparoscopic versus conventional technique in colonic and liver resection in a tumor-bearing small animal model. Surg. Endosc. 16, 1175−1181 (2002)
- (en) Kitagawa, K., Hamada, Y., Nakai, K., Kato, Y. & Okumura, T. Comparison of one- and two-step procedures in a rat model of small bowel transplantation. Transplant. Proc. 34, 1030−1032 (2002)
- Sauve, Y., Girman, S. V., Wang, S., Keegan, D. J. & Lund, R. D. Preservation of visual responsiveness in the superior colliculus of RCS rats after retinal pigment epithelium cell transplantation. Neuroscience 114, 389−401 (2002)
- (en) Wang, H. et al. Attenuation of acute xenograft rejection by short-term treatment with LF15−0195 and monoclonal antibody against CD45RB in a rat-to-mouse cardiac transplantation model. Transplantation 75, 1475−1481 (2003)
- (en) Jin, X. et al. Effects of leptin on endothelial function with OB-Rb gene transfer in Zucker fatty rats. Atherosclerosis 169, 225−233 (2003)
- Ravingerova, T., Neckar, J. & Kolar, F. Ischemic tolerance of rat hearts in acute and chronic phases of experimental diabetes. Mol. Cell. Biochem. 249, 167−174 (2003)
- (en) Alves, A. et al. Total vascular exclusion of the liver enhances the efficacy of retroviral-mediated associated thymidine kinase and interleukin-2 genes transfer against multiple hepatic tumors in rats. Surgery 133, 669−677 (2003)
- Liu, M. Y., Poellinger, L. & Walker, C. L. Up-regulation of hypoxia-inducible factor 2alpha in renal cell carcinoma associated with loss of Tsc-2 tumor suppressor gene. Cancer Res. 63, pp. 2675−2680 (2003)
- (en) Smyth, M. D., Barbaro, N. M. & Baraban, S. C. Effects of antiepileptic drugs on induced epileptiform activity in a rat model of dysplasia. Epilepsy Res. 50, 251−264 (2002)
- (en) Taylor, J. R. et al. An animal model of Tourette's syndrome. Am. J. Psychiatry 159, 657−660 (2002)
- (en) Yang, T. D., Pei, J. S., Yang, S. L., Liu, Z. Q. & Sun, R. L. Medical prevention of space motion sickness−animal model of therapeutic effect of a new medicine on motion sickness. Adv. Space Res. 30, 751−755 (2002)
- (en) McBride, W. J. & Li, T. K. Animal models of alcoholism: neurobiology of high alcohol-drinking behavior in rodents. Crit. Rev. Neurobiol. 12, 339−369 (1998)
- (en) Forte, A. et al. Stenosis progression after surgical injury in Milan hypertensive rat carotid arteries. Cardiovasc. Res. 60, 654−663 (2003)
- Komamura, K. et al. Differential gene expression in the rat skeletal and heart muscle in glucocorticoid-induced myopathy: analysis by microarray. Cardiovasc. Drugs Ther. 17, 303−310 (2003)
- (en) McBride, M. W. et al. Functional genomics in rodent models of hypertension. J. Physiol. (Lond.) 554, 56−63 (2004)
- (en) Crisci, A. R. & Ferreira, A. L. Low-intensity pulsed ultrasound accelerates the regeneration of the sciatic nerve after neurotomy in rats. Ultrasound Med. Biol. 28, 1335−1341 (2002)
- (en) Ozkan, O. et al. Reinnervation of denervated muscle in a split-nerve transfer model. Ann. Plast. Surg. 49, 532−540 (2002)
- (en) Fray, M. J., Dickinson, R. P., Huggins, J. P. & Occleston, N. L. A potent, selective inhibitor of matrix metalloproteinase-3 for the topical treatment of chronic dermal ulcers. J. Med. Chem. 46, 3514−3525 (2003)
- (en) Petratos, P. B. et al. Full-thickness human foreskin transplantation onto nude rats as an in vivo model of acute human wound healing. Plast. Reconstr. Surg. 111, 1988−1997 (2003)
- Hussar, P. et al. Bone healing models in rat tibia after different injuries. Ann. Chir. Gynaecol. 90, 271−279 (2001)
- (en) Kasteleijn-Nolst Trenite, D. G. & Hirsch, E. Levetiracetam : preliminary efficacy in generalized seizures. Epileptic Disord. 5, S39−S44 (2003)
- (en) Malik, A. S. et al. A novel dehydroepiandrosterone analog improves functional recovery in a rat traumatic brain injury model. J. Neurotrauma 20, 463−476 (2003)
- (en) Kostrubsky, V. E. et al. Evaluation of hepatotoxic potential of drugs by inhibition of bile acid transport in cultured primary human hepatocytes and intact rats. Toxicol. Sci. 76, 220−228 (2003)
- (en) Lindon, J. C. et al. Contemporary issues in toxicology: the role of metabonomics in toxicology and its evaluation by the COMET project. Toxicol. Appl. Pharmacol. 187, 137−146 (2003)
- (en) Tam, R. C. et al. The ribavirin analog ICN 17261 demonstrates reduced toxicity and antiviral effects with retention of both immunomodulatory activity and reduction of hepatitis-induced serum alanine aminotransferase levels. Antimicrob. Agents Chemother. 44, 1276−1283 (2000)
- (en) Youssef, A. F., Turck, P. & Fort, F. L. Safety and pharmacokinetics of oral lansoprazole in preadolescent rats exposed from weaning through sexual maturity. Reprod. Toxicol. 17, 109−116 (2003
- (en) Jane M. Carlton & al., Genome sequence and comparative analysis of the model rodent malaria parasite Plasmodium yoelii yoelii ; plasmodium genomics ; journal Nature 419, 512-519 (3 October 2002) ; doi:10.1038/nature01099; résumé
- Le lieutenant colonel William F. Mac Kenzie, Lt. du Veterinary Pathology Branch USAF School of Aerospace Medicine, Brooks Air Force Base, Texas est l'un des premiers chercheurs à avoir repéré la propension d'une souche de rat à développer des tumeurs
- (en) Dann CT, Alvarado AL, Hammer RE, Garbers DL, « Heritable and stable gene knockdown in rats » Proc Natl Acad Sci U S A 2006;103(30):11246-51
- (en) Abbott A, Laboratory animals: the Renaissance rat, Nature, 2004, 428:464-466
- (en) Zhou Q, Renard JP, Le Friec G, Brochard V, Beaujean N, Cherifi Y, Fraichard A, Cozzi J, « Generation of fertile cloned rats by regulating oocyte activation » Science 2003, 302:1179
- (en) Justice MJ, Noveroske JK, Weber JS, Zheng B, Bradley A, « Mouse ENU mutagenesis » Hum Mol Genet. 1999, 8:1955-1963.
- (en) Kitada K, Ishishita S, Tosaka K, Takahashi R, Ueda M, Keng VW, Horie K, Takeda J, « Transposon-tagged mutagenesis in the rat » Nat Methods 2007, 4:131-133
- (en) Y Zan, JD Haag et al. (2003), « Production of knockout rats using ENU mutagenesis and a yeast-based screening assay » Nature, 2003 [PDF]
- (en) Smits BM, Mudde JB, van de Belt J, Verheul M, Olivier J, Homberg J, Guryev V, Cools AR, Ellenbroek BA, Plasterk RH, Cuppen E (2006) Generation of gene knockouts and mutant models in the laboratory rat by ENU-driven target-selected mutagenesis. Pharmacogenet Genomics 16:159–169.
- (en) Zan Y, Haag JD, Chen KS, Shepel LA, Wigington D, Wang YR, Hu R, Lopez-Guajardo CC, Brose HL, Porter KI, Leonard RA, Hitt AA, Schommer SL, Elegbede AF, Gould MN (2003) Production of knockout rats using ENU mutagenesis and a yeast-based screening assay. Nat Biotech 21:645–651.
- (en) Kobayashi T, Kato-Itoh M, Yamaguchi T, Tamura C, Sanbo M, Hirabayashi M, Nakauchi H. (2012). Identification of Rat Rosa26 Locus Enables Generation of Knock-in Rat Lines Ubiquitously Expressing tdTomato. Stem Cells Dev. 12 juin 2011 (résumé)
- Transgenesis Rats PlatForm - INSERM UMR 643, spécialisée dans la transgenèse chez le rat, tout en offrant des services de cryopréservation de lignées d'embryon, immunomonitoring et génotypage) produit à Nantes des rats transgéniques
- (en) Knockout rats via embryo microinjection of zinc-finger nucleases - Aaron M Geurts & al., Science, 2009, 15 pages [PDF]
- (en) Chu X, Zhang Z, Yabut J, Horwitz S, Levorse J, Li XQ, Zhu L, Lederman H, Ortiga R, Strauss J, Li X, Owens KA, Dragovic J, Vogt T, Evers R, Shin MK. 2012. Characterization of multidrug resistance 1a/P-glycoprotein knockout rats generated by zinc finger nucleases. Mol Pharmacol. 81(2):220-7
- (en) Sigma-Aldrich develops Parkinson's disease models - Laboratory Talk
- (en) Andrew Wiecek, Year of the rat, BioTechniques, 1er octobre 2009
- Bader M, Ganten D., Transgenic rats: tools to study the function of the renin-angiotensin system ; Clin Exp Pharmacol Physiol. 1996 Sep; 23 Suppl 3:S81-7
- Moreno C, Hoffman M, Stodola TJ, Didier DN, Lazar J, Geurts AM, North PE, Jacob HJ, Greene AS. 2011. Creation and characterization of a renin knockout rat. Hypertension. 57(3):614-9
- (en) Characterization of the serotonin transporter knockout rat : a selective change in the functioning of the serotonergic system - JR Homberg & al., Neuroscience 146, 2007, pp. 1662–1676, - Elsevier [PDF]
- (en) Homberg JR, Mul JD, de Wit E, Cuppen E. (2009) Complete knockout of the nociceptin/orphanin FQ receptor in the rat does not induce compensatory changes in mu, delta and kappa opioid receptors. Neuroscience. 163(1):308-15
- Directive du Conseil n° 86/609/CEE du 24, fixant des dispositions relatives à la protection des animaux de laboratoire utilisés à des fins expérimentales
- directive 2004/9/CE du Parlement européen et du Conseil du 11 février 2004 « concernant l'inspection et la vérification des bonnes pratiques de laboratoire » (BPL)
- l'arrêté du 5 septembre 1994 modifié fixant les normes et protocoles applicables aux essais analytiques, toxicologiques, pharmacologiques et cliniques en matière d'essais de médicaments vétérinaires ;
- Légifrance (Protection des animaux de laboratoire)
- Arrêté du 28 janvier 2005 relatif aux bonnes pratiques de laboratoire pour les médicaments vétérinaires et à leurs modalités d'inspection et de vérification ainsi qu'à la délivrance de documents attestant de leur respect, JORF n°43 du 20 février 2005 page 2888 texte n° 3
- (en) Hedrich, H. J. in History, Strains, and Models in the Laboratory Rat (ed. Krinke, G. J.) 3−16 (Academic, San Diego, 2000)
- (en) Lindsey, J. R. in The Laboratory Rat (eds Baker, H. J., Lindsey, J. R. & Weisbroth, S. H.) 1−36 (Academic, New York, 1979)
- (en) Greenhouse, D. D., Festing, M. F. W., Hasan, S. & Cohen, A. L. in Genetic Monitoring of Inbred Strains of Rats (ed. Hedrich, H. J.) 410−480 (Gustav Fischer, Stuttgart, 1990)
- (en) Rules and Guidelines for Nomenclature of Mouse and Rat Strains
- Outbred Stocks
- Sous-souches Wistar, caractéristiques et comportements
- (en) Clause, B. T. (1998), The Wistar Institute Archives: Rats (Not Mice) and History « Copie archivée » (version du 16 décembre 2006 sur l'Internet Archive) - Amphilsoc, Mendel Newsletter, février 1998
- « The Wistar Institute:History »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) - The Wistar Institute, 2007.
- Charles River, Animal Research River, consulté 5 août 2012.
- Aleman CL, Mas RM, Rodeiro I, Noa M, Hernandez C, M enendez R and Gamez R (1998), Reference database of the main physiological parameters in Sp rague-Dawley rats from 6 to 32 months. Laboratory Animals 32: 457-466
- Suzuki H, Mohr U, Kimmerle G., Spontaneous endocrine tumors in Sprague-Dawley rats ; J Cancer Res Clin Oncol. 1979 Oct; 95(2):187-96.
- Anisimov VN (1976), Spontaneous tumors in rats of different lines. [Article en russe], Vopr Onkol. 1976;22(8):98-110
- Muraoka Y, Itoh M, Yamashita F, Hayashi Y (1977), Spontaneous tumors in aged SD-JCL rats (author's transl) ; Jikken Dobutsu ; Jan 1977;26(1):13-22 (en japonais), résumé (anglais)
- (en) William F. Mac Kenzie (Lt. Colonel, USAF) et F. M. Garner, Colonel (Bionetics Research Laboratory, USA), « Comparison of Neoplasms in Six Sources of Rats » JNCI J Natl Cancer Inst. 1973;50(5):1243-1257. DOI:10.1093/jnci/50.5.1243 (résumé)
- Nakazawa M, Tawaratani T, Uchimoto H, Kawaminami A, Ueda M, Ueda A, Shinoda Y, Iwakura K, Kura K, Sumi N., Spontaneous neoplastic lesions in aged Sprague-Dawley rats. Exp Anim. 2001 Apr; 50(2):99-103
- Adler ES, Hollis JH, Clarke IJ, Grattan DR, Oldfield BJ. (2012), Neurochemical characterization and sexual dimorphism of projections from the brain to abdominal and subcutaneous white adipose tissue in the rat ; J Neurosci. 2012 Nov 7;32(45):15913-21. doi: 10.1523/JNEUROSCI.2591-12.2012 (résumé)
- P T SK, Lakshmanan VK, Raj M, Biswas R, Hiroshi T, Nair SV, Jayakumar R. (2012), Evaluation of Wound Healing Potential of β-Chitin Hydrogel/Nano Zinc Oxide Composite Bandage ; Pharm Res. 2012 Nov 8 (résumé)
- Werley MS, McDonald P, Lilly P, Kirkpatrick D, Wallery J, Byron P, Venitz (2011) Non-clinical safety and pharmacokinetic evaluations of propylene glycol aerosol in Sprague-Dawley rats and Beagle dogs. J. Toxicology. 2011 Sep 5; 287(1-3):76-90. Epub 2011 Jun 12 ()
- Soffritti M, Belpoggi F, Degli Esposti D, Lambertini L, Tibaldi E, Rigano A. (2006), First experimental demonstration of the multipotential carcinogenic effects of aspartame administered in the feed to Sprague-Dawley rats ; Environ Health Perspect. 2006 Mar; 114(3):379-85.
- l. Zutshi M, Salcedo LB, Zaszczurynski PJ, Hull TL, Butler RS, Damaser MS, Effects of sphincterotomy and pudendal nerve transection on the anal sphincter in a rat mode ; Dis Colon Rectum. 2009 Jul;52(7):1321-9 (résumé).
- Salcedo L, Damaser M, Butler R, Jiang HH, Hull T, Zutshi M., Long-term effects on pressure and electromyography in a rat model of anal sphincter injury ; Dis Colon Rectum. 2010 Aug;53(8):1209-17 (résumé).
- Electrical stimulation of anal sphincter or pudendal nerve improves anal sphincter pressure. Damaser MS, Salcedo L, Wang G, Zaszczurynski P, Cruz MA, Butler RS, Jiang HH, Zutshi M. Dis Colon Rectum. 2012 Dec;55(12):1284-94. doi: 10.1097/DCR.0b013e31826ae2f8.
- Wang ML, Massie J, Perry A, Garfin SR, Kim CW (2007), A rat osteoporotic spine model for the evaluation of bioresorbable bone cements ; Spine J. 2007 Jul-Aug;7(4):466-74. Epub 2007 Apr 6. (résumé)
- Cho JH, Cho DC, Yu SH, Jeon YH, Sung JK, Kim KT (2012), Effect of dietary calcium on spinal bone fusion in an ovariectomized rat model ; J Korean Neurosurg Soc. 2012 Oct;52(4):281-7. doi: 10.3340/jkns.2012.52.4.281. Epub 2012 Oct 22 (résumé).
- Gala J, Díaz-Curiel M, de la Piedra C, Calero J (2001), Short- and long-term effects of calcium and exercise on bone mineral density in ovariectomized rats ; Br J Nutr. 2001 Oct;86(4):521-7 (résumé).
- (en) « 43rd Annual Pathology of Laboratory Animals Course »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) - AAFIP.
- (en) Mordes JP, Poussier P, Blankenhorn EP, Greiner DL: Rat models of type 1 diabetes: Genetics, environment and autoimmunity. Boca Raton, CRC Press, 2007
- « Rat LONG EVANS », sur Janvier-Labs (consulté le )
- (en) Kurtz TW & al., 1989, « The Zucker fatty rat as a genetic model of obesity and hypertension »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) ; Hypertension, ed: American Heart Association, Dallas, Texas ; volume=13; Issue=6, pages=896–901, (ISSN 1524-4563) consulté 2008-12-06 ; [PDF]
- (en) Amy J. Davis, « The Heart of a Zucker », Research PennState, vol. 18, no 1, (lire en ligne, consulté le )
- (en) Takaya K, Ogawa Y, Isse N, Okazaki T, Satoh N, Masuzaki H, Mori K, Tamura N, Hosoda K, Nakao K., « Molecular cloning of rat leptin receptor isoform complementary DNAs--identification of a missense mutation in Zucker fatty (fa/fa) rats », Biochem Biophys Res Commun., vol. 225, no 1, , p. 75–83 (PMID 8769097, DOI 10.1006/bbrc.1996.1133)
- Kava, Ruth, M. R. C. Greenwood et P. R. Johnson (1990), « Zucker (fa/fa) Rat »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), ILAR Journal, Ed:Institute for Laboratory Animal Research, volume=32, issue=3,consulté 2008-12-06
- (en) Kim H, Panteleyev AA, Jahoda CA, Ishii Y, Christiano AM. Genomic organization and analysis of the hairless gene in four hypotrichotic rat strains. Mamm Genome. 15 décembre 2004 (12):975–81
- (en) Festing MFW, D May, TA Connors, D Lovell, S Sparrow. 1978. An athymic nude mutation in the rat, Nature, 274, pp. 365–366
- Ferguson, Frederick G., et al. (1979). Three Variations of Hairlessness Associated with Albanism in the Laboratory Rat. Laboratory Animal Science, vol. 29, pp. 459–465.
- Moemeka, A. N., Hildebrandt, A.L., Radaskiewicz, P., & King, T. R. (1998). Shorn (shn): a new mutation causing hypotrichosis in the Norway rat. The Journal of Heredity, 89, 257–260.
- (en) D'Cruz PM, Yasumura D, Weir J, Matthes MT, Abderrahim H, LaVail MM, Vollrath D, Mutation of the receptor tyrosine kinase gene Mertk in the retinal dystrophic RCS rat ; Human Molecular Genetics, 2000, volume=9, pp645–651 ; ; doi=10.1093/hmg/9.4.645; issue=4
- (en) Aikawa H, Nonaka I, Woo M, Tsugane T, Esaki K. (1988) Shaking rat Kawasaki (SRK): a new neurological mutant rat in the Wistar strain Acta Neuropathol (Berl). 1988;76(4):366–72. [PDF]
- Kikkawa S, Yamamoto T, Misaki K, Ikeda Y, Okado H, Ogawa M, Woodhams PL, Terashima T. (2003) Missplicing resulting from a short deletion in the reelin gene causes reeler-like neuronal disorders in the mutant shaking rat Kawasaki. J Comp Neurol. 2003 Aug 25;463(3):303–15.
- (en) Genome project - ensemble.org
- (en) Guidelines for Selecting Route and Needle Size - Duke University and Medical Center - Animal Care & Use Program
- (en) Consensus Documents for the Work on the Safety of Novel Foods and Feeds (« Documents de consensus pour les travaux sur la sécurité des nouveaux aliments ») - OCDE
- Laboratoires Harlan, « Fiche des bouchons 2014 Teklad Global 14 % » [PDF]
- « L'alimentation », sur http://lord-rat.org/Ratibus
- « Le Graal - Qui sommes nous ? », sur www.graal-defenseanimale.org (consulté le )
- « Le projet – White Rabbit » (consulté le )
- Par Axelle Playoust-Braure Le 14 juin 2022 à 11h00, « La retraite des animaux de laboratoire, une issue heureuse... mais exceptionnelle », sur leparisien.fr, (consulté le )
- « Adoption : sauvez un animal de laboratoire de l'euthanasie », sur ConsoGlobe, (consulté le )
- Portail des animaux de compagnie
- Portail des mammifères
