Dapagliflozine
La dapagliflozine est une molécule de la classe des gliflozines. Développée initialement comme un médicament antidiabétique, elle est aussi utilisée en Europe et aux Etats-Unis depuis fin 2020 dans l'insuffisance cardiaque et dans l'insuffisance rénale[3],[4]. Elle est commercialisée en France sous le nom de Forxiga par le groupe AstraZeneca.
| Dapagliflozine | |
| |
| Identification | |
|---|---|
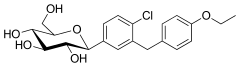
| Nom systématique | (2S,3R,4R,5S,6R)-2-[4-chloro-3-[(4-éthoxyphényl)méthyl]phényl]-6-(hydroxyméthyl)oxane-3,4,5-triol |
| No CAS | |
| No ECHA | 100.167.331 |
| Code ATC | |
| DrugBank | DB06292 |
| PubChem | 9887712 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C21H25ClO6 |
| Masse molaire[1] | 408,873 ± 0,022 g/mol C 61,69 %, H 6,16 %, Cl 8,67 %, O 23,48 %, |
| Propriétés physiques | |
| T° fusion | 65 °C[2] |
| T° ébullition | 609 °C[2] |
| Précautions | |
| SGH | |
   |
|
| Écotoxicologie | |
| LogP | 2,7[2] |
| Données pharmacocinétiques | |
| Biodisponibilité | 78%[2] |
| Liaison protéique | 91%[2] |
| Demi-vie d’élim. | 13,8 h[2] |
| Excrétion |
urine (75,2%), fécès (21%)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Dans le diabète
Le dapagliflozine est utilisé avec un régime et des exercices physiques pour maitriser la glycémie chez les diabétiques de type 2 et pour réduire le risque d'hospitalisation pour crises cardiaques chez les adultes diabétiques de type 2 et les patients sujets de maladies cardiovasculaires et d'autres facteurs de risques.[5],[6]
En 2012, le dapagliflozine a été approuvé par l'Agence européenne des médicaments (EMA)[7] alors qu'aux Etats-Unis, il a été refusé par la FDA en 2012[8] en raison de doutes d'effets secondaires mais autorisé par la suite pour le diabète en 2014[9],[10] puis étendu pour l'insuffisance rénale et les problèmes cardiaques en 2020[11].
Dans l'Union Européenne, la dapagliflozine est indiqué pour les adultes :
- pour le traitement du diabète de type 2 insuffisamment contrôlé en complément d'un régime et de l'exercice :
- en monothérapie quand la metformine est inappropriée pour cause d'intolérance
- en plus d'autres médicaments pour le traitement du diabète de type 2
- pour le traitement du diabète de type 1 insuffisamment contrôlé en complément de l'insuline chez les patients ayant un IMC ≥ 27 kg/m2, lorsque l'insuline seule ne permet pas un contrôle glycémique adéquat malgré une insulinothérapie optimale
- pour le traitement de l'insuffisance cardiaque à fraction d'éjection réduite.[12]
Dans l'insuffisance cardiaque
Il permet la diminution du risque d'aggravation et de mortalité chez les patients porteurs d'une insuffisance cardiaque, même en l'absence de diabète[13]. Les symptômes sont également améliorés[14] avec , notamment, une amélioration de la qualité de vie[15], et une diminution des troubles du rythme ventriculaire graves[16]. Ces effets sont retrouvés dans toutes les tranches d'âge[17].
Il diminue également le risque de survenue d'une fibrillation atriale ou d'un flutter[18].
Le le Comité des médicaments à usage humain de l’EMA adopte un avis positif recommandant l’extension d’indication de la dapagliflozine dans l’insuffisance cardiaque chronique symptomatique avec une fraction d'éjection réduite[19]. L’autorisation de mise sur le marché (AMM) repose sur les résultats de l’étude de phase 3 internationale DAPA-HF (4 742 patients dans 410 sites sur 20 pays)[20].
Dans l'insuffisance rénale
En avril 2021, la FDA a élargi l'indication de la dapagliflozine pour réduire le risque de dysfonction rénale, d'insuffisance rénale, de décès cardiovasculaire et d'hospitalisation pour insuffisance cardiaque chez les adultes atteints d'insuffisance rénale chronique qui présentent un risque de progression de la maladie.[10] L'efficacité de la dapagliflozine pour améliorer les bilans rénaux et réduire la mortalité cardiovasculaire chez les personnes atteintes d'insuffisance rénale chronique a été confirmée grâce à une étude multicentrique en double aveugle portant sur 4304 participants.[21]
Mécanisme d'action
La dapagliflozine inhibe le cotransporteur sodium-glucose 2 (SGLT2) qui est principalement situé dans le tubule proximal du néphron[2]. Le SGLT2 facilite 90 % de la résorption du glucose dans les reins, et son inhibition permet donc l'excrétion du glucose dans l'urine. Cette excrétion permet un meilleur contrôle de la glycémie et potentiellement une perte de poids chez les patients atteints de diabète sucré de type 2.
Métabolisme
La dapagliflozine est principalement glucuronidée pour devenir un métabolite 3-O-glucuronide inactif (60,7%). La dapagliflozine produit aussi d'autres métabolite glucoronidés mineurs (5,4%), un métabolite déséthylé (< 5%), et un métabolite hydroxyé (< 5%). Le métabolisme de la dapagliflozine est médié par les cytochromes P450 CYP1A1, CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP3A4 et les uridine diphosphate glucuronyltransférases UGT1A9, UGT2B4 et UGT2B72. La glucuronidation du principal métabolite est médiée par l'UGT1A9[2].
Effets secondaires
Étant donné que la dapagliflozine entraîne une glycosurie importante (parfois jusqu'à environ 70 grammes par jour), elle peut entraîner une perte de poids rapide et de la fatigue. Le glucose agit comme un diurétique osmotique qui peut conduire à la déshydratation. L'augmentation de la quantité de glucose dans les urines peut également aggraver les infections déjà associées au diabète, en particulier les infections des voies urinaires et la candidose.
À la suite de la remontée de cas de pharmacovigilance, un risque fréquent d'acidocétose diabétique chez les diabétiques de type 1[22] et un risque rare mais sérieux de gangrène de Fournier (fasciite nécrosante périnéale)[23] en association avec la prise de dapagliflozine ont été démontrés en 2016 et 2018 par l'Agence européenne des médicaments (EMA). Dans un courrier, l’Agence nationale de sécurité du médicament et des produits de santé, comme l’avait fait avant elle la Food and Drug Administration (FDA)[24], prévient les professionnels de santé de ces risques afin de pouvoir en informer les patients(ANSM)[25].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- fiche Drugbank
- NEJM September 24, 2020 DOI: 10.1056/NEJMoa2024816 https://www.nejm.org/doi/full/10.1056/NEJMoa2024816?query=TOC
- « FDA Approves Treatment for Chronic Kidney Disease », sur U.S. Food and Drug Administration (FDA), (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public.
Cet article reprend du texte de cette source, qui est dans le domaine public. - « FDA Approves Farxiga to Treat Type 2 Diabetes » [archive du ], U.S. Food and Drug Administration (FDA), (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public.
Cet article reprend du texte de cette source, qui est dans le domaine public. - « FDA approves new treatment for a type of heart failure », sur U.S. Food and Drug Administration (FDA), (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public.
Cet article reprend du texte de cette source, qui est dans le domaine public. - (en) European Medicines Agency, Forgixa
- (en) Burki TK, « FDA rejects novel diabetes drug over safety fears » Lancet, 2012;379:507.
- « Drug Approval Package: Farxiga (dapagliflozin) Tablets NDA #202293 », sur U.S. Food and Drug Administration (FDA), (consulté le )
- « FDA Approves Treatment for Chronic Kidney Disease », sur U.S. Food and Drug Administration (FDA), (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public.
Cet article reprend du texte de cette source, qui est dans le domaine public. - « FDA approves new treatment for a type of heart failure », sur U.S. Food and Drug Administration (FDA), (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public.
Cet article reprend du texte de cette source, qui est dans le domaine public. - « Forxiga EPAR », sur European Medicines Agency (EMA) (consulté le ) Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- (en) McMurray JJV, Solomon SD, Inzucchi SE et al. « Dapagliflozin in patients with heart failure and reduced ejection fraction » N Engl J Med, 2019;381:1995-2008.
- (en) Nassif ME, Windsor SL, Tang F et al. « Dapagliflozin effects on biomarkers, symptoms, and functional status in patients With heart failure with reduced ejection fraction, The DEFINE-HF Trial », Circulation, 2019;140:1463–76.
- (en) Kosiborod MN, Jhund P, Docherty K et al. « Effects of dapagliflozin on symptoms, function and quality of life in patients with heart failure and reduced ejection fraction: results from the DAPA-HF Trial » Circulation. 2020;141:90–9.
- Curtain JP, Docherty KF, Jhund PS et al. Effect of dapagliflozin on ventricular arrhythmias, resuscitated cardiac arrest, or sudden death in DAPA-HF, Eur Heart J, 2021;42:3727–3738
- (en) Martinez FA, Serenelli M, Nicolau JC et al. « Efficacy and safety of dapagliflozin in HFrEF according to age: insights from DAPA-HF » Circulation. 2020;141:100–11.
- (en) Zelniker TA, Bonaca MP, Furtado RHM et al. « Effect of dapagliflozin on atrial fibrillation in patients with type 2 diabetes mellitus: insights from the DECLARE-TIMI 58 trial » Circulation. 2020;141:1227–34.
- (en) « Forxiga », Opinion, sur www.ema.europa.eu, European Medicines Agency, (consulté le ).
- (en) Mark C. Petrie, Subodh Verma, Kieran F. Docherty et Silvio E. Inzucchi, « Effect of Dapagliflozin on Worsening Heart Failure and Cardiovascular Death in Patients With Heart Failure With and Without Diabetes », JAMA, vol. 323, no 14, , p. 1353 (ISSN 0098-7484, PMID 32219386, PMCID PMC7157181, DOI 10.1001/jama.2020.1906, lire en ligne, consulté le )
- « FDA Approves Treatment for Chronic Kidney Disease », sur U.S. Food and Drug Administration (FDA), (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public.
Cet article reprend du texte de cette source, qui est dans le domaine public. - Paresh Dandona, Chantal Mathieu, Moshe Phillip, Lars Hansen, Diethelm Tschöpe, Fredrik Thorén, John Xu, Anna Maria Langkilde et DEPICT-1 Investigators, « Efficacy and Safety of Dapagliflozin in Patients with Inadequately Controlled Type 1 Diabetes: The DEPICT-1 52-Week Study », Diabetes Care, vol. 41, no 12, , p. 2552–2559 (PMID 30352894, DOI 10.2337/dc18-1087
 , S2CID 53027785)
, S2CID 53027785) - Yang Hu, Ziyu Bai, Yan Tang, Rongji Liu, Bin Zhao, Jian Gong et Dan Mei, « Fournier Gangrene Associated with Sodium-Glucose Cotransporter-2 Inhibitors: A Pharmacovigilance Study with Data from the U.S. FDA Adverse Event Reporting System », Journal of Diabetes Research, vol. 2020, , p. 1–8 (PMID 32695827, PMCID 7368210, DOI 10.1155/2020/3695101
 )
) - (en) Susan J. Bersoff-Matcha, Christine Chamberlain, Christian Cao et Cindy Kortepeter, « Fournier Gangrene Associated With Sodium–Glucose Cotransporter-2 Inhibitors: A Review of Spontaneous Postmarketing Cases », Annals of Internal Medicine, vol. 170, no 11, , p. 764 (ISSN 0003-4819, DOI 10.7326/M19-0085, lire en ligne, consulté le ).
- « Forxiga® 10 mg (dapagliflozine), Xigduo® (dapagliflozine/metformine) : Recommandations pour prévenir les risques d’acidocétose diabétique et de gangrène de Fournier (fasciite nécrosante périnéale) - Lettre aux professionnels de santé - ANSM : Agence nationale de sécurité du médicament et des produits de santé », sur www.ansm.sante.fr (consulté le )
- Portail de la médecine
- Portail de la pharmacie
- Portail de la biochimie