Flutter atrial
Le flutter atrial est un trouble du rythme supraventriculaire caractérisé par une suite de contractions cardiaques se succédant très rapidement, responsable d'une tachycardie soit régulière soit irrégulière, en fonction de la réponse ventriculaire. Il est caractérisé par un aspect bien particulier de la ligne de base sur l'électrocardiogramme (en « dents de scie » ou en « toit d'usine »).
Pour les articles homonymes, voir Flutter (homonymie).
| Flutter atrial | |
| Classification et ressources externes | |
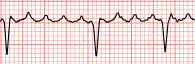 Flutter atrial avec conduction atrio-ventriculaire variable | |
Historique
Le terme a été employé pour la première fois par John McWiiliam en 1887 pour décrire l'aspect d'une oreillette isolée stimulée par un courant électrique[1]. L'aspect électrocardiographique est décrit en 1910[2] et le mécanisme de réentrée circulaire suspecté dix ans plus tard[3].
Physiopathologie
La contraction cardiaque normale provient d'une dépolarisation (inversion de la polarité électrique de la membrane cellulaire) cyclique d'un groupe de cellules situées sur la partie haute d'une oreillette (la droite le plus souvent), le nœud sinusal. Cette dépolarisation se propage de haut en bas et de proche en proche, en direction du nœud atrioventriculaire (il n'existe pas de voie de conduction spécialisée au niveau des oreillettes, contrairement aux ventricules cardiaques).
Dans certains cas, cette activité électrique peut boucler sur elle-même, c'est-à-dire que le courant va descendre de l'oreillette par un circuit A puis se diviser en deux, un courant qui continue à descendre en direction des ventricules et un deuxième courant qui remonte en sens inverse par un circuit B en direction de l'oreillette, installant ainsi une boucle électrique, puisque ce second courant pourra à nouveau redescendre par le circuit A. On parle alors de ré-entrée permettant la pérennisation du trouble rythmique atrial. Ce circuit emprunte une grande partie de l'oreillette droite et passe, le plus souvent, par l'isthme cavo-tricuspide, partie se situant entre la partie basse de la valve tricuspide (séparant l'oreillette droite du ventricule droit) et la jonction entre la veine cave inférieure et cette même oreillette[4]. Il existe cependant des circuits plus atypiques, notamment après chirurgie correctrice d'une anomalie congénitale intéressant les oreillettes ou après une isolation des veines pulmonaires par radiofréquence pour une fibrillation auriculaire.
Il va être responsable d'une activité (contraction) régulière et rapide des oreillettes (250 à 300 par minute). La transmission de l'influx électrique vers les ventricules se fait par l'intermédiaire du nœud atrioventriculaire, ce dernier faisant office de filtre et ne laissant pas passer l'intégralité des signaux, ce qui explique que le rythme ventriculaire peut être régulier ou irrégulier : en règle générale, chez le patient sans traitement, la conduction se fait en 2 pour 1 (deux contractions atriales entraînant une contraction ventriculaire). On parle alors de flutter 2/1 et le rythme ventriculaire est entre 125 et 150/min. Si le nœud atrioventriculaire est défaillant ou si un traitement est administré, la conduction peut être altérée avec un aspect de flutter 4/1 (contractions ventriculaires régulières) ou dite à conduction variable (En fait, il existe toujours une certaine régularité de conduction, expliquée par le phénomène Wenckebach alterne).
La contraction rapide des oreillettes, même si elle est moindre que lors d'une fibrillation atriale, entraîne une perte de l'efficacité de la contraction atriale avec une diminution du débit cardiaque, une stagnation du sang dans les oreillettes avec un risque de formation de caillots (thrombus) dans ces cavités et au-delà le risque thromboembolique, notamment d'accident vasculaire cérébral.
Épidémiologie
Son incidence est près de dix fois inférieure à celle de la fibrillation atriale[5], et comme elle, elle tend à croître avec l'âge[6]. Elle est plus fréquente chez l'homme[6]. Une fibrillation atriale se développe chez plus de la moitié des patients ayant fait un épisode de flutter[7]. Même en cas d'ablation réussie du flutter, le risque de survenue d'une fibrillation dans les suites reste élevé[8].
Diagnostic
Signes fonctionnels
Le patient peut être totalement asymptomatique (il ne présente aucun signe clinique). Il peut ressentir des palpitations, se plaindre d'une fatigue (asthénie), de malaises (lipothymies), d'une gêne respiratoire (dyspnée), d'une douleur thoracique (angor fonctionnel), d'angoisse.
Examen clinique
L'auscultation retrouve un rythme cardiaque rapide, régulier ou irrégulier. On recherchera des signes d'insuffisance cardiaque.
Il peut être reconnu sur la dissociation radio-jugulaire : les battements jugulaires (contraction auriculaire) sont plus rapides que le pouls radial (contraction ventriculaire).
Électrocardiogramme
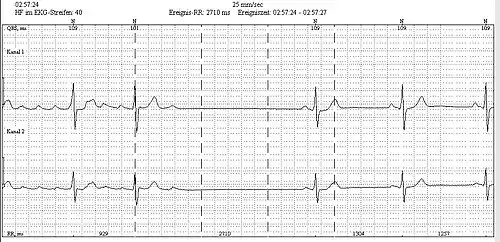
L'électrocardiogramme montre un aspect caractéristique : Les ondes P (témoin de la systole atriale) sont en « dents de scie », identiques et régulières, diphasiques (dont la phase négative prédomine : on parle alors d'onde F) et plus nettement marquées dans les dérivations D2, D3 et aVf. C'est l'aspect communément appelé « typique »[9].
L'aspect en est proche de celui de la tachysystolie atriale : dans ce dernier cas, l'activité atriale est également régulière, mais plus visible en V1-V2 et il n'existe pas cet apparence en « dents de scie ». La différence n'est cependant pas formelle et le diagnostic est porté parfois uniquement lors d'une exploration électrophysiologique[5].
Le flutter atrial doit être distingué de la fibrillation atriale, cette dernière montrant, sur l'ECG, une activité atriale complètement anarchique.
Au niveau des ventricules cardiaques, le rythme est d'environ 150 par minute en cas d'un flutter 2/1, la réponse ventriculaire pouvant être variable d'un cycle à l'autre. Les complexes QRS sont fins (sauf en cas de bloc de branche préexistant où ils sont larges). La fréquence rapide des QRS peut masquer les ondes P, rendant le diagnostic moins aisé. Toute manœuvre (en particulier vagale) permettant de ralentir le rythme ventriculaire permet alors de démasquer les ondes F du flutter, ainsi que les tests pharmacologiques type adénosine triphosphate. Cependant ce dernier peut faciliter, par un possible effet de rebond, la conduction atrio-ventriculaire, avec survenue d'un flutter 1/1 beaucoup plus mal toléré[10].
En dehors des crises (flutter paroxystique), l'ECG est normal.
Autres examens
- Échographie cardiaque pour aider à la recherche d'une maladie cardiaque sous-jacente.
- Le holter cardiaque, enregistrement électrocardiographique sur 24 h, peut être intéressant en cas de flutter paroxystique.
Causes
Le flutter atrial peut avoir :
- une origine cardiaque : cardiopathies (ischémiques, valvulopathie mitrale, embolie pulmonaire (cœur pulmonaire chronique), myocardite, séquelle post-opératoire, malformation congénitale) ;
- être due à un désordre métabolique, notamment une hypokaliémie ;
- être secondaire à une hyperthyroïdie ;
- être lié à la prise de certains médicaments.
À noter qu'il est souvent idiopathique (aucune cause trouvée).
Traitement
La prise en charge du flutter atrial a fait l'objet de la publication de recommandations. Celles, américaines, datent de 2015[11]. Celles, européennes, datent de 2019[12].
Il a pour but de ralentir le rythme cardiaque, de réduire le trouble du rythme (rétablir un rythme sinusal normal), de maintenir le rythme sinusal une fois celui-ci rétabli et d'éviter les complications emboliques grâce aux anticoagulants systématiques.
Ralentir le rythme cardiaque
On peut utiliser des bradycardisants de type bêta-bloquants ou inhibiteurs calciques bradycardisants, et plus rarement l'amiodarone, notamment en intraveineux lorsque le rythme est dangereusement élevé et mal toléré. Ce ralentissement n'est pas toujours aisé à obtenir[12].
La réduction du flutter
Elle peut être obtenue par l'administration de médicaments antiarythmiques, par choc électrique externe ou par stimulation atriale rapide ("overdrive"). Elle doit toujours être tentée après mise sous traitement anticoagulant efficace en raison du risque thromboembolique. Il faut toujours vérifier la correction des troubles métaboliques avant réduction.
- réduction médicamenteuse : utilisation d'antiarythmiques de type amiodarone, du dofétilide[13], de l'ibutilide[14],
- réduction électrique (défibrillation) sous anesthésie générale brève ; les médicaments digitaliques devant être arrêtés depuis plus de 48 heures.
- L'overdrive est faite par stimulation électrique rapide des oreillettes (à une fréquence dépassant celle du flutter), soit par voie endocavitaire, en positionnant une sonde sous contrôle radiographique, au contact de la paroi de l'oreillette droite (par exemple, par ponction de la veine fémorale et montée par la veine cave inférieure), soit par voie trans-œsophagienne (on fait alors avaler l'extrémité d'une sonde souple au patient, cette dernière étant positionnée, sous contrôle électrocardiographique, au niveau de l'oreillette gauche).
- une ablation par radiofréquence d'une partie du circuit de ré-entrée (le plus souvent au niveau de l'isthme cavo-tricuspide, partie la plus étroite de la réentrée) permet le retour à un rythme sinusal et la prévention des récidives dans un même temps
Prévention des récidives
Si le flutter est typique et isolé (sans fibrillation atriale associé), on peut proposer, en première intention, une ablation par radiofréquence[15] : au cours d'une exploration électrophysiologique, on créé une lésion cicatricielle de faible profondeur mais faisant barrage à la réentrée au niveau de l'isthme cavo-tricuspide. Le succès de la procédure dépasse 90 % avec un faible taux de complications[4]. En cas de flutter atypique, une cartographie tridimensionnelle de l'activité électrique de l'oreillette en tachycardie peut être nécessaire.
Dans les autres cas (ou en cas d'échec de l'ablation) un traitement médicamenteux anti-arythmique peut être prescrit. L'utilisation de la flécaïne donné seul expose cependant au risque de survenue d'un flutter 1/1 par ralentissement de la fréquence du flutter. Elle est, pour cela, prescite en association avec un bêta-bloquant[12]. Le sotalol peut être aussi utilisé[16] ainsi que l'amiodarone.
Prévention des complications emboliques
L'anticoagulation est systématique hors contre-indication majeure car l'accident vasculaire-cérébral est la principale complication redoutée pour les troubles du rythme supraventriculaires. Le risque semble être le même que lors d'une fibrillation atriale[5] même si le niveau de preuve est plus faible, l'incidence de ce trouble rythmique étant bien moindre.
Au début, un traitement anticoagulant par héparine (héparine standard en intraveineux ou en sous-cutané ou héparines de bas poids moléculaire en sous-cutané) est instauré. Ce traitement est relayé par une anticoagulation par voie orale utilisant les antivitamines K (AVK) ou les nouveaux anticoagulants oraux (par exemple dabigatran, apixaban, rivaroxaban)
La poursuite au long cours d'une anticoagulation efficace sera discutée au cas par cas en fonction du score de risque embolique et du score de risque de saignement HAS BLED. On note toutefois que le risque embolique est inférieur à celui de la fibrillation atriale[17].
Évolution et complications
Évolution
Sous traitement, restauration habituelle du rythme sinusal. Il existe deux formes évolutives possibles :
- le flutter chronique, responsable de l'apparition d'une insuffisance cardiaque,
- le flutter paroxystique, en règle générale bien toléré, d'apparition imprévisible.
Il est assez fréquemment associé à une fibrillation atriale[18] et le traitement par ablation n'empêche pas la récidive sous forme de fibrillation[19].
Complications
En cas de mauvaise tolérance du flutter, il peut entraîner un œdème aigu pulmonaire, une insuffisance cardiaque aigüe. En dehors de cela, le flutter peut être la cause d'une cardiomyopathie, dite rythmique, avec altération de la fonction systolique[20].
Dans le flutter, comme dans la fibrillation atriale, il n'y a pas de contraction efficace des oreillettes, entraînant une stagnation du sang dans ces cavités cardiaques, stase menant à la formation de thrombus (caillots sanguins). Ainsi, à partir du cœur gauche, un thrombus peut potentiellement emboliser principalement vers le cerveau, entraînant un accident vasculaire cérébral ischémique, mais également vers d'autres parties du corps : ischémie de membre, ischémie mésentérique, infarctus rénal...
La mort subite n'est pas directement associée au flutter atrial. Cependant, chez les individus porteurs d'une voie accessoire telle que le faisceau de Kent dans le Syndrome de Wolff-Parkinson-White, la voie accessoire peut conduire l'activité électrique des oreillettes aux ventricules beaucoup plus rapidement que le nœud atrioventriculaire. Dans ce cas, le rythme des oreillettes est de 300 battements par minute et mènera à un rythme ventriculaire de 300 battements par minute. Les ventricules, incapables de soutenir une tachycardie ventriculaire à un tel niveau, entreront en fibrillation, qui mènera rapidement à un collapsus et au décès.
Références
- McWilliam JA, Fibrillar contraction of the heart, J Physiol, 1887;8:296–310
- Jolly WA, Ritchie WT, Auricular flutter and fibrillation, Heart, 1910;2:177–221
- Lewis T, Observations upon flutter and fibrillation; Part IX. The nature of auricular fibrillation as it occurs in patients, Heart, 1921;8:341–345
- Lee G, Sanders P, Kalman JM, Catheter ablation of atrial arrhythmias: state of the art, Lancet, 2012;380:1509-1519
- Bun SS, Latcu DG, Marchlinski F, Saoudi N, Atrial flutter: more than just one of a kind , Eur Heart J, 2015;36:2356-2363
- Granada J, Uribe W, Chyou PH et al. Incidence and predictors of atrial flutter in the general population, J Am Coll Cardiol, 2000;36:2242–2246
- Halligan SC, Gersh BJ, Brown RD Jr. et al. The natural history of lone atrial flutter, Ann Intern Med, 2004;140:265–268
- Voight J, Akkaya M, Somasundaram P, Karim R, Valliani S, Kwon Y, Adabag S, Risk of new-onset atrial fibrillation and stroke after radiofrequency ablation of isolated, typical atrial flutter, Heart Rhythm, 2014;11:1884–1889
- Puech P, Latour H, Grolleau R, [Le flutter et ses limites, Arch Mal Cœur Vaiss, 1970;63:116–144
- Brodsky MA, Allen BJ, Grimes JA, Gold C, Enhanced atrioventricular conduction during atrial flutter after intravenous adenosine, N Engl J Med, 1994;330:288-289
- Page RL, Joglar JA, Caldwell MA et al. 2015 ACC/AHA/HRS Guideline for the Management of Adult Patients With Supraventricular Tachycardia: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society, Circulation, 2016;133:e506-e574
- Brugada J, Katritsis DG, Arbelo et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardia The Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC): Developed in collaboration with the Association for European Paediatric and Congenital Cardiology (AEPC), Eur Heart J, 2020;41:655-720
- Falk RH, Pollak A, Singh SN, Friedrich T, Intravenous dofetilide, a class III antiarrhythmic agent, for the termination of sustained atrial fibrillation or flutter, J Am Coll Cardiol, 1997;29:385-90
- Stambler BS, Wood MA, Ellenbogen KA, Perry KT, Wakefield LK, VanderLugt JT, Efficacy and safety of repeated intravenous doses of ibutilide for rapid conversion of atrial flutter or fibrillation, Circulation, 1996;94:1613-21
- Natale A, Newby KH, Pisano E et al. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter, J Am Coll Cardiol, 2000;35:1898-1904
- Benditt DG, Williams JH, Jin J et al. Maintenance of sinus rhythm with oral d,l-sotalol therapy in patients with symptomatic atrial fibrillation and/or atrial flutter, Am J Cardiol, 1999;84:270-7
- Lin YS, Chen YL, Chen TH et al. Comparison of Clinical Outcomes Among Patients With Atrial Fibrillation or Atrial Flutter Stratified by CHA2DS2-VASc Score, JAMA Netw Open, 2018;1:e180941
- Waldo AL, Feld GK, Inter-relationships of atrial fibrillation and atrial flutter mechanisms and clinical implications, J Am Coll Cardiol, 2008;51:779-786
- Moubarak G, Pavin D, Laviolle B et al. Incidence of atrial fibrillation during very long-term follow-up after radiofrequency ablation of typical atrial flutter, Arch Cardiovasc Dis, 2009;102:525-532
- Pizzale S, Lemery R, Green MS, Gollob MH, Tang AS, Birnie DH, Frequency and predictors of tachycardia-induced cardiomyopathy in patients with persistent atrial flutter, Can J Cardiol, 2009;25:469-72
- Portail de la médecine