Delphinidine
La delphinidine ou delphinidol est un composé organique naturel de la famille des anthocyanidols. Ses formes glycosylées constituent des pigments végétaux allant du bleu au rouge et ayant une activité antioxydante[2] notable.
| Delphinidine | |
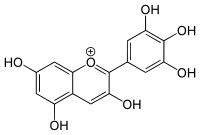
| |
| Structure de la delphinidine | |
| Identification | |
|---|---|
| Nom UICPA | 3,5,7-trihydroxy-2-(3,4,5-trihydroxyphényl)chroménium |
| No CAS | (HCl) |
| No ECHA | 100.007.671 |
| No CE | 208-437-0 (HCl) |
| No E | E163b |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C15H11O7 |
| Masse molaire[1] | 303,243 6 ± 0,014 9 g/mol C 59,41 %, H 3,66 %, O 36,93 %, |
| Propriétés physiques | |
| T° fusion | >350 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés chimiques

La delphinidine fait partie avec la cyanidine, la pélargonidine, la malvidine, la péonidine et la pétunidine, des principaux anthocyanidols rencontrés dans la nature. Dans ce groupe, elle se caractérise par la présence de trois groupements hydroxyles en position 3', 4' et 5' sur le cycle aromatique B (voir la numérotation dans la table 1).
En raison de son noyau flavylium possédant une forte réactivité avec les nucléophiles, la delphinidine est une molécule relativement instable et donc pratiquement absente sous forme libre dans les tissus végétaux[3]. L'addition d'un sucre en position C-3 (par O-glycosylation) lui confère une meilleure stabilité et solubilité. Les hétérosides formés par condensation de la delphinidine et d'un ose font partie de la famille des anthocyanosides ou anthocyanes, une vaste famille de pigments colorés.
La delphinidine est l'aglycone le plus fréquent dans la nature après la cyanidine, puisque 22 % des anthocyanosides sont construits à partir de la delphinidine.
La delphinidine fut isolée en 1915, des pétales bleu pourpre de Delphinium consolida (espèce maintenant classée dans le genre Consolida comme Consolida regalis Gray) par les pionniers de l'analyse des pigments floraux, Richard Willstätter et Mieg.
Hétérosides de delphinidine dans l'alimentation
La delphinidine et ses dérivés possèdent une activité anti-oxydante notable. En comparant la capacité in vitro à piéger les radicaux libres du DPPH•[N 1] par les anthocyanidols et leur 3-glucosides, Azevedo et als[4] (2010) ont montré que l'activité antiradicalaire était la plus grande pour la delphinidine et son 3-glucoside puis venait la cyanidine et la malvidine (et leur 3-glucosides). Plusieurs études épidémiologiques ont montré l'effet protecteur contre les maladies coronariennes et cardiovasculaires de la consommation d'anthocyanosides[5].
La base phenol-explorer[6] recense 13 hétérosides de delphinidine présent dans les fruits et légumes :
| Table 1 Hétérosides de delphinidine dans les aliments | |
 | |
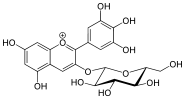
| Delphinidin 3-O-glucoside (ou myrtilline) | Cassis (86,68 mg/100g), Framboise rouge (0,21 mg/100g), Vaccinium corymbosum L., raisin rouge, grenade (jus), haricot (noir, cru) |
| Delphinidin 3-O-glucosyl-glucoside | Oignon rouge (6,50 mg/100g) |
| Delphinidin 3,5-O-diglucoside | Grenade pur jus (1,56 mg/100g]) |
| Delphinidin 3-O-(6"-acetyl-galactoside) | Vaccinium augustifolium Ait., Vaccinium corymbosum L. |
| Delphinidin 3-O-(6"-acetyl-glucoside) | Raisin rouge (0,54 mg/100g), Vaccinium augustifolium Ait., Vaccinium corymbosum L. |
| Delphinidin 3-O-(6"-malonyl-glucoside) | |
| Delphinidin 3-O-(6"-p-coumaroyl-glucoside) | vin rouge (0,18 mg/100g) |
| Delphinidin 3-O-arabinoside | Vaccinium augustifolium Ait., Vaccinium corymbosum L. |
| Delphinidin 3-O-feruloyl-glucoside | Haricot, noir, cru (1,10 mg/100g) |
| Delphinidin 3-O-galactoside | Vaccinium augustifolium Ait., Vaccinium corymbosum L. |
| Delphinidin 3-O-rutinoside (ou tulipanine) | Cassis (197,41 mg/100g) |
| Delphinidin 3-O-sambubioside | Groseille (Ribes rubrum) |
| Delphinidin 3-O-xyloside | |
Pigment coloré des plantes
Les dérivés de la delphinidine donnent leurs teintes bleues à des fleurs telle que les violettes, les delphiniums ou les aconits. Ainsi, le pigment bleu-violacé de la fleur d'Aconitum carmichaelii (en) a été identifié comme un dérivé de delphinidine[N 2] et nommé la violdelphine (en)[7]. Ils donnent aussi sa couleur bleu rougeoyante aux raisins du cépage cabernet sauvignon. Ils sont aussi présents dans le cépage Concord, les canneberges et les grenades[8].
- Hortensia Hydrangea macrophylla
Les hortensias (Hydrangea) peuvent fleurir rouge ou bleu suivant l'acidité du sol et la présence d'aluminium. Dans un sol basique, les sépales sont rouge fuchsia, mais s'il est acide, ils sont bleu pourpre.
 |
 | |
| Hydrangea macrophylla | ||
 |
 |
|
| 1 Cation flavylium de Delphinidine-3-glucoside de couleur ROUGE FUCHSIA |
2 Complexe de la base quinonique de Del-3-gl avec Al3+ de couleur BLEU MAJORELLE | |
Il est surprenant d'apprendre que toute cette palette de couleurs vient d'un seul anthocyanoside, le 3-glucoside de delphinidine (1), car en général, les fleurs rouges et bleues ont des chromophores anthocyanidoliques différents.
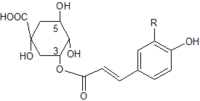
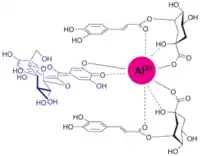
Yoshida et als ont pu mesurer le pH des vacuoles des cellules colorées qui se trouvent dans la seconde couche des sépales[9]. Lorsque les sépales sont rouges le pH est faible (pH=3.3) donc relativement acide mais il l'est un peu moins quand ils sont bleus (pH=4.1). L'acidité des vacuoles évolue inversement à celle du sol de culture. C'est cette acidité vacuolaire qui explique le passage sous forme de cation flavylium rouge[N 3] de la delphinidine. Mais pour bien comprendre le bleuissement de l'hortensia deux autres facteurs interviennent : des cations métalliques d'aluminium Al3+ et des co-pigments : 3 l'acide 3-caféylquinique (3-Caf), 4 l'acide 3-p-coumarylquinique (3-pC) et 5 l'acide 5-caféylquinique (5-Caf) (ou acide chlorogénique). Dans les vacuoles des cellules bleues, la concentration relative d'ions Al3+ et des co-pigments d'acides 3-acylquiniques 3 et 4 (3-Caf et 3-pC) est beaucoup plus élevée que dans les cellules rouges (où 5-Caf est en grande quantité plutôt que 3-Caf et 3-pC). La présence de ces co-pigments est essentielle pour la stabilité de la couleur bleue. Kondo et als[10] ont proposé un schéma de formation d'un complexe dans lequel, au centre, l'ion Al3+ coordonne le pigment 1 de delphinidine-3-glucoside et coordonne simultanément les atomes d'oxygène des co-pigments[11].
 |
 |
| Co-pigments : 3 R=OH acide 3-caféylquinique 4 R=H acide 3-p-coumarylquinique |
Pigment bleu d'hydrangea (modèle de Kondo et als[10]) |
Dans les sols acides, les racines de l'hortensia sécrètent de l'acide citrique qui forme un complexe avec Al3+ du sol pouvant être ensuite absorbé par les racines. Cet aluminium est subséquemment transporté dans la plante et s'accumule dans les vacuoles. Par contre dans les sols basiques, les ions Al3+ ne sont pas absorbables par les plantes. L'aluminium joue donc le rôle central dans le bleuissement du pigment normalement rouge du flavylium (en sol basique mais milieu acide de la vacuole). C'est la chélation (par des liaisons de coordination) entre ce cation métallique et le ligand anthocyanidolique qui provoque le déplacement de l'absorbance vers des longueurs d'onde plus grandes.

Le déplacement vers le bleu[N 4] de la couleur perçue peut se faire comme pour l'hortensia, par la formation d'un complexe avec un métal, mais aussi très souvent par une association entre le pigment anthocyanidolique et un co-pigment incolore, ou jaune clair tel qu'un glycoside de flavone qui vient s'empiler sur la molécule. C'est le cas par exemple, de la couleur bleue de la véronique.
- Véronique de Perse Veronica persica
Le pigment coloré de la Véronique de Perse (Veronica persica) est un glycoside de delphinidine (1) qui a été identifié[N 5] dans les pétales. L'autre flavonoïde important à avoir été identifié est un dérivé de l'apigénine (2) de la famille des flavones[N 6]. Le rôle de co-pigment de ce composé a été parfaitement démontré in vitro. Le déplacement du pic d'absorption du glycoside de delphinidine 1 vers les grandes longueurs d'onde a été observé[12] d'une manière dépendante de la dose quand on lui ajoute le co-pigment 2 (le glucuronide d'apigénine). Dans les pétales, le pigment 1 et le co-pigment 2 sont dans un rapport molaire de 1 pour 9 capable de donner la belle couleur bleu ciel typique des véroniques.
Voir aussi
Articles connexes
- Flavonoïde
- Anthocyanidine
- Caroténoïde
- Prodelphinidines, un type de tanins condensés produisant de la delphinindin lors de leur hydrolyse en ilieu acide
Notes
- 2,2-diphényl 1-picrylhydrazyl .Quand un agent antiradicalaire est ajouté au DPPH•, l’électron libre est apparié et la couleur pourpre change en jaune. L'effet se mesure par l'absorbance à 515 nm
- delphinidin 3-rutinoside-7-0-(6-0~(4-(6-0-(4-hydroxybenzoyl)-β-D-glucosyl)oxybenzoy-β-D-glucoside)
- pour plus d'explications voir Anthocyane
- ou déplacement bathochrome est une augmentation de la longueur d'onde du pic d'absorption c'est-à-dire un déplacement vers le rouge
- 1 = Delphinidin 3-O-(2-O-(6-O-p-coumaroyl-glucosyl)-6-O-p-coumaroyl-glucoside)-5-O-glucoside
- 2 = Apigenin 7-O-(2-O-glucuronosyl)-glucuronide
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) AFAQ Farrukh; SYED Deeba N.; MALIK Arshi; HADI Naghma; SARFARAZ Sami; KWEON Mee-Hyang; KHAN Naghma; MOHAMMAD ABU ZAID; MUKHTAR Hasan, « Delphinidin, an anthocyanidin in pigmented fruits and vegetables, protects human HaCaT keratinocytes and mouse skin against UVB-mediated oxidative stress and apoptosis », Journal of investigative dermatology, vol. 127, no 1, , p. 222–232 (PMID 16902416, DOI 10.1038/sj.jid.5700510)
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, , 398 p. (ISBN 2-7430-0805-9)
- Joana Azevedo, Iva Fernandes, Ana Faria, Joana Oliveira, Ana Fernandes, Victor de Freitas, Nuno Mateus, « Antioxidant properties of anthocyanidins, anthocyanidin-3-glucosides and respective portisins », Food Chemistry, vol. 119, , p. 518-523
- Pamela J Mink, Carolyn G Scrafford, Leila M Barraj, Lisa Harnack, Ching-Ping Hong, Jennifer A Nettleton, and David R Jacobs Jr, « Flavonoid intake and cardiovascular disease mortality: a prospective study in postmenopausal women », Am J Clin Nutr, vol. 85, , p. 895-909
- PHENOL-EXPL
- K Takeda, « The anthocyanin responsible for purplish blue flower colour of Aconitum chinense », Phytochemistry, vol. 36, no 3, , p. 613-616 (ISSN 0031-9422, lire en ligne, consulté le )
- Jean Ribereau-Gayon; Pascal Ribereau-Gayon, « The anthocyans and leucoanthocyans of grapes and wines », American Journal of Enology, vol. 9, , p. 1–9
- Kumi Yoshida, « Blue flower color development by anthocyanins: from chemical structure to cell physiology », Natural Product Reports, vol. 26, no 7, , p. 884-915 (ISSN 0265-0568, DOI 10.1039/b800165k, lire en ligne, consulté le )
- Tadao Kondo, « Essential structure of co-pigment for blue sepal-color development of hydrangea », Tetrahedron Letters, vol. 46, no 39, , p. 6645-6649 (ISSN 0040-4039, DOI 10.1016/j.tetlet.2005.07.146, lire en ligne, consulté le )
- Schreiber HD, Swink AM, Godsey TD., « The chemical mechanism for Al3+ complexing with delphinidin: a model for the bluing of hydrangea sepals. », J Inorg Biochem., vol. 104, no 7,
- Eiichiro Ono, Miho Ruike, Takashi Iwashita, Kyosuke Nomoto, Yuko Fukui, « Co-pigmentation and flavonoid glycosyltransferases in blue Veronica persica flowers », Phytochemistry, vol. 71, , p. 726-735
- Portail de la chimie
- Alimentation et gastronomie
- Portail de la biochimie
- Portail des couleurs