Anthocyane
Les anthocyanes (du grec anthos « fleur » et kuanos « bleu sombre ») ou anthocyanosides[N 1],[1] (ou sur le modèle anglais anthocyanines) sont des colorants naturels des feuilles, des pétales et des fruits, situés dans les vacuoles des cellules, solubles dans l'eau, allant du rouge orangé au bleu pourpre dans le spectre visible.
Ne pas confondre avec les anthocyanidines, leurs aglycones

Ces composés existent sous forme d'hétérosides formés par la condensation d'une molécule non glucidique (appelé aglycone) et d'oses et souvent, de groupes acyles. L'aglycone qui les caractérise est un anthocyanidol de la classe des flavonoïdes. En 2006, 539 anthocyanosides ont été recensés[2].
Les anthocyanosides sont présents dans un certain nombre de végétaux tels que myrtille, mûre, cerise, raisin noir, orange sanguine, aubergine, pomme de terre vitelotte, prune, bleuet (airelle bleue du Canada, ne pas confondre avec le Bleuet des champs), mauve, etc. Ils donnent leur couleur aussi bien aux feuilles d'automne qu'aux fruits rouges. Ils jouent un rôle important dans la pollinisation des fleurs et la dispersion des graines, ainsi que dans la protection des plantes contre les agressions du milieu (froid, lumière, ravageurs, etc.).
Leur fort pouvoir colorant, leur solubilité en milieu aqueux et leur absence de toxicité font des anthocyanosides des colorants naturels susceptibles de remplacer les colorants synthétiques utilisés dans l'industrie agroalimentaire. Enfin, leur activité anti-oxydante laisse supposer que leur apport par l'alimentation pourrait jouer un rôle bénéfique dans la santé humaine, notamment dans le domaine des risques cardiovasculaires.
Structure

Les anthocyanosides sont les hétérosides d'anthocyanidines, c'est-à-dire des anthocyanidols portant des sucres. Ils sont principalement basés sur six anthocyanidols : cyanidine, delphinidine, pélargonidine, péonidine, pétunidine et malvidine, construits sur le même squelette flavylium responsable de la couleur du composé. Si l'aglycone est le groupement chromophore du pigment c'est aussi un noyau très réactif aux nucléophiles qui confère une certaine instabilité à ces molécules. Elles sont donc rarement présentes sous cette forme dans les tissus végétaux. Par contre, il suffit de l'addition d'un glucide en position C-3 du cycle central pour les stabiliser.
La partie osidique des anthocyanosides peut être un monosaccharide (glucose, galactose, rhamnose), un diholoside (rutinose constitué d'un glucose lié à un rhamnose, xyloglucose) ou parfois un triholoside[1]. La plupart des anthocyanosides sont des 3-monosides et des 3, 5-diosides d'anthocyanidols. Il existe aussi des diosides liés en 3, 7 et des triosides liés en 3, 5, 3'.
De nombreux anthocyanosides sont en outre acylés par :
- des acides hydroxycinnamiques : acides 4-coumarique, caféique, férulique, sinapique ;
- des acides benzoïques : acide gallique ;
- des acides aliphatiques carboxyliques : acide acétique, ou des acides dicarboxyliques comme les acides malonique, malique, oxalique, succinique.
Ces acides estérifient un hydroxyle de sucre, généralement sur leur C-6".
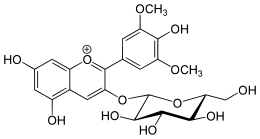 | 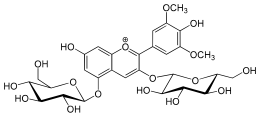 |
 |
| 3-glucoside de malvidine | 3,5-diglucoside de malvidine | 3-coumaroyl-6-glucoside de malvidine |
Les anthocyanosides avec une seule liaison glycosidique en position C-3 sont facilement hydrolysables par catalyse acide et redonnent l'aglycone (l'anthocyanidol) d'origine[3]. Les anthocyanosides possédant deux liaisons glycosidiques en position 3 et 5 sont déjà plus résistants à l'hydrolyse acide. Les diglycosides sont donc plus stables que les monoglycosides. Enfin, la présence de groupements acyles liés aux sucres assure une protection supplémentaire du noyau pyrylium contre les attaques nucléophiles (de l'eau en particulier).
De nombreux facteurs peuvent influer la dégradation des anthocyanosides : l'acidité, la température de stockage, la structure chimique, la lumière, etc.
Facteurs influençant la couleur
.jpg.webp)
Les anthocyanosides couvrent une large palette de couleurs dépendant de la nature des substitutions (OH, CH3) caractérisant le noyau central de l'aglycone (cf. anthocyanidol qui joue le rôle de chromophore) mais ces couleurs dépendent aussi du pH, de la présence de copigments (en), d'ions métalliques (fer, aluminium), d'alcool, etc.
- Influence du pH

Les anthocyanosides sont particulièrement sensibles au changement de pH, en passant du rouge en milieu acide (bas pH) au bleu en pH intermédiaire et en devenant incolore puis vert et jaune clair en milieu basique[4]. Ils peuvent donc être utilisés comme de véritables indicateurs colorés. Un TP se basant sur le jus de chou rouge et modifiant le pH, permet de vérifier facilement ces teintes[5].
En milieu aqueux, quatre formes coexistent en équilibre[6],[7] (fig. 4) :
- le cation flavylium A+ (1), de couleur rouge ;
- les bases quinoniques AO (2, 3 et 4), de couleur bleu-mauve ;
- les bases carbinols AOH (5 et 6), incolores ;
- les chalcones C (7), de couleur jaune clair.
L'étude cinétique de ces équilibres a permis d'établir les vitesses de réaction régissant l'équilibre entre ces quatre formes. En milieu fortement acide (pH 1), le cation flavylium 1 prédomine largement et contribue à la coloration rouge ou pourpre. Lorsque le pH s'élève plusieurs formes coexistent. Pour un pH compris entre 2 et 4, les bases quinoniques sont prédominantes et tirent la teinte vers le bleu. Pour un pH entre 5 et 6, deux espèces supplémentaires apparaissent : une pseudobase carbinol, 4, incolore et une chalcone, 6, jaune clair. Enfin, à pH supérieur à 7, les anthocyanosides sont dégradés.
- Influence des copigments
Les anthocyanosides tendent à créer entre eux ou avec d'autre composés phénoliques des assemblages dits de copigmentation[3] qui améliorent leur pouvoir colorant, leur tonalité et leur stabilité. Les copigments sont généralement incolores mais quand on les mélange avec des anthocyanosides, l'interaction produit un effet hyperchromique. Les copigments peuvent être des flavonoïdes, des alcaloïdes, des acides aminés, des acides organiques, des nucléotides, des polysaccharides, des ions métalliques ou d'autres anthocyanosides[7].
L'effet le plus manifeste de la copigmentation se manifeste dans un milieu faiblement acide (pH 4-6) quand les anthocyanosides sont sous la forme incolore.
Occurrence
| Anthocyanines en mg par 100 g de denrée alimentaire d'après Clifford[8] 2000, Eder[9] 2000, Timberlake, Henry[10] 1988 | |
| Aliment | Concentration |
|---|---|
| Aronia | 200-1 000 |
| Aubergine | 750 |
| Canneberge | 50-200 |
| Cerise | 350-450 |
| Fraise | 13-36 |
| Framboise | 10-60 |
| Mûre | 82-180 |
| Myrtille | 80-460 |
| Mûre de Logan | ~77 |
| Orange | ~200 |
| Pomme (peau) | 10-216 |
| Raisin rouge | 30-750 |
| Rhubarbe | jusqu'à 200 |
| Vin rouge | 24-35 |
Les anthocyanes sont des pigments présents uniquement dans la vacuole des plantes, et chez les champignons, mais ne sont pas trouvés chez les animaux. En effet, la biosynthèse des anthocyanes passe principalement, comme les autres flavonoïdes, par la voie métabolique des phénylpropanoïdes. En revanche, toutes les plantes terrestres ne contiennent pas d'anthocyane. Chez les Caryophyllales, les Cactus et les Galium, ils sont remplacés par les bêtacyanines.
Les anthocyanes apparaissent principalement dans les fruits mais aussi dans les feuilles et les racines. Elles sont principalement localisées dans les cellules des couches extérieures tel que l'épiderme. Les quantités sont assez importantes[8],[9],[10] : un kilogramme de mûres en contient par exemple 1,15 gramme, les légumes rouges et noirs en contiennent environ 20 mg par 100 grammes. Les glands de chêne ou les châtaignes se gorgent d'anthocyanes au moment de la germination au printemps. Environ 2 % de tous les hydrocarbures fixés par la photosynthèse sont transformés en flavonoïdes et leurs dérivés tels que les anthocyanes, ce qui fait environ dix milliards de tonnes par an.
Dans le raisin, les anthocyanes se concentrent dans la pellicule. Les anthocyanes de la vigne européenne Vitis vinifera sont glycosylés uniquement en position 3. Parmi eux, le 3-glucoside de malvidine, un pigment de couleur violacée (alors que par exemple le 3-glucoside de la cyanidine est plus rouge) est le plus abondant.
Les anthocyanes sont présents avec d'autres flavonoïdes et composés chimiques proches tels que carotènes et bêtacyanines. Ils sont responsables de la couleur automnale des feuilles quand la photosynthèse s'est arrêtée et que la chlorophylle a disparu.
Sur les jeunes plants ou les nouveaux rameaux, quand la production de chlorophylle n'a pas encore commencé et que la plante est donc sans protection contre les ultra-violets, la production d'anthocyane augmente. Dès que la production de chlorophylle commence, celle d'anthocyanes est réduite. Le taux d'anthocyanes produit dépend du type de la plante, du substrat, de la lumière et de la température. Il a également été constaté que la coloration rouge permet de réaliser un camouflage contre les herbivores qui sont incapables de voir les longueurs d'onde rouge. De plus, la synthèse anthocyanique coïncide souvent avec la synthèse des composés phénoliques désagréables au goût[11].
Fonction dans les plantes
Les anthocyanes, en plus de leur effet sur la physiologie de la plante, ont de multiples fonctions quant aux relations plantes/animaux. Elles attirent les pollinisateurs des plantes, les frugivores et elles piègent les victimes des plantes carnivores. De nombreuses hypothèses sont proposées quant à leurs fonctions protectrices lorsqu'elles s'accumulent dans les tissus photosynthétiques[12] : elles repoussent certains herbivores (fonction aposématique des fruits leur signalant qu'ils contiennent des composés toxiques ou sont non comestibles, fonction mimétique du feuillage qui se fait passer pour des feuilles mortes ou en sénescence), ou qui attire moins en automne les pucerons que les couleurs vertes des feuilles estivales (ces insectes pondant moins sur les feuilles automnales)[13],[14]. Elles ont un rôle dans l'inhibition de l'homochromie de certains insectes (réduisant leur camouflage) et même dans le mimétisme de certaines structures. Leur biosynthèse peut également être stimulée par un stress abiotique. Des réactions anthocyanées se produisent en réponse à des stress nutritifs tels que des carences en azote et en phosphore, l'accumulation d'anthocyanes aidant les plantes à maintenir l'intégrité de leurs fonctions cellulaires en favorisant la mobilisation et l'acquisition de nutriments[15]. Composés osmotiquement actifs, leur présence peut améliorer l’état hydrique des plantes en cas de stress hydrique ou lutter contre le froid en cas de températures basses (« coup de froid »)[16]. Les anthocyanes ont un rôle photoprotecteur : en absorbant les UV, elles réduisent la photoinhibition[17] et la photo-oxydation, agissant en bouclier pour l'ADN et les composants cellulaires (comme le bronzage qui correspond à une augmentation de la mélanine épidermique)[18]. Cet effet photoprotecteur est fréquent chez les feuilles juvéniles qui synthétisent des anthocyanes de jeunesse, pigments bloquant les rayons ultraviolets néfastes sur les feuilles à la cuticule encore mince[19], mais aussi chez les jeunes tiges[20]. Les anthocyanes ont un effet « désherbant » qui limite la concurrence pour le développement des graines des plantes qui en produisent[21]. Ils ont également un rôle de protection au niveau de la tige (notamment de la base teintée de rouge) ou au niveau des entre-nœuds, en absorbant l'excès de lumière et empêchant ainsi la dégradation de molécules photolabiles fabriquées par la plante et qui servent de composé de défense antifongique et antibactérien[22].
Absorption et métabolisme
L'absorption des anthocyanosides s'effectue principalement au niveau de l'estomac et du jéjunum[23].
Lors du passage dans l'appareil digestif du rat les anthocyanosides sont légèrement dégradés et une fraction est ensuite rapidement absorbée puis éliminée dans la bile et l'urine sous forme de glucosides intacts ou bien sous formes méthylées ou glucuronidées[24].
Chez l'homme, on observe aussi une métabolisation de la cyanidine-3-glucoside en formes méthylée et glucuronidée. L'analyse de l'urine après l'ingestion par des sujets humains de 200 g de fraises, riches en pélargonine-3-glucoside (Pe-3-gluc), révèle en plus de la Pe-3-gluc, trois monoglucuronides de pélargonine, un sulfoconjugué de pélargonine et la pélargonine elle-même. La totalité des métabolites d'anthocyanosides de fraises excrétés dans l'urine représente 1,80 % de la Pe-3-gluc ingérée[25]. Une absorption plus faible a été trouvée pour les anthocyanosides de framboises. Moins de 0,1 % des trois principaux anthocyanosides de la framboise sont excrétés dans l'urine et de grandes quantités passent directement de l'intestin grêle au gros intestin sans avoir subi de biotransformations[26]. Le microbiote du gros intestin transforme ensuite les anthocyanosides en acide protocatéchique.
Une étude sur l'absorption d'anthocyanosides de jus de canneberge[27] par 15 patients a donné des taux de récupération urinaire très variables suivant les individus, allant de 0,078 à 3,2 %.
Ainsi, après consommation, les anthocyanosides existent dans la circulation sanguine et l'urine, soit sous forme intacte soit sous forme méthylée, glucuronidée ou sulfoconjuguée. Le pic de concentration dans le plasma est atteint entre 1 et 3 heures après la consommation, durée variable suivant le type de composé et la matrice alimentaire. Les métabolites persistent dans l'urine durant 24 heures[28].
Activités biologiques
Activité antioxydante
Les anthocyanosides et leurs aglycones, comme tous les polyphénols, possèdent des groupes hydroxyles phénoliques, Ar-OH, pouvant fournir aux radicaux libres des H capables de les neutraliser.
Il n'existe pas une valeur absolue de l'activité antioxydante mais différentes méthodes d'analyse basées sur différents mécanismes. En comparant la capacité in vitro à piéger les radicaux libres du DPPH• (2,2-diphényl 1-picrylhydrazyl)[N 2] par les anthocyanidols et leur 3-glucosides, Azevedo et al.[29] (2010) ont montré que l'activité antiradicalaire était la plus grande pour la delphinidine Dp (et son 3-glucoside Dp-3-gluc) puis venait la cyanidine Cy et la malvidine Mv (et leur 3-glucosides) :
- Mv, Mv-3-gluc < Cy, Cy-3-gluc < Dp, Dp-3-gluc.
Le potentiel de piégeage des radicaux libres semble liée au nombre de groupes hydroxyle -OH sur le cycle B puisque la delphinidine en possède trois, la cyanidine deux et la malvidine un seul.
Une autre méthode basée sur le potentiel de réduction du fer (FRAP[N 3]) a donné un ordre semblable. La capacité réductrice augmente avec le nombre de groupements hydroxyle sur le cycle B conformément à l'ordre : Mv < Cy, Dp.
Une troisième méthode utilisée par Azevedo et ses collaborateurs consiste à évaluer la capacité des pigments à contrer l'oxydation des liposomes PC du soja induite par un générateur de radicaux libres nommé AAPH. L'étude a montré que les anthocyanidols (Mv, Cy, Dp) et leurs 3-glucosides piégeaient efficacement les radicaux peroxyles générés dans la phase aqueuse. Il n'y a pas de différence significative entre Mv, Cy et Dp pour ralentir la peroxydation des lipides mais leurs glucosides sont un peu moins efficaces.
La comparaison de la capacité antioxydante des anthocyanosides avec d'autres polyphénols présents dans le vin rouge a été effectuée par Fauconneau et al.[30]. Ils ont testé les composés par trois méthodes : la capacité à prévenir la peroxydation des microsomes (une membrane riche en acides gras polyinsaturés), du LDL et le piégeage direct des radicaux libres DPPH•. Les trois méthodes ont donné une plus grande activité à la (+)-catéchine et à l'(-)-épicatéchine suivies par les deux anthocyanosides testés (malvidine-3-glucoside et péonidine-3-glucoside) et enfin le trans-resveratrol :
- t-resveratrol < Mv-3-gluc, Peo-3-gluc < (-)-épicatéchine, (+)-catéchine.
L'activité de piégeage du peroxynitrite[N 4] donne à peu près la même activité antioxydante[31] aux 3-glucosides de malvidine et de delphinidine qu'aux flavanols ((+)-catéchine, épicatéchine) mais moins qu'à leurs dimères ou trimère (des tanins condensés) :
- Pet-3-gluc < Mv-3-gluc, Dp-3-gluc, catéchine, épicat. < dimères B1, B2 < trimère.
Régulation du monoxyde d'azote NO par l'endothélium
La concentration des anthocyanosides dans la circulation sanguine semble un peu faible pour influer efficacement sur l'extinction des dérivés réactifs de l'oxygène[28] mais pourrait être suffisante pour améliorer les fonctions endothéliales en influençant le niveau de monoxyde d'azote NO.
L'endothélium, la couche interne des vaisseaux, régule la vasomotricité en contrôlant la production du monoxyde d'azote NO. En effet, l'oxyde nitrique synthase (eNOS) produit par les cellules endothéliales catalyse la synthèse d'oxyde d'azote NO (ou oxyde nitrique) lequel agit sur les cellules musculaires lisses vasculaires comme vasodilatateur. Les effets potentiels du NO sont une diminution de la pression artérielle (antihypertensif), une entrave aux dépôts graisseux (athéromes) sur les parois artérielles (anti-athérogène) et une activité antithrombotique.
Une étude portant sur trois fruits riches en pigments anthocyanosidiques, l'aronia, la myrtille et la baie de sureau, a montré que les deux premiers avaient une action vasoprotective pour les artères coronaires. En mesurant in vitro la relaxation des artères coronaires de cochons soumis à des doses variables d'extraits de pigments, on observe une vasorelaxation dépendante de la dose d'extraits d'aronie et de myrtilles mais pas de sureau[32]. L'étude a montré par ailleurs que l'action résultait de la production de NO par l'endothélium[N 5].
Pour élucider le mécanisme d'action des anthocyanosides, plusieurs équipes de recherche ont cherché à voir si l'augmentation de production de NO ne passait pas par un accroissement de l'expression de l'oxyde nitrique synthase eNOS. Ainsi, Xu et al.[33] ont montré que le traitement des cellules endothéliales bovines par la cyanidine-3-glucoside (Cy-3-gluc) durant 8 heures renforçait l'expression de la protéine eNOS d'une manière dépendante de la dose. Des études semblables sur les polyphénols du vin rouge ont montré qu'ils pouvaient renforcer la formation de NO par l'endothélium via une phosphorylation de eNOS[34]. Il se pourrait donc que le métabolisme d'eNOS plutôt que l'activité antioxydante générale soit l'activité biologique majeure des flavonoïdes.
Données épidémiologiques
Des études épidémiologiques ont examiné le lien entre la consommation des diverses classes de flavonoïdes et les maladies cardiovasculaires. Une étude d'une durée de 16 ans portant sur 34 486 femmes ménopausées de l'Iowa a montré[35] une association inverse entre la consommation d'anthocyanosides et la mortalité totale, la mortalité par maladie coronarienne (MC[N 6]) et par maladies cardiovasculaires (MCV[N 7]). Ainsi, la consommation de fraises au moins une fois par semaine est associée à une diminution de la mortalité par maladies cardiovasculaires.
De nombreuses études épidémiologiques ont montré que la mortalité par maladie cardiovasculaire pouvait être diminuée par une consommation modérée de vin rouge. Une méta-analyse (de 26 études) portant sur la relation entre la consommation de vin et la survenue de maladies cardiovasculaires suggère un effet préventif significatif dépendant de la dose pour une consommation modérée[36]. On sait que la composition phénolique des vins rouges est très variable et qu'elle varie fortement suivant les cépages, les années et les pratiques d'élaboration et que sur la quarantaine de polyphénols remarquables qu'ils contiennent, la part des anthocyanosides est importante puisqu'on en discerne sept principaux, représentant environ 35 % du poids[37]. La comparaison des valeurs de l'activité antioxydante totale avec celle de leur fraction anthocyanosidique montre une contribution importante de ces pigments au pouvoir antioxydant, puisqu'elle peut expliquer aux environs de 50 % de ce pouvoir[38].
Biosynthèse
Les débuts de la compréhension de biochimie des anthocyanidols remonte à 1913 quand Willstätter et ses collègues ont montré que les pigments d'une grande variété de plantes dérivaient tous de trois anthocyanidols : la pélargonidine, la cyanidine et la delphinidine. Après 1960, à la description biochimique des multiples étapes de la biosynthèse a pu être associée la description de gènes codant les enzymes impliquées dans les réactions[39].
La description des 6 anthocyanidols principaux est de première importance puisqu'ils sont présents dans 90 % des anthocyanosides identifiés. Ils sont tous hydroxylés en 3, 5, 7. Il convient de distinguer ceux dont le cycle B ne comporte que des hydroxyles (pélargonidine avec un OH, cyanidine avec deux OH et delphinidine avec trois OH) des trois autres dont le cycle B est methoxylé. Les glucosides de ces derniers s'obtiennent par dérivation des glucosides des trois premiers.
Ainsi la biosynthèse comporte une voie commune puis 3 voies parallèles aboutissant à la pélargonidine, la cyanidine et la delphinidine[39],[40].
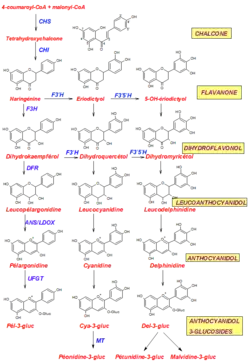
- Les anthocyanosides sont biosynthétisés comme les autres flavonoïdes par le croisement de deux voies métaboliques dans les cellules végétales :
- la première part du shikimate pour produire l'acide aminé phénylalanine, qui selon la voie des phénylpropanoïdes formera un dérivé de l'acide paracoumarique et de la coenzyme A, le 4-coumaroyl-CoA ;
- la seconde produit trois molécules de malonyl-CoA, une unité C3 formée à partir d'une unité C2, l'acétyl-CoA[41].
- Ces deux voies se croisent pour former sous l'action d'une enzyme, la chalcone synthase (CHS), qui formera un intermédiaire du type chalcone (tetrahydroxychalcone) via un mécanisme de pliage de polycétide commun chez les plantes.
- La chalcone est ensuite isomérisée par l'action d'une enzyme, la chalcone isomerase (CHI) qui provoque une cyclisation interne formant une flavanone, la naringinine. À cette étape s'ouvrent deux autres voies parallèles, à la suite d'une hydroxylation en 3' par la flavonoïde 3'-hydroxylase (F3'H) puis une 5'-hydroxylation (F3'5'H) pour donner l'ériodictyol et le 5-OH-ériodictyol[42]
- Les flavanones sont ensuite oxydées par une enzyme de type flavanone hydroxylase (FHT or F3H), ou flavonoïde 3-hydroxylase pour donner des dihydroflavonols
- Les produits de ces oxydations sont ensuite réduits par l'action de l'enzyme dihydroflavonol 4-réductase (DFR) en leucoanthocyanidols, incolores, correspondants[43].
- Les enzymes impliqués dans la production d'anthocyanidols, à l'étape suivante, ont d'abord été identifiés comme anthocyanidine synthase (ANS) ou leucoanthocyanidine dioxygénase (LDOX). Mais à la suite d'une clarification du mécanisme in vivo, on pense maintenant que la réaction passe par l'intermédiaire d'une pseudobase (3-flaven-2,3-diol), puis subit l'addition d'un glucose en C-3 par F3GT (flavonoid-3-glucosultransferase). Toutefois l'oxydation en C-3 par ANS se manifesterait sous forme d'un effet de bord mineur[2]. La Pélargonidine va de l'orange au rouge, la Cyanidine du rouge au magenta et la Delphinidine est pourpre.
- Les produits de ces réactions, des anthocyanidols généralement instables, sont ensuite couplés à un ose par une enzyme de type UDP-3-O-glucosyltransférase[44] (UFGT) pour former des hétérosides, de type anthocyanidol 3-glucosides, relativement stables.
- L'obtention des hétérosides des trois derniers anthocyanidols se fait par une méthyltransférase (MT) qui donne la péonidine 3-glucoside à partir du Cya-3-gluc, la pétunidine 3-glucoside et la malvidine 3-glucoside à partir de la Del-3-gluc.
Application
L'anthocyane est aussi souvent utilisée en poudre. Cette dernière, hydrosoluble et soluble dans l'alcool donne lieu à diverses applications possibles. Il existe une poudre d'anthocyanes colorante E163 qui provient de marc de raisin. Ce colorant en poudre est utilisé notamment dans les confiseries, dans les produits laitiers, dans les boissons, les sirops ou encore les glaces et les sorbets[45]
Notes
- Jean Bruneton préfère maintenir en français les suffixes -oside pour les hétérosides et -ol pour les polyphénols, ce qui semblent induire moins de confusion.
- quand un agent antiradicalaire est ajouté au DPPH•, l’électron libre est apparié et la couleur pourpre change en jaune. L'effet se mesure par l'absorbance à 515 nm
- en anglais : ferric reducing antioxidant power
- le peroxynitrite ONOO− est un dérivé réactif de l'oxygène (ou une espèce réactive de l'oxygène)
- puisqu'elle est abolie par des inhibiteurs de eNOS
- Cardiopathies ischémiques (angine de poitrine, infarctus du myocarde…)
- maladies hypertensives, valvulopathie cardiaque…
Références
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- Kevin M. Davies, « Modifying Anthocyanin Production in Flower », in K. Gould et al. "ANTHOCYANINS Biosynthesis, Functions and Applications", Springer,
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, , 398 p. (ISBN 2-7430-0805-9)
- (en) Rice-Evans CA, Miller NJ. Paganga G., « Structure-antioxidant activity relationships of flavonoids and phenolic acids », Free Radic Biol Med, vol. 20, no 7, , p. 933-956
- « Indicateur coloré naturel : le jus de chou rouge - SPC - Au laboratoire des Sciences Physiques et Chimiques », sur www.spc.ac-aix-marseille.fr (consulté le )
- Michaël Jourdes, Réactivité, synthèse, couleur et activité biologique d'ellagitannins c-glycosidiques et flavano-ellagitannins, thèse de chimie organique, Université de Bordeaux I,
- (en) Araceli Castaneda-Ovando, Ma. de Lourdes Pacheco-Hernandez, Ma. Elena Paez-Hernandez, Jose A. Rodriguez, Carlos Andres Galan-Vidal, « Chemical studies of anthocyanins: A review », Food Chemistry, vol. 113, , p. 859-871
- (en) Clifford M.N., « Anthocyanins – nature, occurrence and dietary burden », J. Sci. Food Agric., vol. 80,
- (en) Reinhard Eder, "Pigments", in Food Analysis by Hplc, Leo M.L. Nollet (ed.), Marcel Dekker Inc, , 1068 p.
- (en) Timberlake C.F., Henry B.S., « Anthocyanins as natural food colorants », Prog. Clin. Biol. Res., vol. 280, , p. 107-121
- (en) Jack Sullivan, « Anthocyanin », Carnivorous Plant Newsletter, vol. 27, no 3, , p. 86-88 (lire en ligne)
- (en) LS. Lev-Yadun & K. Gould, « Role of Anthocyanins in Plant Defence ». In K. Gould, K. Davies & C. Winefield (eds.), Anthocyanins. Biosynthesis, functions, and applications, Springer, 2009, p.21-48
- (en) Feild TS, Lee DW, Holbrook NM, « Why leaves turn red in autumn. The role of anthocyanins in senescing leaves of red-osier dogwood », Plant Physiology, vol. 127, no 2, , p. 566–574.
- (en) Jon E. Sanger, « Quantitative Investigations of Leaf Pigments From Their Inception in Buds Through Autumn. Coloration to Decomposition in Falling Leaves », Ecology, vol. 52, no 6, , p. 1075-1089.
- (en) Akula Ramakrishna et Sarvajeet Singh Gill, Metabolic Adaptations in Plants During Abiotic Stres, CRC Press, , p. 30
- (en) Linda Chalker-Scott, « Environmental significance of anthocyanins in plant stress responses », Photochemistry and Photobiology, vol. 70, no 1, , p. 1–9.
- (en) Lee, D.W. and Lowry, J.B., « Young-leaf anthocyanin and solar ultraviolet », Biotropica 12, 1980, p. 75–76
- (en) Burger J & Edwards GE, « Photosynthetic efficiency, and photodamage by UV and visible radiation, in red versus green leaf Coleus varieties », Plant Cell Physiol, 37, 1996, p.395–399
- Peter Wohlleben, La Vie secrète des arbres, Les Arènes, (lire en ligne), p. 83.
- Why some stems are red: cauline anthocyanins shield photosystem II against high light stress. Kevin S. Gould, Dana A. Dudle and Howard S. Neufeld. Journal of Experimental Botany, Vol. 61, No. 10, pp. 2707–2717, 2010
- (en) Christina Schallenberg, « There's a reason those maple leaves are red: Leaves produce powerful chemical », Toronto Star, vol. 22 octobre,
- (en) Jonathan E. Page, Neil G. Towers, « Anthocyanins protect light-sensitive thiarubrine phototoxins », Planta, vol. 215, no 3, , p. 478–484 (DOI 10.1007/s00425-002-0769-6).
- (en) Michaela C. Matuschek,T, Wouter H. Hendriks, Tony K. McGhie, Gordon W. Reynolds, « The jejunum is the main site of absorption for anthocyanins in mice », Journal of Nutritional Biochemistry, vol. 17, , p. 31-36
- (en) Séverine Talavéra, Catherine Felgines, Odile Texier, Catherine Besson, Claudine Manach, Jean-Louis Lamaison, and Christian Rémésy, « Anthocyanins Are Efficiently Absorbed from the Small Intestine in Rats », The J. of Nutrition, vol. 134, no 9, , p. 2275-2279
- (en) Catherine Felgines, Séverine Talavéra, Marie-Paule Gonthier, Odile Texier, Augustin Scalbert, Jean-Louis Lamaison et Christian Rémésy, « Strawberry Anthocyanins Are Recovered in Urine as Glucuroand Sulfoconjugates in Humans », The J. of Nutrition, vol. 133, no 5, , p. 1296-1301
- (en) Rocío González-Barrio, Gina Borges, William Mullen et Alan Crozier, « Bioavailability of Anthocyanins and Ellagitannins Following Consumption of Raspberries by Healthy Humans and Subjects with an Ileostomy », J. Agric. Food Chem., vol. 58, no 7, , p. 3933-3939
- (en) Milbury PE, Vita JA et Blumberg JB., « Anthocyanins are bioavailable in humans following an acute dose of cranberry juice », J. Nutr., vol. 140, , p. 1099-104
- (en) Taylor C. Wallace, « Anthocyanins in Cardiovascular Disease », Advances in Nutrition, vol. 2, nos 1-7, (DOI 10.3945/an.110.000042, lire en ligne)
- (en) Joana Azevedo, Iva Fernandes, Ana Faria, Joana Oliveira, Ana Fernandes, Victor de Freitas et Nuno Mateus, « Antioxidant properties of anthocyanidins, anthocyanidin-3-glucosides and respective portisins », Food Chemistry, vol. 119, , p. 518-523
- (en) Bernard Fauconneau, Pierre Waffo-Teguop, François Huguet, Laurence Barrier, Alain Decendit et Jean-Michel Merillon, « Comparative study of radical scavenger and antioxidant properties of phenolic compounds from Vitis vinifera cell cultures using in vitro tests », Life Sciences, vol. 61, no 21, (PMID 9395251)
- (en) Jan Muselík, María García-Alonso, María P. Martín-López, Milan Žemlička et Julián C. Rivas-Gonzalo, « Measurement of Antioxidant Activity of Wine Catechins, Procyanidins, Anthocyanins and Pyranoanthocyanins », Int. J. Mol. Sci, vol. 8, , p. 797-809
- (en) David R. Bell et Kristen Gochenaur, « Direct vasoactive and vasoprotective properties of anthocyanin-rich extracts », J Appl Physiol, vol. 100, , p. 1164-1170
- (en) Jin-Wen Xu, Katsumi Ikeda et Yukio Yamori, « Upregulation of Endothelial Nitric Oxide Synthase by Cyanidin-3-Glucoside, a Typical Anthocyanin Pigment », Hypertension, vol. 44, , p. 217-222
- (en) Mamadou Ndiaye, Marta Chataigneau, Irina Lobysheva, Thierry Chataigneau et Valérie B. Schini-Kerth, « Red wine polyphenols-induced, endothelium-dependent NOmediated relaxation is due to the redox-sensitive PI3-kinase/Akt-dependent phosphorylation of endothelial NOsynthase in the isolated porcine coronary artery », Br J Pharmacol., vol. 142, no 7,
- (en) Pamela J Mink, Carolyn G Scrafford, Leila M Barraj, Lisa Harnack, Ching-Ping Hong, Jennifer A Nettleton et David R Jacobs Jr, « Flavonoid intake and cardiovascular disease mortality: a prospective study in postmenopausal women », Am J Clin Nutr, vol. 85, , p. 895-909
- (en) Augusto Di Castelnuovo, Serenella Rotondo, Licia Iacoviello, Maria Benedetta Donati et Giovanni de Gaetano, « Meta-Analysis of Wine and Beer Consumption in Relation to Vascular Risk », Circulation, vol. 105, , p. 2836-2844
- Nicolas Vivas, Les composés phénoliques et l'élaboration des vins rouges, Editions Féret,
- (en) M.D. Rivero-Perez, P. Muniz et M.L. Gonzalez-Sanjose, « Contribution of anthocyanin fraction to the antioxidant properties of wine », Food and Chemical Toxicology, vol. 46, , p. 2815-2822
- (en) Brenda Winkel, « The biosynthesis of flavonoids », dans The Science of Flavonoids, Springer, (ISBN 978-0387-28821-5, lire en ligne [PDF]), p. 71
- (en) P. K. Boss, C. Davies et S. P. Robinson, « Analysis of the Expression of Anthocyanin Pathway Genes in Developing Vitis vinifera L. cv Shiraz Grape Berries and the Implications for Pathway Regulation », Plant Physiology, vol. 111, no 4,
- (en) Jack Sullivan, « Anthocyanin », Carnivorous Plant Newsletter (en)(CPN) September 1998, (lire en ligne, consulté le )
- (en) SURINDER CHOPRA, ATSUSHI HOSHINO, JAYANAND BODDU et SHIGERU IIDA, « FLAVONOID PIGMENTS AS TOOLS IN MOLECULAR GENETICS, chap 6 », in Erich Grotewold "The Science of Flavonoids", Springer,
- (en) Jun-ichiro Nakajima, Yoshikazu Tanaka, Mami Yamazaki et Kazuki Saito, « Reaction Mechanism from Leucoanthocyanidin to Anthocyanidin 3-Glucoside, a Key Reaction for Coloring in Anthocyanin Biosynthesis », The Journal of Biological Chemistry, vol. 276, no 28, , p. 25797-25803 (ISSN 0021-9258 et 1083-351X, DOI 10.1074/jbc.M100744200).
- (en) Nik Kovinich, Ammar Saleem, John T. Arnason et Brian Miki, « Functional characterization of a UDP-glucose : flavonoid 3-O-glucosyltransferase from the seed coat of black soybean (Glycine max (L.) Merr.) », Phytochemistry, vol. 71, nos 11-12, , p. 1253-1263 (ISSN 0031-9422, PMID 20621794, DOI 10.1016/j.phytochem.2010.05.009).
- Poudre d'anthocyanes colorante E163 sur le site grapsud.com
Voir aussi
- Portail de la chimie
- Portail de la biochimie
- Portail de la pharmacie
- Portail de la médecine
- Portail des couleurs
