Diagrammes binaires
Un diagramme binaire est un diagramme de phase reflétant les propriétés d'équilibre d'un mélange binaire de deux corps A et B. On porte en abscisses la fraction molaire x(A) de A et en ordonnées la température en kelvins (diagrammes isobares)[1].
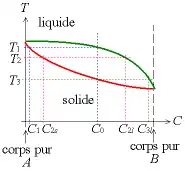
On suppose que les constituants A et B ne réagissent pas chimiquement, sont totalement miscibles à l'état liquide et forment une ou plusieurs phases à l'état solide.
Diagrammes binaires isobares
On appelle diagramme isobare un diagramme binaire dans lequel la pression est constante[2].
Description et notations
.svg.png.webp)
On prend l'exemple d'un mélange avec des composants dont les phases solides sont parfaitement miscibles pour illustrer notre propos[3].
La grandeur en ordonnée est la température thermodynamique. La grandeur portée en abscisse est la fraction molaire x(B) qui s'écrit alors . Plus on se déplace vers la droite, plus le mélange s'approche de B pur (x(A) = 0), plus on se déplace vers la gauche, plus on s'approche de A pur (x(B) = 0).
Il est important de noter la possibilité de travailler avec des fractions massiques.
Le diagramme est divisé en trois domaines : une phase liquide, une phase solide, et une phase où les deux états se mêlent. Le solidus marque l'apparition de la première goutte de liquide après augmentation de la température. Le liquidus marque l'apparition du premier cristal de solide après refroidissement.
Système diphasé
On prend un point M qui représente un mélange où les phases liquide et solide coexistent. Projeter M sur l'axe des abscisses nous donne la fraction molaire de B au point M. On imagine ensuite une droite parallèle à celle des abscisses passant par M, croisant le solidus au point S et le liquidus au point L. Leurs projetés respectifs donnent la fraction molaire de B en phase solide et liquide.
On expose alors le théorème des moments :
Pour un système diphasé soit la quantité de matière de la phase liquide et la quantité de matière de la phase solide, alors
Analyse thermique
On construit les diagrammes binaires en étudiant le refroidissement de tels systèmes : on les chauffe pour qu'ils passent entièrement sous phase liquide puis on observe l'évolution de leur température.
Si le corps est pur on observera un palier de température. Cependant si le corps est un alliage on n'observera pas de palier, mais des ruptures dans la courbe au début puis à la fin de la solidification.
Diagrammes plus complexes : les azéotropes
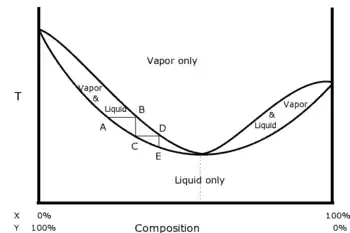
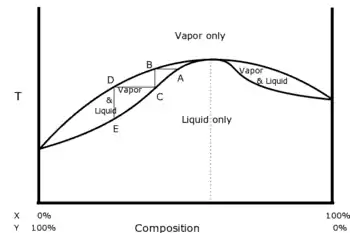
Un azéotrope est un mélange liquide-vapeur[4] tel que le liquide et la vapeur aient la même composition. Lorsque l'on fait évaporer ce mélange particulier, il garde la même composition ce qui rend les techniques de distillation simples inefficaces. Les azéotropes positifs sont particulièrement utilisés parce que très utiles : le mélange formé par les deux corps purs a une température de vaporisation inférieure à celle des deux corps.
Il est intéressant de noter que de part et d'autre de l'azéotrope les volatilités des divers composants sont inversées. Ainsi dans le mélange propanol-eau avec 10% de masse molaire de propanol, c'est le propanol qui est le plus volatil, et dans un mélange à 90% de propanol, c'est l'eau qui est la plus volatile.
Notes et références
Liens externes
- http://ressources.univ-lemans.fr/AccesLibre/UM/Pedago/chimie/01/06-Etat_solide/res/Diagrammes_de_phases.pdf
- https://nte.mines-albi.fr/Thermo/co/uc_Azeotropie.html
- Portail de la chimie
- Portail de la physique